3.2: Compuestos organometálicos de Boro y Aluminio
- Page ID
- 69276
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Preparación y reactividad de compuestos de organoboro y organoaluminio.
- Influencia de la acidez de Lewis en características estructurales
Compuestos Organoboron
BMe 3 es incoloro, gaseoso (p.e. -22 °C) y es monomérico. Es pirofórico pero no hidrolizado rápidamente por el agua.
Los alquilboranos se pueden sintetizar por metátesis entre BX 3 y compuestos organometálicos de metales con baja electronegatividad, como rMgX o AlR 3.
\[\ce{BF3 + 3CH3MgBr -> B(CH3)3 + 3MgBrF (solvent\: used: \: dibutyl\: ether)}\]
Por qué dibutil éter como disolvente: Tiene una presión de vapor mucho menor que BMe 3 y como resultado la separación por destilación trampa a trampa en una línea de vacío es fácil.
Además, existe una asociación muy débil entre BMe 3 y OBu 2 (Me 3 b:OBu 2).
Si bien, los compuestos de trialquil- y triarilboro son ácidos de Lewis suaves, los reactivos carbaniónicos fuertes conducen a aniones del tipo [BR 4] -.
Ejemplo, Na [BPh] 4: El anión voluminoso se hidroliza muy lentamente en agua neutra o básica y es útil para la preparación de cationes positivos grandes.
\[\ce{Na[BPh]4 + K+ -> K[BPh]4}\]
K [bPh] 4 es insoluble, utilizado para la estimación gravimétrica (determinación) del potasio, un ejemplo de la baja solubilidad de sales de cationes grandes y aniones grandes en agua/
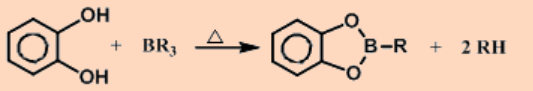
Los compuestos organohaloborones son más reactivos que los compuestos simples de trialquilboro.
Preparación:
\[\ce{2 BCl3 + 6AlR3 -> 3R2BCl + 6AlR2Cl (metathesis)}\]
\[\ce{2 BCl3 + BMe3 ->[(diborane)] 3BMeCl2 (redistribution\:reaction)}\]
Reacciones: (Reacciones de protólisis con ROH, R 2 NH y otros reactivos)
\[\ce{3BMeCl2 + 2HNR2 -> BMe2(NR2) + [R2NH2]Cl}\]
\[\ce{BMe2Cl + Li(C4H9) -> BMe2(C4H9) + LiCl}\]
Compuestos de organoaluminio
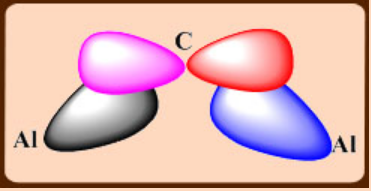
Con grupos alquilo menos voluminosos, se produce la dimerización y una de las características distintivas del puente alquilo es el pequeño ángulo de Al-C-Al, que es de ~ 75°.
Los enlaces 3c,2e son muy débiles y tienden a disociarse en el líquido puro lo que aumenta con el aumento en el volumen del grupo alquilo.
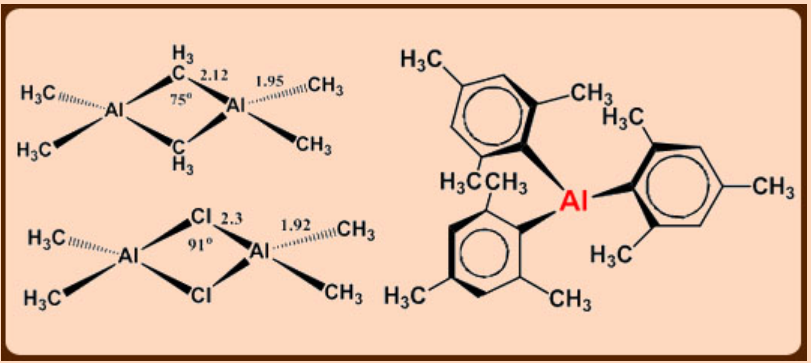
\[\ce{Al2(CH3)6 <=> 2Al(CH3)3}\]K= 1.52 x 10 -8
\[\ce{Al2(C4H9)6 <=> 2Al(C4H9)3}\]K= 2.3 x 10 -4
Orientación perpendicular de grupos feynl en Al 2 Ph 6 El
trifenilaluminio existe como un dímero con grupos puente η 1-fenilo que se encuentran en un plano perpendicular a la línea que une los dos átomos de Al.
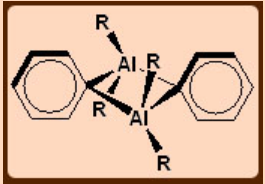
Esta estructura se ve favorecida en parte por motivos estéricos y en parte por la suplementación del enlace Al-C-Al por donación de electrones desde los orbitales de fenilo π a los átomos de Al.
Tendencia al puenteo: X > Ph > alquilo
3c,2e enlaces formados por una combinación simétrica de orbitales Al y C
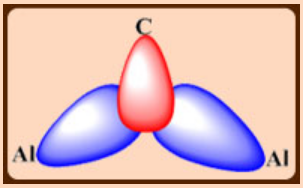
Una interacción adicional entre el orbital pπ en C y una combinación antisimétrica de orbitales Al.
Síntesis
Muy útil como catalizadores de polimerización de alquenos e intermedios químicos.
Reactivos carbaniónicos caros para la sustitución de grupos orgánicos halógenos por metátesis.
Las preparaciones a escala de laboratorio implican:\[\ce{2Al + 3Hg(CH3)2 -> Al2(CH3)6 + 3Hg}\]
Método comercial:\[\ce{2Al + CH3Cl -> Al2Cl2(CH3)4}\]
\[\ce{Al2Cl2(CH3)4 + 6Na -> Al2(CH3)6 + 2Al + 6NaCl}\]
Método comercial para etilaluminio y homólogos superiores:\[\ce{2Al + 3H2 + 6RHC=CH2 ->[60-110°C][110-200atm] 2Al2(CH2CH2R)6}\]
La reacción probablemente procede por la formación de una especie de superficie Al-H que se suma a través del doble enlace del alqueno en una reacción de hidrometalación.
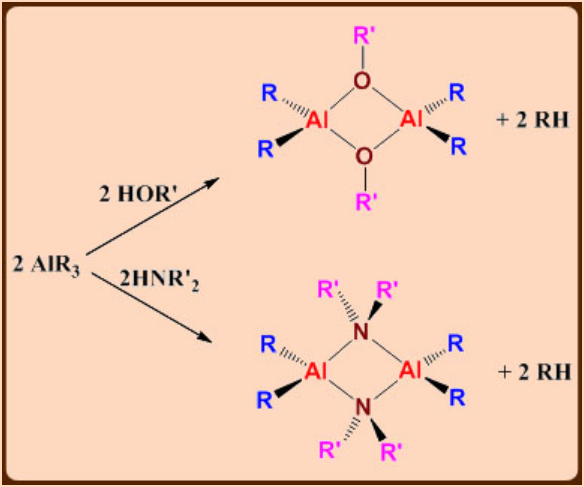
Reacciones:
Los compuestos de alquilaluminio son ácidos de Lewis suaves y forman complejos con éteres, aminas y aniones. Cuando se calienta, a menudo la eliminación de β-hidrógeno es responsable de la descomposición de compuestos etílicos y alquilaluminio superiores. Por ejemplo Al (i C 4 H 9) 3 La
tendencia hacia la estructura puente es: PR 2 - > X - > H - > Ph - > R -.
Problemas:
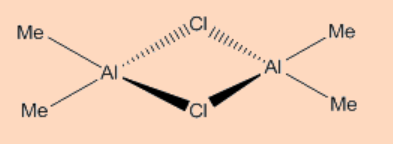
1. Proponer una estructura para Al 2 (Me) 4 Cl 2.
Solución:
Similar al diborano:
2. Para estos compuestos (H 3 Si) 2 O y (CH 3 CH 2) 2 O, ¿cuáles esperas que tengan la constante de fuerza menor, flexión Si-O-Si o flexión C-O-C?
Solución:
Menor constante de fuerza para flexión Si-O-Si.
3. Explicar cómo la diferencia de reactividad entre los enlaces Al-C y Si-C con los grupos O-H conduce a la elección de diferentes estrategias para la síntesis de alcóxidos de aluminio y silicio.
Solución
\[\ce{Al2Me6 + 6MeOH -> 2Al(OMe)3 + 6CH4}\]
Para la reacción de Al 2 Me 6 con alcoholes, consulte el libro de texto de Shriver y Atkins.
El tetrametilsilano no reacciona con el alcohol metílico. Por lo tanto, el reactivo apropiado es tetraclorosilano y la reacción es:
\[\ce{SiCl3 + 4MeOH -> Si(OMe)4 + 4HCl}\]
4. Comparar fórmulas de los compuestos de hidrógeno más estables de germanio y arsénico con las de sus compuestos metílicos. ¿Se pueden explicar las diferencias en términos de las electronegatividades relativas de C y H?
Solución
GeH 4, GeR 4; aSH 3, ASr 3
La estabilidad de hidruros y alquilos es muy similar para cada elemento. Esto puede deberse a una electronegatividad similar de H y C.
5. Para comprar a una compañía química, el precio del trimetilaluminio es mayor que el del trietilaluminio. ¿Se debe a los métodos de síntesis? Racionalizar la diferencia de precio.
Solución: El
trietilaluminio se puede hacer en grandes cantidades por reacción directa de aluminio, gas hidrógeno y etano gas que es un método más económico.
\[\ce{2Al + 3H2 + 6RHC=CH2 ->[60-110°C][110-200atm] 2Al2(CH2CH2R)6}\]
La preparación del trimetialuminio implica una ruta más cara como el MeCl y el aluminio para formar Al 2 Me 4 Cl 2 seguido de tratamiento con sodio metálico. El metal de sodio y el MeCl no son baratos en comparación con el etano y los gases de hidrógeno.
\[\ce{2Al + CH3Cl -> Al2Cl2(CH3)4}\]
\[\ce{Al2Cl2(CH3)4 + 6Na -> Al2(CH3)6 + 2Al + 6NaCl}\]


