4.3: Fosfinas
- Page ID
- 69111
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Clasificación de ligandos.
- Naturaleza de la unión en fosfinas.
- Propiedades estéricas y electrónicas de las fosfinas.
- Adhesión en fosfinas y CO.
- Ángulo de cono y su aplicación en catálisis.
Clasificación de Ligandos por átomos donantes
El ligando es una molécula o un ion que tiene al menos un par de electrones que puede ser donado. Los ligandos también pueden llamarse bases de Lewis; en términos de química orgánica, son 'nucleófilos'.
Los iones metálicos o moléculas como BF 3 (con capas de electrones de valencia incompleta (deficientes en electrones) se denominan ácidos de Lewis o electrófilos).
Por qué moléculas como H 2 O o NH 3 dan complejos con iones tanto del grupo principal como de metales de transición. Por ejemplo [Al (OH 2) 6] 3+ o [Co (NH 3) 6] 3+
Por qué otras moléculas como PF 3 o CO dan complejos solo con metales de transición.
Aunque PF 3 o CO dan moléculas neutras como Ni (PF 3) 4 o Ni (CO) 4 o Cr (CO) 6.
Por qué, NH 3, aminas, donantes de oxígeno, etc., no dan complejos como Ni (NH 3) 4.
Ligandos donadores clásicos o simples
Actuar como donantes de pares de electrones a iones o moléculas aceptoras, y formar complejos de todo tipo de ácidos de Lewis, iones metálicos o moléculas.
Ligandos no clásicos, ligandos π-bonding o π-ácidos: Se forman en gran parte con átomos de metal de transición.
En este caso se produce una interacción especial entre los metales y ligandos.
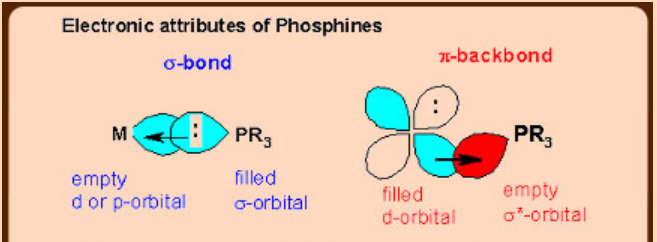
Estos ligandos actúan tanto como donadores σcomo aceptores πdebido a la disponibilidad de orbitales vacíos de simetría adecuada, y energías comparables con las del metal t 2g ( no vinculantes) orbitales.
Por ejemplo, considere PR 3 y NH 3: Ambos pueden actuar como bases hacia H +, pero el átomo de P difiere de N en que PR 3 tiene σ* orbitales de baja energía, mientras que en N la energía más baja d orbitales o σ* orbitales son demasiado altos en energía para usar.
Considere el CO que no tiene basicidad medible para protones, pero reacciona fácilmente con metales como el Ni que tienen altos calores de atomización para dar compuestos como Ni (CO) 4.
Los ligandos también pueden clasificarse electrónicamente dependiendo de cuántos electrones contribuyan a un átomo central. Los átomos o grupos que pueden formar un solo enlace covalente son donadores de un electrón.
EJEMPLOS: F, SH, CH 3 etc.,
Los compuestos con un par de electrones son donantes de dos electrones
EJEMPLO: NH 3, H 2 O, PR 3 etc.,
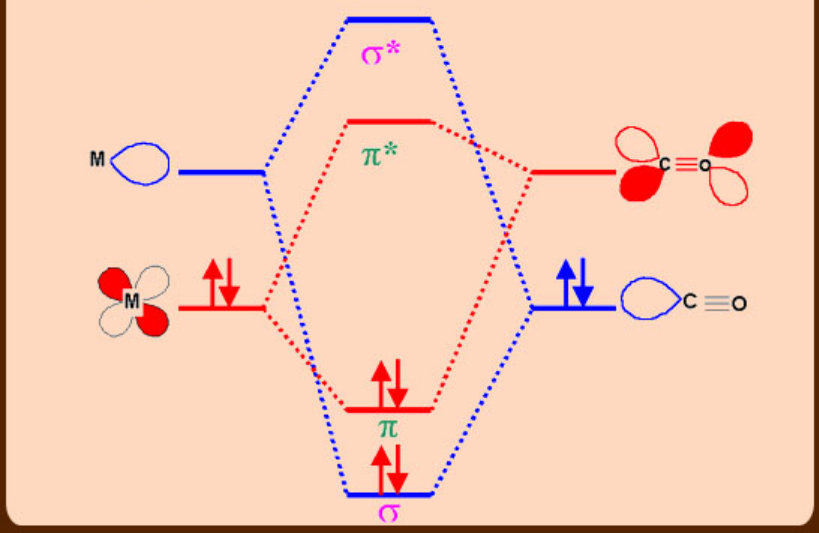
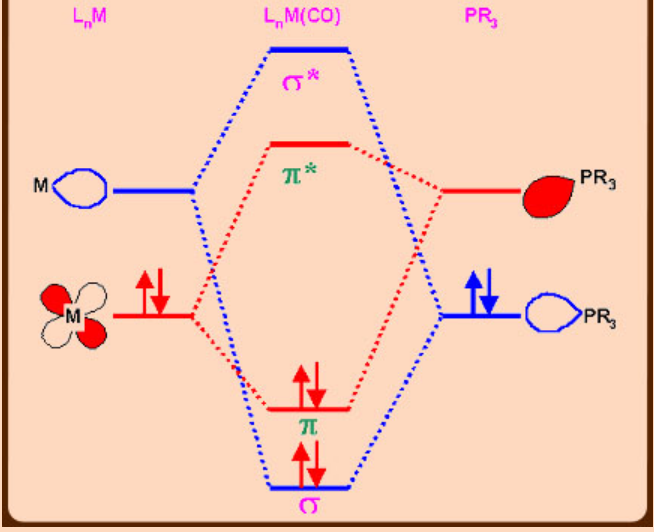
Adhesión en Metal-Carbonilo y Metal-Fosfinas
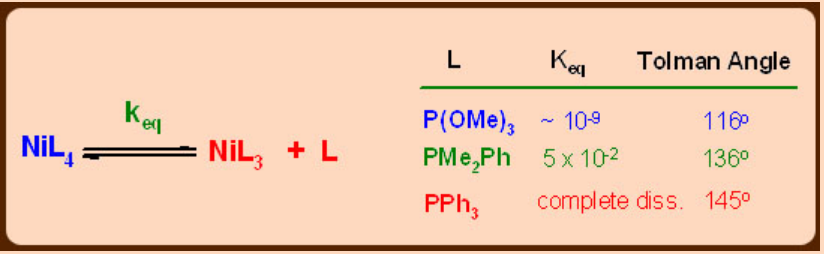
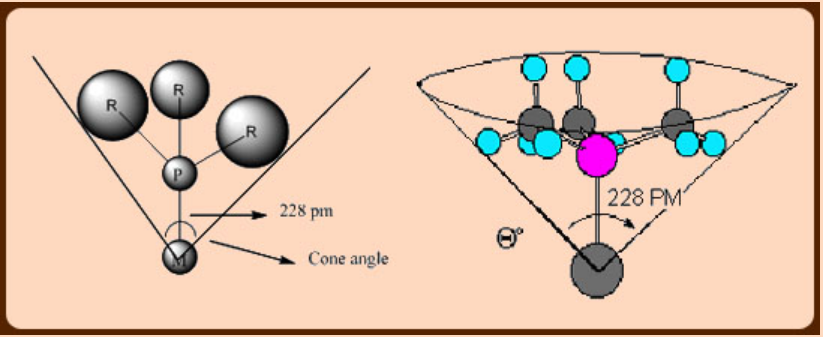
Factores estéricos en fosfinas (ángulo del cono de Tolman)
El ángulo del cono es muy útil para evaluar las propiedades estéricas de las fosfinas y su comportamiento de coordinación.
El efecto electrónico de las fosfinas puede evaluarse mediante datos espectroscópicos IR y RMN, especialmente cuando los carbonilos son co-ligandos. En un complejo metálico que contiene tanto fosfinas como carbonilo, las frecuencias de ν (CO) revelarían las capacidades de donador o π—aceptor de las fosfinas. Si las fosfinas empleadas son donadores σfuertes, entonces se movería más densidad de electrones de M (t 2g orbitales) - π* (CO) y como resultado, se observa una disminución en el ν (CO). Por el contrario, si una fosfina dada es un donador de σpobre pero un aceptor π fuerte, entonces la fosfina (σ*-orbitales) también compite con el CO por la unión posterior, lo que resulta en una menor disminución en la frecuencia de ν (CO).
Otro aspecto importante es el tamaño estérico de los ligandos de PR 3, a diferencia del caso de los carbonilos, que se pueden ajustar fácilmente cambiando el grupo R. Esto es de gran ventaja en la química de metales de transición, especialmente en la catálisis mediada por metales, donde la estabilización de los metales en estados de baja coordinación es muy importante además de los estados de baja oxidación. Esta condición puede promover la adición oxidativa en el centro del metal, lo cual es un paso importante en la catálisis homogénea. Los efectos estéricos de las fosfinas se pueden cuantificar con el ángulo de cono de Tolman.
El ángulo del cono se puede definir como un ángulo sólido en el metal a una distancia M-P de 228pm que encierra las superficies de van der Waal de todos los átomos de ligando o sustituyentes en todas las orientaciones rotacionales. Los ángulos de cono para las fosfinas más utilizadas se enumeran en la siguiente tabla.
|
Fosfina |
Ángulo de cono (°) |
|
PH 3 |
87 |
|
PF 3 |
104 |
|
P (OMe) 3 |
107 |
|
PMe 3 |
118 |
|
PMe 2 Ph |
122 |
|
PET 3 |
132 |
|
PPh 3 |
145 |
|
PCy 3 |
170 |
|
P (Bu t) 3 |
182 |
|
P (mesitilo) 3 |
212 |
Fosfinas con diferentes ángulos de cono versus número de coordinación para metales del grupo 8:
|
ML 4 |
ML 3 |
ML 2 |
|
(Me 3 P) 4 Ni |
||
|
(Me 3 P) 4 Pd |
||
|
(Me 3 P) 4 Pt |
(Ph 3 P) 3 Pt |
(Tert-Bu 3 P) 2 Pt |
Ángulo Tolman y Catálisis
Se pueden usar ligandos de fosfina estéricamente exigentes para crear un sitio de coordinación vacío (16 complejos VE) que es un truco importante para afinar la actividad catalítica de los complejos de fosfina.