6.1:18 Regla de electrones de valencia
- Page ID
- 69070
Objetivos de aprendizaje
En esta sección aprenderás lo siguiente
- Tener una idea sobre la estabilidad de los complejos de metales de transición con respecto a su recuento de electrones de valencia total.
- Estar al tanto de los complejos de metales de transición que obedecen o no obedecen a la Regla del Electrón de 18 Valencias.
- Tener una apreciación del recuento de electrones de valencia en los complejos organometálicos de metales de transición que surgen de las interacciones orbitales metal-ligando.
Los compuestos organometálicos de metales de transición presentan diversas variaciones estructurales que se manifiestan en diferentes propiedades químicas. Muchos de estos compuestos organometálicos de metales de transición son principalmente de interés por las perspectivas de catálisis química. A diferencia del grupo principal de compuestos organometálicos, que utilizan principalmente orbitales ns y np en la unión química, los compuestos de metales de transición utilizan regularmente los orbitales (n−1) d, ns y np para la unión química (Figura\(\PageIndex{1}\)). El llenado parcial de estos orbitales hace que estos centros metálicos tengan capacidades tanto donadoras como aceptoras de electrones, lo que les permite participar en interacciones sinérgicas σ-donador/n-aceptor con ligandos donante-aceptor como carbonilos, carbenos, arenos, isonitrilos y etc,.
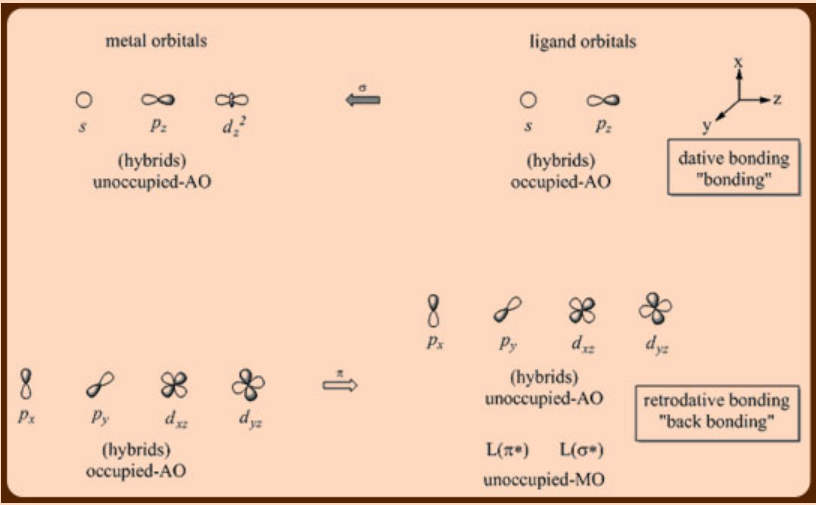
La regla del electrón de valencia 18 (18 VE) o la regla del gas inerte o la regla del número atómico efectivo (EAN): La regla del electrón de 18 valencia (VE) establece que los compuestos de metales de transición termodinámicamente estables contienen 18 electrones de valencia que comprenden del metal d electrones más los electrones suministrado por los ligandos unidos a metal. El conteo de los 18 electrones de valencia en los complejos de metales de transición se puede obtener siguiendo cualquiera de los dos métodos de conteo de electrones, (i). el método iónico y (ii). el método neutro. Tenga en cuenta que un enlace metal-metal contribuye con un electrón al recuento total de electrones del átomo de metal. Un ligando puente dona un electrón hacia el átomo de metal puente.
Fe ferroceno (C 5 H 5) 2

Mn 2 (CO) 10

Los compuestos organometálicos de metales de transición pertenecen principalmente a cualquiera de las tres categorías.
- Complejos de clase I para los cuales el número de electrones de valencia no obedecen a la regla de 18 VE.
- Complejos de Clase II para los cuales el número de electrones de valencia no exceda de 18.
- Complejos de clase III para los cuales los electrones de valencia obedecen exactamente a la regla 18 VE.
El principio rector que rige la clasificación de los compuestos organometálicos de metales de transición se basa en la premisa de que los orbitales antiadherentes no deben ser ocupados; los orbitales no enlazantes pueden estar ocupados mientras que los orbitales de unión deben estar ocupados.
Clase I
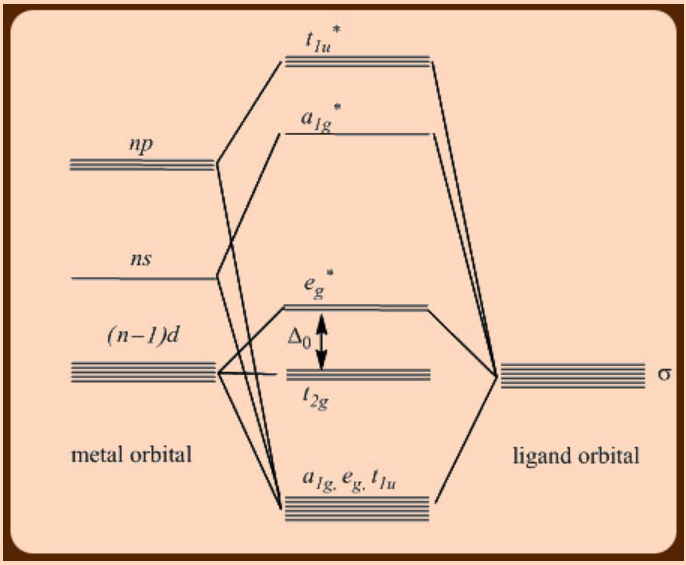
En los complejos de clase I, la división Δ o es pequeña y a menudo se aplica a metales 3d y ligandos σ en el extremo inferior de la serie espectroquímica. En este caso, el orbital t 2g es de naturaleza no enlazante y puede estar ocupado por 0-6 electrones (Figura\(\PageIndex{2}\)). El orbital e g * es débilmente antienlace y puede estar ocupado por 0-4 electrones. Como consecuencia, se puede obtener un recuento de electrones de valencia de 12−22 para esta clase de compuestos. Debido a la pequeña energía de división de tetr δ, los complejos tetraédricos de metales de transición también pertenecen a esta clase.
Clase II
En los complejos de clase II, la división Δ o es relativamente grande y es aplicable a metales de transición 4d y 5d con alto estado de oxidación y para ligandos σ en el rango intermedio y superior de la serie espectroquímica. En este caso, el orbital t 2g es esencialmente de naturaleza no enlazante y puede llenarse con 0-6 electrones (Figura 3). El orbital e g * es fuertemente antiadherentes y no está ocupado en absoluto. En consecuencia, el recuento de electrones de la capa de valencia de este tipo de complejos sería así de 18 electrones o menos.
Clase III
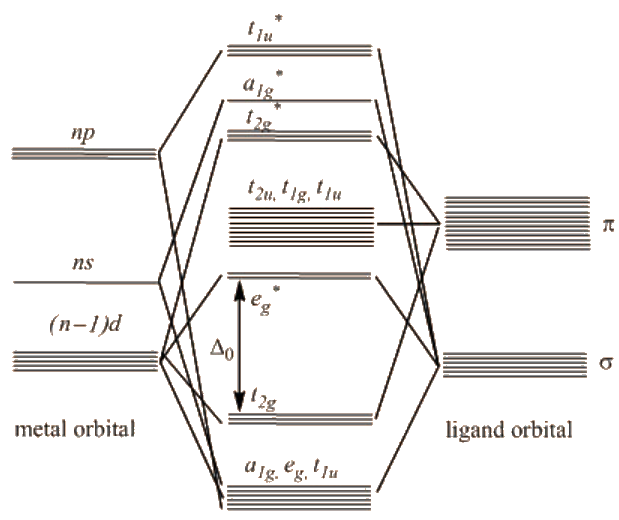
En los complejos de clase III, la división Δ o es la más grande y es aplicable a buenos ligandos donadores σ y aceptores π como CO, PF 3, olefinas y arenos ubicados en el extremo superior de la serie espectroquímica.
El orbital t 2g se une debido a las interacciones con los orbitales del ligando y debe estar ocupado por 6 electrones. El orbital e g * es fuertemente antiadherentes y por lo tanto permanece desocupado.
Problemas
Declarar el estado de oxidación del metal y el recuento de electrones de valencia total de las siguientes especies.
1. V (C 2 O 4) 3 3−
Ans: +3 y 14
2. Mn (acac) 3
Ans: +3 y 16
3. W (CN) 8 3−
Ans: +5 y 17
4. CPMn (CO) 3
Ans: 0 y 18
5. Fe 2 (CO) 9
Ans: 0 y 18
Prueba de autoevaluación
Declarar el estado de oxidación del metal y el recuento de electrones de valencia total de las siguientes especies.
1. TiF 6 2 -
Ans: +4 y 12
2. Ni (es) 3 2+
Ans: +2 y 20
3. Cu (NH 3) 6 2+
Ans: +2 y 21
4. W (CN) 8 4-
Ans: +4 y 18
5. CH 3 Co (CO) 4
Ans: 0 y 18
Resumen
Los complejos de metales de transición pueden clasificarse en los siguientes tres tipos.
- Los que no obedecen la regla del electrón de valencia 18 son de tipo clase I
- Los que no superan la regla de 18 electrones de valencia son de clase II y
- Los que siguen estrictamente la regla de los 18 electrones de valencia.
Dependiendo de la interacción de los orbitales metálicos con los orbitales del ligando y también de la naturaleza de la posición del ligando en series espectroquímicas, los compuestos organometálicos de metales de transición se pueden formar en cualquiera de las tres categorías.


