6.2: Síntesis y Estabilidad
- Page ID
- 69067
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Comprender el papel liderado por los ligandos en la estabilización de complejos organometálicos de metales de transición.
- Conocer los diversos métodos sintéticos disponibles para la preparación de los complejos organometálicos de metales de transición.
- Comprender los diversos factores como β-eliminación y otras vías de descomposición bimolecular que contribuyen a la inestabilidad observada de los complejos organometálicos de metales de transición.
- Obtener información sobre la fabricación de complejos organometálicos estables de metales de transición mediante la supresión de los factores desestabilizadores mencionados.
Los ligandos juegan un papel vital en la estabilización de complejos de metales de transición. La estabilidad así como la reactividad de un metal en su forma compleja dependen así del número y del tipo de ligandos a los que se une. En este sentido, los ligandos organometálicos basados en carbono vienen en diversas variedades mostrando una amplia gama de modos de unión a un metal. En general, los modos de unión de los ligandos derivados de carbono dependen del estado de hibridación del átomo de carbono unido a metal. Por lo tanto, estos ligandos pueden unirse a un metal de muchas maneras diferentes como se representa a continuación. Por último, estos ligandos pueden ser de (a) tipo puramente donador o dependiendo de la capacidad del ligando para formar los enlaces múltiples también pueden ser de (b) un tipo de donador/n-aceptor, en el que la interacción σ-se complementa con un grado variable de interacción p-.
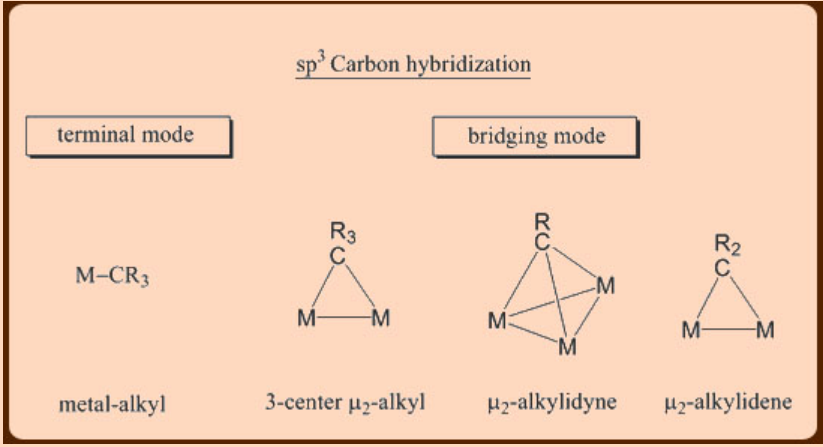
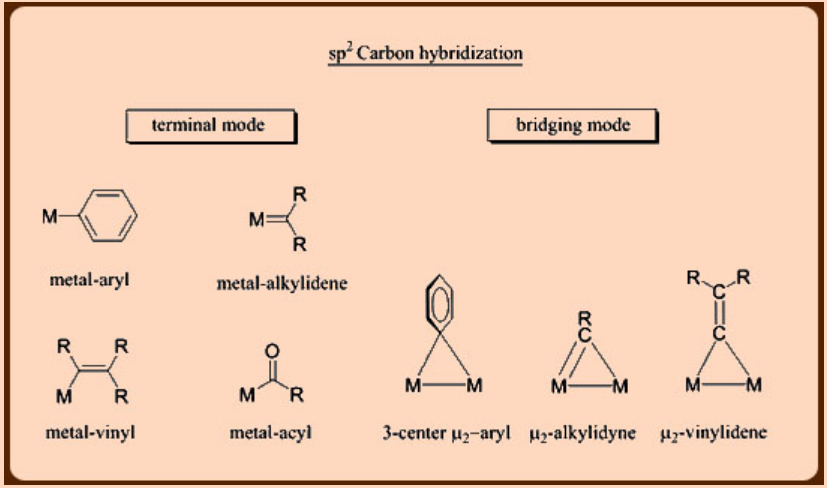
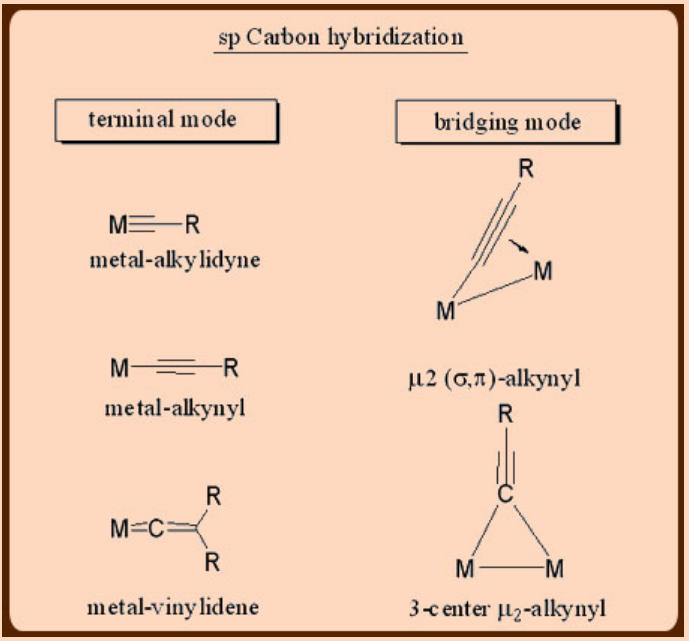
Preparación de complejos de metal de transición-alquilo y metal de transición-arilo
Los complejos de metal de transición-alquilo y arilo de metal de transición se preparan normalmente mediante las siguientes rutas que se analizan a continuación:
a. Metátesis
Esto implica las reacciones de haluros metálicos con reactivos de organolitio, organomagnesio, organoaluminio, organoestaño y organozinc.
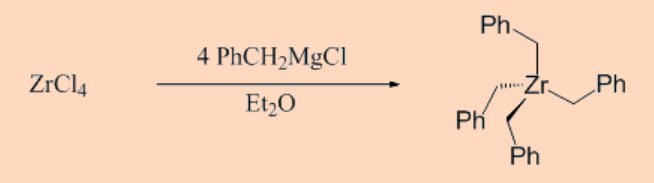
De los diferentes compuestos organoalquílicos enumerados anteriormente, los compuestos de organolitio y organomagnesio son fuertemente carbaniónicos, mientras que los organometálicos del grupo principal restante como los reactivos de organoalquilo, organozinc y organoestaño son relativamente menos carbaniónicos por naturaleza. Así, los reactivos organometálicos del grupo principal tienen un poder alquilante atenuado, que puede ser utilizado productivamente en el intercambio parcial de ligandos haluro.
\[\ce{TiCl4 ->[Al2Me6] MeTiCl3}\]
\[\ce{NbCl5 ->[ZnMe2] Me2NbCl3}\]
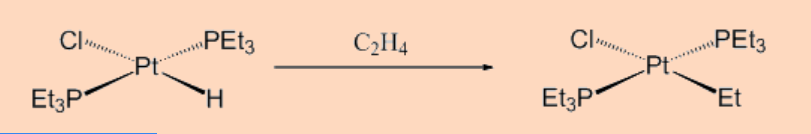
b. Inserción de alquenos o Hidrometalación
Como su nombre lo indica, esta categoría de reacción implica una reacción de inserción entre hidruro metálico y alqueno como se muestra a continuación. Este tipo de reacciones son relevantes para ciertos procesos catalíticos homogéneos en los que a menudo se observa la inserción de una olefina a un enlace M-H.
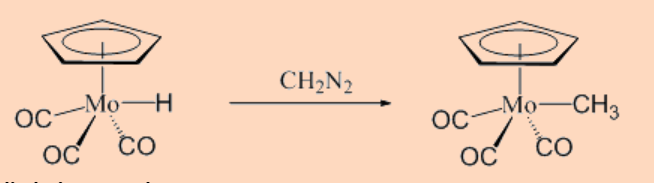
c. Inserción de carbeno
Esta categoría representa la reacción de hidruros metálicos con carbenos.
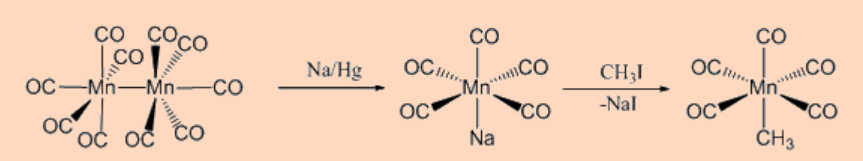
d. Reacción de alquilación de metalato
Esta categoría representa la reacción de aniones carbonilato con haluros de alquilo como se muestra a continuación.
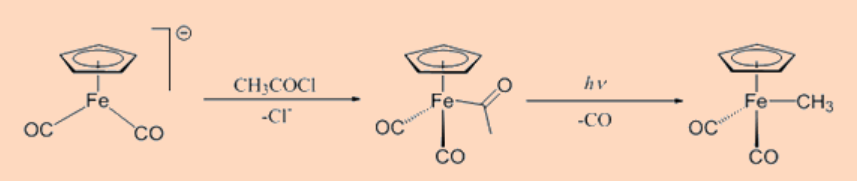
e. Reacción de acilación de metalato
Esta categoría implica la reacción de aniones carbonilato con haluros de acilo
f. Reacción de adición oxidativa
Muchos complejos de metales de transición de 16 VE insaturados que tienen configuración d 8 o d 10 experimentan reacciones de adición oxidativa con haluros de alquilo. Las reacciones de adición oxidativa proceden con el estado de oxidación así como el número de coordinación del metal aumentando en +2.
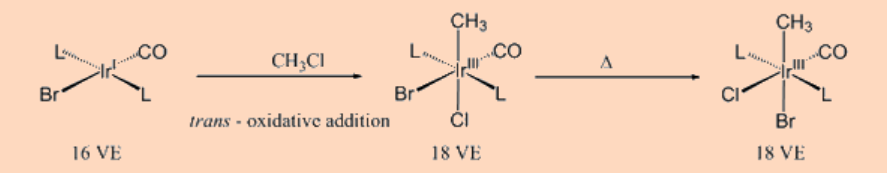
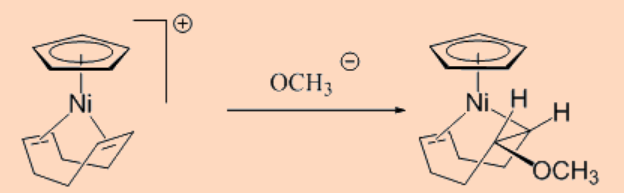
g. Reacción de adición
Esta categoría implica la reacción de un complejo de olefina unida a metal activado con un nucleófilo como se muestra a continuación.
Estabilidad termodinámica y labilidad cinética
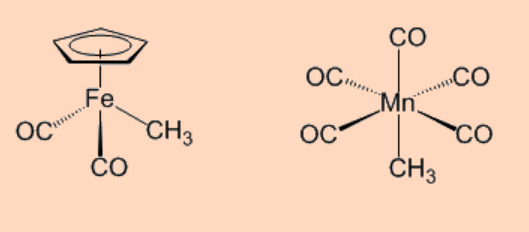
Los compuestos organometálicos de metales de transición a menudo son difíciles de sintetizar en condiciones normales de laboratorio y requieren estrictos protocolos experimentales que implican la exclusión de aire y humedad para hacerlo. Como consecuencia, muchos compuestos binarios homolépticos de metales de transición−alquilo y metales de transición−arílicos como, Et 2 Fe o Me 2 Ni, no se pueden preparar en condiciones normales de laboratorio. Lo más interesante es que la mayoría de los ejemplos de compuestos de metal de transición−arilo y metal de transición—alquilo, conocidos en la literatura, contienen invariablemente ligandos adicionales como η 5-C 5 H 5, CO, PR 3 o haluros.
Por ejemplo,
Los valores de energía de enlace de metal de transición−carbono (TM-C) son importantes para comprender la inestabilidad de los compuestos organometálicos de metales de transición. En general, los enlaces TM-C son más débiles que los enlaces de metal de transición-elemento del grupo principal (TM-MGE) (MGE = F, O, Cl y N) y lo más interesante es que, a diferencia de las energías de enlace TM-MGE, los valores de energía del enlace TM-C aumentan al aumentar el número atómico. Los efectos estéricos de los ligandos también juegan un papel crucial en la influencia de las energías de enlace TM-C y, por lo tanto, deben ser considerados debidamente.
Contrariamente a la creencia popular, la dificultad para obtener complejos de metal de transición—arilo y metal de transición—alquilo surge principalmente de las razones termodinámicas pero más bien de las cinéticas. La β−eliminación es, con mucho, el mecanismo de descomposición más general que contribuye a la inestabilidad de la transición compuestos organometálicos metálicos. β−eliminación da como resultado la formación de hidruros metálicos y olefinas como se muestra a continuación.
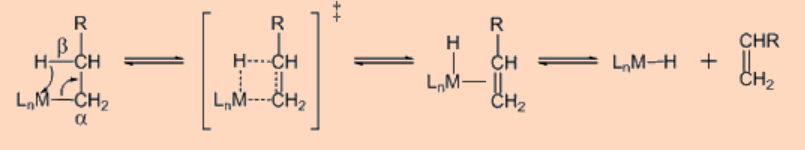
La β−eliminación también puede ser reversible como se muestra a continuación.
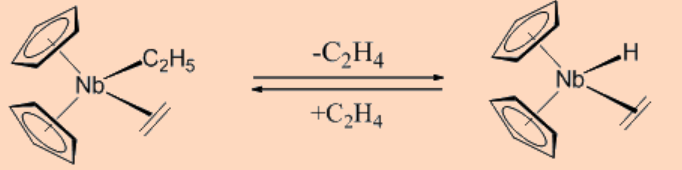
La inestabilidad de los compuestos organometálicos de metales de transición puede surgir de la labilidad cinética como en el caso de las reacciones de β−eliminación que desencadenan la descomposición de estos complejos. Así, la supresión de las reacciones de descomposición proporciona una opción viable para la estabilización de los complejos organometálicos de metales de transición. Las reacciones de β−eliminación en complejos organometálicos de metales de transición pueden ser suprimidas bajo cualquiera de las siguientes tres condiciones.
a. La formación de la olefina saliente se vuelve estérica o energéticamente desfavorable
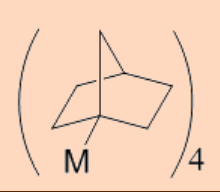
En el curso de la β−eliminación, esta situación surge cuando el enlace olefínico se forma en un átomo de carbono de cabeza de puente o cuando se forma un doble enlace con los elementos de periodos superiores. Por ejemplo, el grupo norbornilo es menos propenso a la descomposición por β−eliminación porque eso requeriría la formación de doble enlace olefínico en un átomo de carbono de cabeza de puente en la olefina posterior, es decir, norborneno, y que es energéticamente desfavorable.
b. Ausencia de átomo de hidrógeno β en ligandos orgánicos Los ligandos unidos a metales de
transición que no poseen β−hidrógeno no pueden descomponerse por la vía de β−eliminación y, por lo tanto, tales complejos son generalmente más estables que los que contienen átomos de β−hidrógeno. Por ejemplo, el complejo neopentilo, Ti [CH 2 C (CH 3) 3] 4 (m.p 90 °C), y el complejo bencílico, Zr (CH 2 Ph) 4 (m.p. 132 °C), presentan mayor estabilidad térmica ya que ambos ligandos neopentilo y bencilo carecen de β−hidrógenos.
c. El átomo de metal central está saturado coordinadamente Los complejos organometálicos de metales de
transición en los que el átomo metálico central está saturado coordinadamente tienden a ser más estables debido a la falta de espacio de coordinación disponible alrededor del centro del metal para facilitar la reacción de β−eliminación u otras reacciones de descomposición. Por lo tanto, la ausencia de sitios de coordinación libres en el metal es crucial para mejorar la estabilidad de los complejos organometálicos de metales de transición. Por ejemplo, el Ti (Me) 4, que está coordinadamente insaturado puede sufrir una reacción de descomposición bimolecular a través de un intermedio binuclear (A), es inestable y presenta una temperatura de descomposición de —40 °C; por el contrario, Pb (Me) 4, que no puede sufrir descomposición por tal vía bimolecular, es más estable y destila a 110 °C a 1 bar de presión atmosférica.
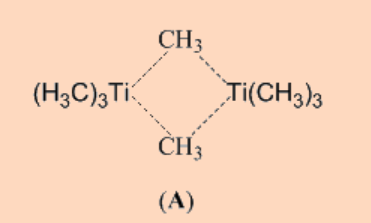
El Ti (Me) 4 se descompone por dimerización implicando la formación de enlaces Ti−C (3c−2e). Para Pb (Me) 4, dicha vía de descomposición bimolecular no es factible, ya que al ser un elemento del grupo principal tiene mayor d orbital exterior para extender el número de coordinación. Si el sitio de coordinación libre de Ti (Me) 4 es bloqueado por otro ligando, como en [(bipy) Ti (Me) 4], entonces la estabilidad térmica del complejo, [(bipy) Ti (Me) 4], aumentó significativamente. Otros ligandos quelantes bidentados como el bis (dimetilfosfano) etano (dmpe) también sirven para el mismo propósito.
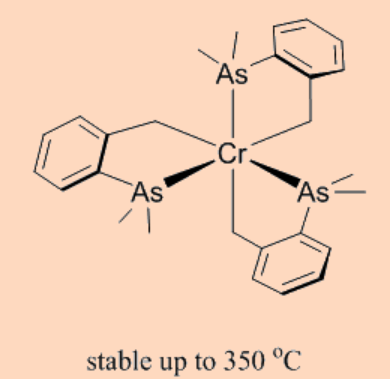
La saturación coordinativa trae así la estabilización cinética en los complejos. Por ejemplo, Ti (Me) 4 es extremadamente reactivo ya que es insaturado coordinadamente, mientras que W (Me) 4 es relativamente inerte por razones de estar blindado estéricamente y por lo tanto, saturado coordinadamente. Así, si se atienden todos los criterios antes discutidos para la supresión de β-eliminación, entonces se pueden obtener complejos organometálicos extremadamente estables como el que se muestra a continuación.
Problemas
1. Organizar los siguientes compuestos en el orden de su estabilidad.
- Ti (Et) 4
- Ti (Me) 4 y
- Ti (6-norbornilo) 4
Respuesta: Ti (Et) 4 < Ti (Me) 4 < Ti (6-norbornyl) 4
2. Predecir el producto de la reacción dada a continuación.
\[\ce{(BuP)CuCH2CD2C2H5 -> }\]
Ans: Cantidades molares equi de (Bu 3 P) CuD y CH 2 =CDC 2 H 5
3. ¿El compuesto β-eliminará,
\[\ce{PtH(C≡CH)L2 ->[\Beta -elimination] }\]
(a). fácilmente, (b). lentamente y (c). en absoluto.
Explica tu respuesta con el razonamiento adecuado.
Respuesta: En absoluto, ya que los ß-hidrógenos están apuntando lejos del metal y no pueden participar en la recación de ß-eliminación.
Prueba de autoevaluación
1. Escriba el (los) producto (s) de las reacciones.
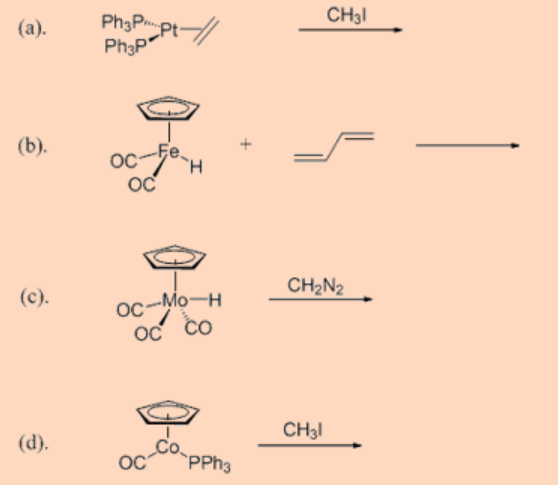
Ans:
Resumen
Los ligandos asumen un papel fundamental en la estabilización de los complejos organometálicos de metales de transición. Existen varios métodos disponibles para la preparación de los complejos organometálicos de metales de transición. La inestabilidad observada de los complejos organometálicos de metales de transición puede atribuirse a dos fenómenos principales, a saber, β-eliminación y reacción de descomposición bimolecular que socavan severamente la inestabilidad de estos complejos. La supresión de estas vías de descomposición allanó así el camino para la obtención de complejos organometálicos de metales de transición altamente estables.


