7.2: Hidruros Metálicos
- Page ID
- 69158
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Conocer los hidruros metálicos, su síntesis, caracterización y su reactividad.
- Conocer los complejos σ−y sus propiedades.
- Conoce los complejos de dihidrógeno de metales de transición.
Los hidruros metálicos ocupan un lugar importante en la química organometálica de metales de transición, ya que los enlaces M−H pueden experimentar reacciones de inserción con una variedad de sustratos orgánicos insaturados que producen numerosos compuestos organometálicos con enlaces M-C. No solo los hidruros metálicos son necesarios como reactivos sintéticos para preparar los compuestos organometálicos de metales de transición, sino que también son necesarios para importantes etapas de inserción de hidruro en muchos procesos catalíticos. El primer compuesto hidruro de metal de transición fue reportado por W. Heiber en 1931 cuando sintetizó Fe (CO) 4 H 2. Aunque afirmó que el Fe (CO) 4H 2 contenía enlace Fe-H, no fue aceptado hasta la década de 1950, cuando el concepto de enlace M−H covalente normal fue ampliamente reconocido.
Los restos de hidruro metálico son fácilmente detectables en 1H NMR ya que aparecen un alto campo de TMS en la región entre 0 y 60 ppm, donde no aparecen otras resonancias. Los restos hidruro generalmente se acoplan con centros metálicos que poseen espines nucleares. De manera similar, los restos hidruro también se acoplan con los ligandos de fosfina unidos a metal adyacentes, si están presentes en el complejo, presentando constantes de acoplamiento características cis (J = 15 − 30 Hz) y trans (J = 90 − 150 Hz). En la espectroscopia IR, las frecuencias M−H aparecen entre (1500 − 2200) cm −1 pero sus intensidades son en su mayoría débiles. La detección cristalográfica del resto de hidruro metálico es difícil ya que los átomos de hidrógeno en general son pobres dispersores de rayos X. Ubicada adyacente a un átomo de metal en un enlace M-H, la detección del átomo de hidrógeno se vuelve desafiante y, como consecuencia, el método cristalográfico de rayos X subestima sistemáticamente la distancia internuclear M−H en ~ 0.1 Å. Sin embargo, se podrían obtener mejores datos realizando los estudios de difracción de rayos X a baja temperatura en la que el movimiento térmico de los átomos se reduce significativamente. A la luz de estos hechos, la difracción de neutrones se convierte en un método poderoso para la detección de los restos de hidruro metálico ya que el hidrógeno dispersa neutrones de manera más efectiva y, por lo tanto, las distancias de enlace M−H se pueden medir con mayor precisión Una limitación del método de difracción de neutrones es que se requieren cristales de gran tamaño para el estudio.
Síntesis
Las siguientes reacciones se emplean para sintetizar hidruros metálicos.
i. Reacciones de protonación
Para que ocurra esta reacción el centro metálico tiene que ser básico y rico en electrones.
\[\ce{[Fe(CO)4]^{-2} ->[H+] [HFe(CO)4]^{-} ->[H+] H2Fe(CO)4}\]
ii. De donantes de hidruro
Generalmente para este método, se hace reaccionar un hidruro del grupo principal con haluro metálico.
\[\ce{WCl6 + LiBEt3H + PR3 -> WH6(PR3)3}\]
iii. Uso de adición de dihidrógeno (H 2)
Este método implica la adición oxidativa de H 2 y por lo tanto requiere centros metálicos que sean capaces de someterse a la etapa de adición oxidativa.
\[\ce{WMe6 + PMe2Ph ->[H_{2}] WH6(PMe2Ph)3}\]
iv. A partir de un ligando
Este método toma en cuenta la β-eliminación que se produce en una variedad de restos de ligando unidos a metal, produciendo así un enlace M-H.
\[\ce{RuCl2(PPh3)3 + KOCHMe2 + PPH3 -> RuH2(PPh3)4 + Me2CO + KCl}\]
Reacciones de hidruros metálicos
Los hidruros metálicos son especies reactivas cinéticamente y por lo tanto participan en una variedad de transformaciones como las que se discuten a continuación.
i. Reacciones de desprotonación
La reacción de desprotonación se puede lograr mediante un resto hidruro dando como resultado la formación de gas H 2 como se muestra a continuación.
\[\ce{WH6(PMe3)3 + NaH -> Na[WH5(PMe3)3] + H2}\]
ii. Transferencia e inserción de hidruro
En esta reacción se observa una transferencia de hidruro desde un centro metálico a formaldehído que da como resultado la formación de un resto metoxi unido a metal como se muestra a continuación.
\[\ce{Cp2*ZrH2 + CH2O -> Cp2*Zr(OMe)2}\]
iii. Reacción de transferencia de hidrógeno
A continuación se da un ejemplo de reacción de transferencia de átomos de hidrógeno.
\[\ce{[Co(CN)5H]^{3-} + PhCH=CHCOOH -> [Co(CN)5]^{3-} + PHCH-CH2COOH}\]
Es interesante señalar que la naturaleza del átomo de hidrógeno en un enlace M-H puede variar de ser de naturaleza prótica, cuando se une a centros metálicos deficientes en electrones como en compuestos carbonílicos metálicos, a la de ser de naturaleza hídrida, cuando se une a metales de transición tempranos más electropositivos. En este último caso, los restos hidruro tienden a ser básicos y exhiben reacciones de transferencia de hidruro con electrófilos como aldehídos o cetonas. Además, la protonación de estos hidruros metálicos básicos conduce a la eliminación del gas dihidrógeno (H 2) junto con la generación de un sitio de coordinación vacante en el centro metálico.
Puenteo de hidruros
Los hidruros metálicos suelen mostrar dos modos de unión, a saber, terminal y puente. En el caso de los hidruros de puente, el átomo de hidrógeno puede puentear entre dos o incluso más centros metálicos y, por lo tanto, los hidruros de puente a menudo muestran geometrías dobladas.
σ−complejos
Los complejos σ−son compuestos raros, en los que los electrones de enlace σ de un enlace X−H participan además en la unión con un centro metálico (X = H, Si, Sn, B y P). Por lo tanto, los complejos σ exhiben una unión torcida a un centro metálico con el átomo de hidrógeno, que no contiene ningún par solitario, estando más cerca del centro metálico y dando como resultado una estructura lateral. Muchas veces, si el centro metálico es rico en electrones, entonces puede ocurrir una donación posterior al orbital σ* del resto X−H unido a metal dando como resultado una escisión completa del enlace X−H.
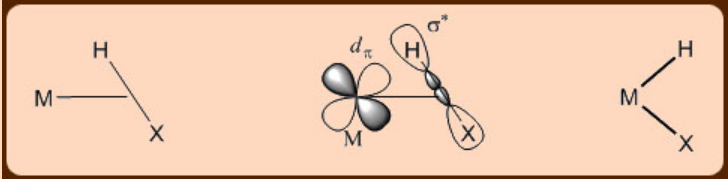
Complejos metálicos de dihidrógeno
La variante más simple de un complejo σ−contiene un ligando dihidrógeno. El primer complejo de dihidrógeno fue aislado por Kubas, después de lo cual se reportaron muchos nuevos.
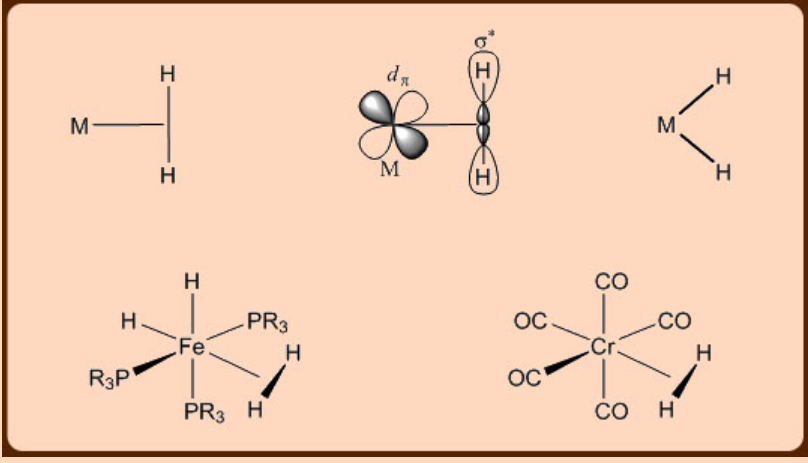
Muy esperado, se encuentra que el resto dihidrógeno unido a un metal en un complejo σ−es más ácido (p K a = 0 − 20) en comparación con la molécula de dihidrógeno libre (p K a = 35). Es interesante observar que el cambio p K a asociado con la unión de dihidrógeno a un metal en un complejo σ−relativo al de la molécula H 2 libre es significativamente mayor que el cambio asociado con la unión de H 2 O al metal. Debido a esta acidez inherente, la desprotonación del resto dihidrógeno unido a metal por una base se puede emplear así apropiadamente para la activación heterolítica del resto dihidrógeno como se ilustra a continuación.
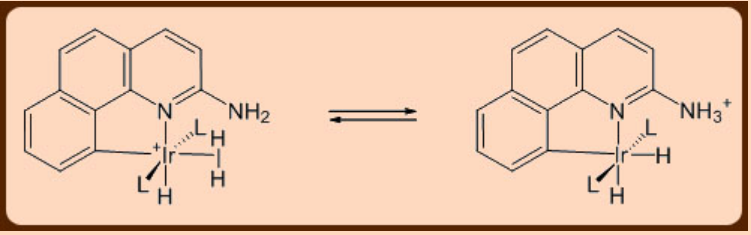
Los complejos de dihidrógeno de los metales a menudo se denominan hidruros no clásicos. Se anticipa que los metales básicos π ricos en electrones dividan los restos de dihidrógeno unidos a metal dando como resultado complejos de dihidruro clásicos. En la misma línea de pensamiento, el metal con deficiencia de electrones y menos π básico tendería a estabilizar un complejo de dihidrógeno. Los complejos de dihidrógeno también se pueden caracterizar por la difracción de rayos X así como los métodos de difracción de neutrones. En el espectro IR, el estiramiento H−H unido a metal aparece en el rango (2300 − 2900) cm −1 mientras que en el espectro de RMN 1H el mismo aparece entre 0 y −10 ppm como un pico ancho. Los complejos de dihidrógeno a menudo se caracterizan por estudios de marcaje isotópico del resto H-D unido a metal que muestra una constante de acoplamiento de 20 a 34 Hz como se supone que se observa a 43 Hz en el caso de la molécula H-D libre.
Problemas
1. Predecir el producto de la reacción.
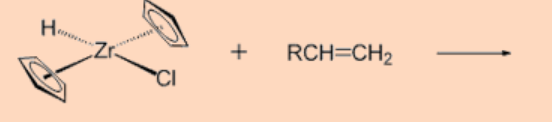
Ans:
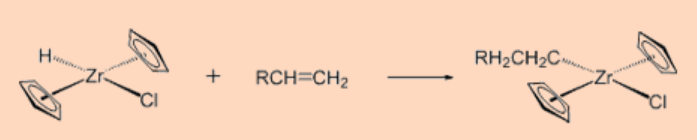
2. Dar el estado de oxidación y el recuento de electrones de valencia total del centro metálico.
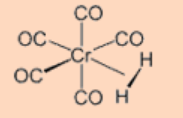
Ans: Estado de oxidación 0 y 18 VE
3. ¿Qué tipo de centros metálicos estabilizarían los complejos metálicos de dihidrógeno?
Ans: Ligandos deficientes en electrones y menos π básicos
4. Especificar si la naturaleza del resto hidrógeno en el complejo, HCO (CO) 4 es ácida o básica?
Ans: Ácidos
5. ¿Dónde aparecen las bandas de estiramiento M−H en el espectro IR de los complejos de hidruro metálico?
Ans: 1500 a 2200 cm -1
Prueba de autoevaluación
1. Predecir el producto de la reacción.
\[\ce{IrCl(Co)(Pph3)2 ->[H_{2}]}\]
Ans:
\[\ce{IrCl(CO)(PPh3)2 ->[H2] IrH2Cl(CO)(PPh3)2}\]
2. Dar el estado de oxidación y el recuento de electrones de valencia total del centro metálico.
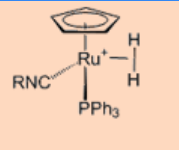
Ans: Estado de oxidación +2 y 18 VE
3. ¿Qué tipo de centros metálicos estabilizarían los complejos clásicos de dihidruro?
Ans: Ligandos ricos en electrones y más p básicos
4. Especificar si la naturaleza del resto hidrógeno en el complejo, IRh 5 (pCy 3) 2 es ácida o básica?
Ans: Básico
5. Entre la difracción de rayos X y la difracción de neutrones, ¿cuál es un mejor método para la caracterización del resto M−H?
Ans: Difracción de neutrones
Resumen
Los hidruros metálicos son compuestos importantes en el esquema general de la química organometálica ya que están involucrados en muchas etapas cruciales de numerosas reacciones catalíticas. Además de los hidruros metálicos, otra clase importante de compuestos son los complejos de metales de transición, cuya variante más simple son los complejos de dihidrógeno metálicos. Estos complejos σ y los complejos de dihidrógeno metálicos son importantes para las activaciones heterolíticas del heteroátomo H-heteroátomo unido a metal respectivo y los enlaces H-H.


