8.1: Carbonilos metálicos
- Page ID
- 69234
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- El trasfondo histórico de los complejos carbonílicos metálicos.
- El ligando CO y su capacidad de unión al metal.
- Se observó sinergia entre el ligando a metal hacia adelante σ—donación y el metal a ligando hacia atrás π—donación observada en una interacción metal-CO.
- La síntesis, caracterización y su reactividad de los compuestos carbonílicos metálicos.
Los carbonilos metálicos son una clase importante de compuestos organometálicos que se han estudiado durante mucho tiempo. En 1884, Ludwig Mond, al observar que las válvulas de níquel estaban siendo consumidas por el gas CO en una industria de refinación de níquel, calentó polvo de níquel en una corriente de gas CO para sintetizar el primer compuesto de carbonilo metálico conocido en forma Ni (CO) 4. Así nació el famoso proceso de refinación de Mond, basado en la premisa de que el compuesto volátil de Ni (CO) 4 se puede descomponer en metal puro a temperatura elevada. Posteriormente, Mond fundó Mond Nickel Company Limited para purificar níquel de su mineral usando este método.
El ligando carbonilo (CO) se distingue de otros ligandos en muchos aspectos. Por ejemplo, a diferencia de los ligandos de alquilo, el ligando de carbonilo (CO) está insaturado, lo que permite no solo que el ligando done, sino que también acepte electrones en su orbital π* de orbitales metálicos d π y haciendo así que el ligando de CO π-ácido. La otra diferencia radica en el hecho de que el CO es un ligando blando en comparación con los otros ligandos básicos comunes como H 2 O o los alcóxidos (RO-), que se consideran como ligandos duros.
Al ser de naturaleza π−ácida, el CO es un ligando de campo fuerte que logra una mayor división d −orbital a través del metal al ligando π−back donativo. Por lo tanto, una interacción de unión metal-CO comprende una donación de CO a metal y una donación de metal a CO π-back (Figura\(\PageIndex{1}\)). Curiosamente, tanto las mediciones espectroscópicas como los estudios teóricos sugieren que la extensión de la donación de metal a CO π−back es casi igual o incluso mayor que la extensión de la donación de CO a metal σ−donación en complejos de carbonilo-metal. Esta observación concuerda con el hecho de que los centros de metales de transición de baja valent—tienden a formar complejos carbonílicos metálicos.
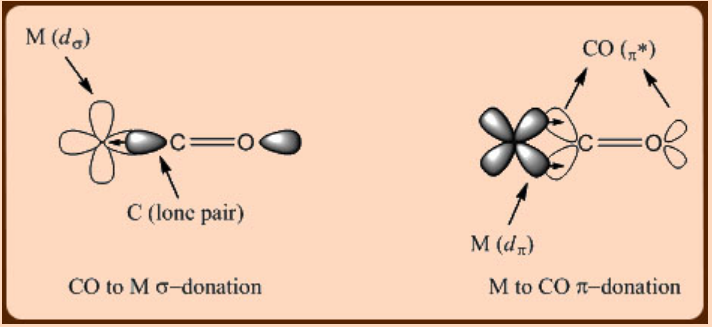
En los complejos de carbonilo-metal, el soporte directo de la donacion n-back se observa en la distancia de enlace M-C que se vuelve mas corta en comparacion con la de una distancia normal de enlace sencillo M-C. Por ejemplo, el complejo CpMO (CO) 3 CH 3, exhibe dos tipos de distancias de enlace M-C que comprenden una distancia Mo−CH 3 más larga (2.38 Å) y una distancia Mo−Co mucho más corta (1.99 Å) que surgen de una donación de metal a ligando π−back. Por lo tanto, resulta evidente que la interacción metal−CO se puede caracterizar fácilmente usando cristalografía de rayos X. La espectroscopia infrarroja también se puede emplear igualmente con éxito en el estudio de la interacción Metal-CO. Dado que el enlace de metal a CO n-back implica una donacion de la orbital de metal d π a una orbital π* de un enlace C-O, se observa un desplazamiento significativo de la frecuencia de estiramiento de ν (CO) hacia la menor energía en los complejos de carbonilos metálicos con respecto a la del CO libre (2143 cm -1 ).
Preparación de complejos carbonílicos metálicos
Los métodos comunes para la preparación de los compuestos carbonílicos metálicos son,
i. Uso directo de CO
\[\ce{Fe ->[CO, \: 200atm, \: 200°C] Fe(CO)5}\]
El requisito principal de este método es que el centro metálico debe estar en un estado reducido de oxidación baja para facilitar la unión de CO al centro metálico a través de la donación de metal a ligando π−back.
ii. Uso de CO y un agente reductor
\[\ce{NiSO4 + CO + S2O4^{2-} -> Ni(CO)4}\]
Este método se denomina comúnmente carbonilación reductiva y se utiliza principalmente para los compuestos que tienen centros metálicos de mayor estado de oxidación. El agente reductor primero reduce el centro metálico a un estado de oxidación inferior antes de la unión del CO para formar los compuestos carbonílicos metálicos.
iii. A partir de compuestos carbonílicos
Este método implica la abstracción de CO a partir de compuestos orgánicos como los alcoholes, aldehídos y CO 2.
Reactividades de carbonilos metálicos
i. Ataque nucleofílico al carbono
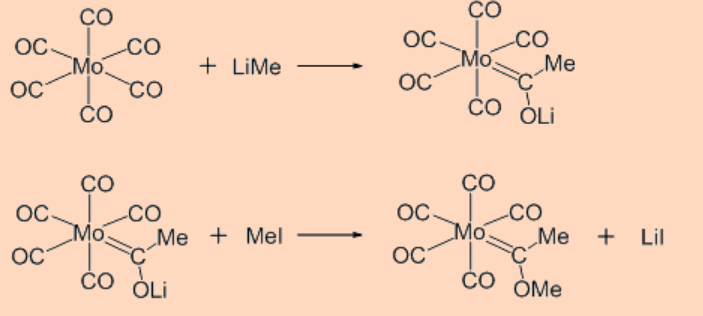
La reacción suele dar lugar al resto carbeno.
ii. El ataque electrofílico al oxígeno
\[\ce{Cl(PR3)4Re-CO + AlMe3 -> Cl(PR3)4Re-CO -> AlMe3}\]
iii. Reacción de inserción migratoria
\[\ce{MeMn(CO)5 +PMe3 -> (MeCO)Mn(CO)4(PMe3)}\]
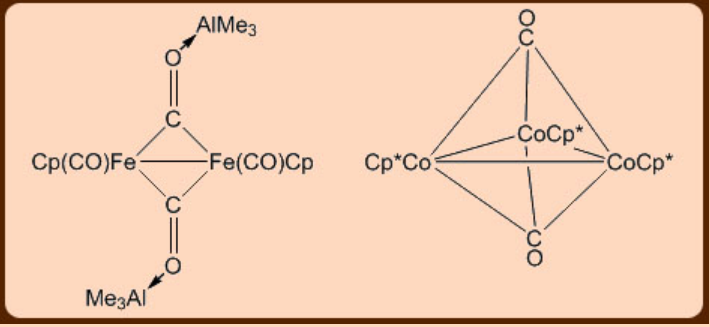
El carbonilo metálico muestra dos tipos de enlaces en la forma de los modos terminal y puente. La espectroscopia infrarroja puede distinguir fácilmente entre estos dos modos de unión del resto carbonilo metálico ya que los terminales muestran una banda de estiramiento de ν (CO) a ca. 2100-2000 cm −1 mientras que los puentes aparecen en el rango de 1720−1850 cm −1. El resto carbonilo puede tender puentes entre más de dos centros metálicos (Figura\(\PageIndex{2}\)).
Problemas
1. ¿Cuántos pares solitarios hay en la molécula de CO?
Respuesta: Tres (uno de carbono y dos de oxígeno).
2. A pesar de que O es más electronegativo que C, el momento dipolar del CO es casi cero. Explique.
Respuesta: Por la donación de electrones del oxígeno al carbono.
3. ¿Qué tipo de centros metálicos forman complejos carbonílicos metálicos?
Ans: Centros metálicos de baja valencia.
4. ¿Cuáles son los dos modos principales de unión exhibidos por el ligando CO?
Respuesta: Modos de unión terminal y puente.
Prueba de autoevaluación
1. ¿Predecir el producto de la reacción?
\[\ce{Ni + CO_{Excess} ->}\]
Respuesta: Tres (uno de carbono y dos de oxígeno).
2. Al unirse a un centro metálico la frecuencia de estiramiento C−O aumenta/disminuye con respecto a la del CO libre?
Ans: Disminuye.
3. Explique por qué los centros metálicos de baja valencia estabilizan la unión de CO en los complejos de carbonilo metálico
Respuesta: Porque la donación de metal a ligando π−back.
4. Dé un ejemplo de un buen ligando σ−donante y π−donante?
Ans: Alcóxidos (RO -).
Resumen
El CO es un ligando distintivo de la química organometálica. Los complejos de carbonilo-metal han sido estudiados desde hace mucho tiempo. Los ligandos de CO se unen fuertemente al centro de metal usando un mecanismo sinérgico que implica la donación de σ—donación del par solitario de ligando a metal y seguido de la donación π−back de un orbital d de metal lleno a un orbital σ* vacío de enlace C−O del ligando CO. Los complejos de carbonilo-metal se preparan por varios métodos. Los complejos de carbonilo-metal suelen ser estabilizados por centros metálicos en estados de baja oxidación.


