8.2: Fosfinas Metálicas
- Page ID
- 69233
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Conoce los complejos de fosfina metálica.
- Tener una comprensión de las propiedades estéricas y electrónicas de los ligandos de fosfina.
- Obtenga una visión más profunda sobre las interacciones de la fosfina metálica.
- Ser introducido en otros ligandos p básicos.
Las fosfinas son uno de los pocos ligandos que han sido ampliamente estudiados en las últimas décadas hasta tal punto que el ajuste fino sistemático de los esteros y la electrónica ahora se puede lograr con cierto grado de previsibilidad. Las fosfinas son mejores ligandos para espectadores que ligandos actores. Tolman realizó experimentos pioneros de espectroscopía infrarroja en los complejos PR 3 Ni (CO) 3 observando las frecuencias de estiramiento de ν (CO) para obtener una visión de las propiedades donantes de los ligandos PR 3. Por lo tanto, un ligando de fosfina donador de σ más fuerte aumentaría la densidad de electrones en el centro del metal, lo que llevaría a un enlace de retorno de metal a ligando mejorado y, por lo tanto, disminuiría las frecuencias de estiramiento de ν (CO) en estos complejos. Otro aspecto importante del ligando fosfina es su tamaño que tiene un impacto estérico significativo en sus complejos metálicos. Así, a diferencia del ligando CO, que es pequeño y por lo tanto muchos pueden unirse simultáneamente a un centro metálico, lo mismo no es cierto para los ligandos de fosfina ya que solo unos pocos pueden unirse a un centro metálico. El número de ligandos de fosfina que pueden unirse a un centro metálico también depende del tamaño de sus sustituyentes R. Por ejemplo, hasta dos pueden unirse a un centro metálico en el caso de los ligandos Pcy 3 o P (i-Pr) 3, tres o cuatro para PPh 3, cuatro para Me 2 PH y cinco o seis para PMe 3. El efecto estérico de la fosfina fue cuantificado por Tolmann y viene dado por un parámetro llamado Ángulo de Cono que mide el ángulo en el metal formado por el ligando PR 3 que se une a un metal (Figura\(\PageIndex{1}\)).
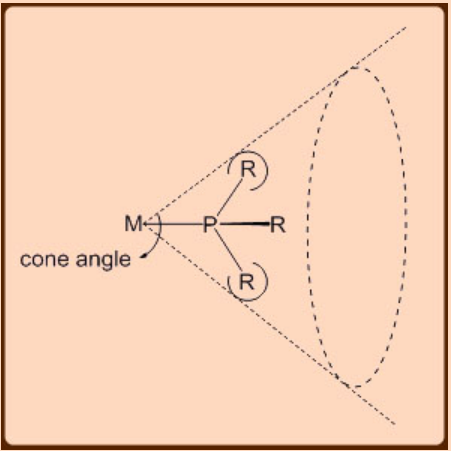
Los criterios de ángulo de cono se han invocado con éxito en la racionalización de las propiedades de una amplia gama de complejos de fosfina metálica. Una característica única del ligando de fosfina es que permite un cambio conveniente del efecto electrónico sin sufrir mucho cambio en sus efectos estéricos. Por ejemplo, PbU 3 y P (O i Pr) 3 tienen efectos estéricos similares pero varían en sus efectos electrónicos. Lo contrario también es cierto ya que el efecto estérico se puede cambiar fácilmente sin sufrir mucho cambio en el efecto electrónico. Por ejemplo, PMe 3 y P (o-tolil) 3 tienen un efecto electrónico similar pero difieren en sus efectos estéricos. Así, la capacidad de modular convenientemente los efectos estéricos y electrónicos hacen que los ligandos de fosfina sean un sistema versátil para llevar a cabo muchas catálisis organometálicas.
Estructura y unión
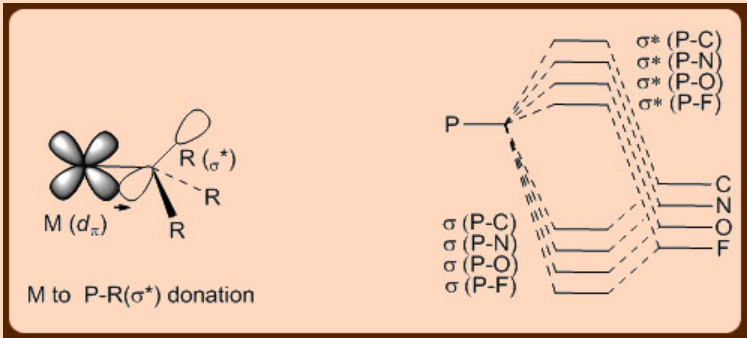
Las fosfinas son dos donantes de electrones que se acoplan a un par solitario para unirse a metales. Estos son considerados como buenos donadores σ−y malos aceptores π−y pertenecen a la misma clase con los ligandos arilo, dialquilamino y alcoxo. De hecho, son más ácidos p que ligandos donadores puros como NH 3 y, lo que es más interesante, su acidez π−puede variar significativamente mediante la incorporación sistemática de sustituyentes en el átomo de P. Por ejemplo, PF 3 es más π−ácido que CO. Análogamente a lo que se observa en el caso del ligando CO ácido de referencia, en el que el metal d π orbital dona electrones a un orbital π* de un enlace C−O, en el caso de los ligandos de fosfinas, tal donaciónn-back ocurre a partir del orbital de metal d π ocurre sobre a σ* orbital de un enlace P−R (Figura\(\PageIndex{2}\)). En los ligandos de fosfina, con el incremento de la electronegatividad de R se estabilizan tanto los orbitales σ como σ* del enlace P−R. En consecuencia, la contribución del orbital atómico del átomo P al orbital σ*−orbital del enlace P−R aumenta, lo que eventualmente aumenta el tamaño del orbital σ* del enlace P−R. Esto a su vez facilita una mejor superposición del orbital σ* del enlace P−R con el orbital del metal d π durante la donación de metal a ligando π−back en estos complejos de fosfina metálica.
Partiendo del CO, que es un ligando aceptor p fuerte, hasta pasar a las fosfinas, que son buenos donadores de σy malos ligandos aceptores p, hasta ir incluso más lejos a otro extremo a los ligandos, que son tanto buenos donadores σ' como donadores p, una rica variedad de ligandos de fosfina están disponibles para estabilizar diferentes tipos de complejos organometálicos. En este contexto se discuten a continuación los siguientes ligandos.
ligandos π-básicos
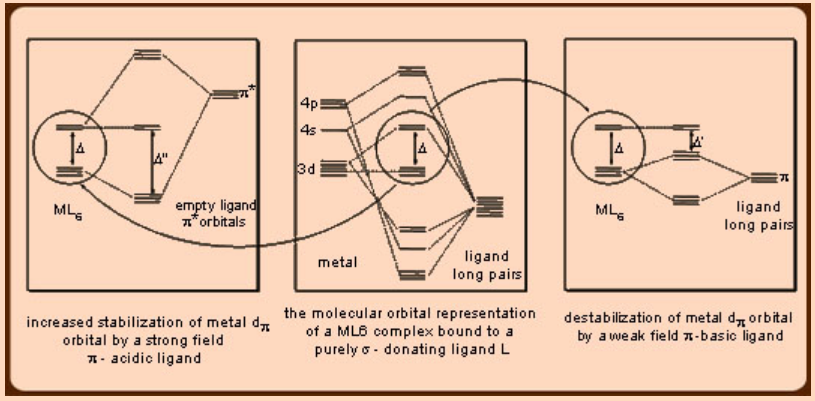
Los alcóxidos (RO −) y haluros como F −, Cl − y Br − pertenecen a una categoría de ligandos π−básicos ya que se acoplan a un segundo par solitario para la donación π−al metal por encima y por encima del primer par solitario que participa σ−donación al metal. Opuesto a lo que se observa en el caso de los ligandos n-ácidos, en los que el orbital del ligando π* estabiliza el orbital metálico d π y afectando así a una mayor división del campo del ligando, en concordancia con la naturaleza de campo fuerte de estos ligandos (Figura 3), en el caso de los ligandos n-básicos , el segundo par solitario desestabiliza los orbitales metálicos d π conduciendo a una división más pequeña del campo de ligandos, lo que está de acuerdo con la naturaleza de campo débil de estos ligandos. Los orbitales que contienen el par solitario de ligandos generalmente se localizan en los heteroátomos más electronegativos y por lo tanto son invariablemente más bajos en energía que los orbitales metálicos d π. De ahí que la desestabilización de los orbitales metálicos d π se produce debido a la repulsión del ligando relleno orbital de par solitario con los orbitales d π metálicos rellenos. En el caso de las situaciones en las que los orbitales metálicos d π están vacantes, como en los sistemas d 0 de iones Ti 4+, la posibilidad de la desestabilización de los orbitales metálicos d π no surge sino la estabilización se produce a través de la donación de los electrones orbitales de par solitario del ligando lleno a los orbitales d π metálicos vacíos como se ve en el caso de TiF 6 y W (OMe) 6. Por lo tanto, este escenario en ligandos π−básicos es opuesto al observado en el caso de los ligandos π−ácidos, para los cuales los orbitales de ligandos π* vacíos son más altos en energía que los orbitales d π metálicos rellenos.