1.10: Consideraciones electrónicas generales de los complejos metal-ligando
- Page ID
- 74696
Los complejos metálicos son aductos ácido-base de Lewis formados entre iones metálicos (el ácido) y ligandos (la base).
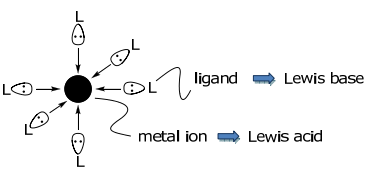
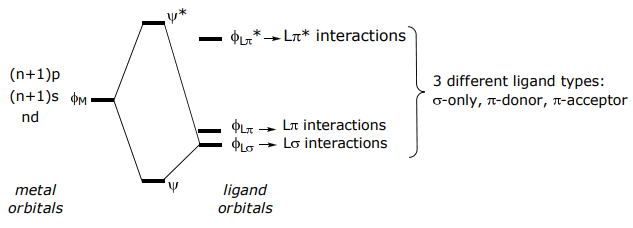
La interacción de los orbitales fronterizos atómicos (para ligandos de un solo átomo) o moleculares (para muchos ligandos de átomos) del ligando y el metal conducen a la formación de enlaces,
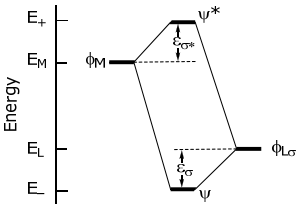
De manera más cuantitativa, la energía de interacción de estabilización y desestabilización, ε σ y ε σ *, respectivamente, se define en el siguiente diagrama de niveles de energía,
Tratar este problema dentro de la estructura de LCAO que comprende rendimientos orbitales de metal y ligando,
ψ = c M φ M + c L φ L
y resolviendo para el hamiltoniano,
$$
\ begin {alineada}
&\ mathrm {H}\ psi=\ mathrm {E}\ psi\\
&\ izquierda. |\ mathrm {H} -\ mathrm {E} |\ psi\ rangle=\ izquierda|\ mathrm {H} -\ mathrm {E} _ {\ mathrm {j}}\ derecha|\ mathrm {c} _ {\ mathrm {M}}\ phi_ {\ mathrm {M}} +\ mathrm {c} _ {\ mathrm {L}}\ phi\ derecha\ rangle=0
\ end {alineado}
\]
Al multiplicar a la izquierda por ΦM y ΦL se obtiene el conjunto de ecuaciones homogéneas lineales,
$$
\ begin {alineada}
&c_ {M}\ izquierda\ langle\ phi_ {M} |H-E|\ phi_ {M}\ derecha\ rangle+c_ {L}\ izquierda\ langle\ phi_ {M} |H-E|\ phi\ derecha\ rangle=0\
&c_ {M}\ izquierda\ langle\ phi_ {L} |H-E|\ phi_ {M}\ derecha\ alcance+c_ {L}\ langle\ phi|h-e|\ phi\ rangle=0
\ end {alineado}
\]
que proporciona el determinante laico,
$$
\ izquierda|\ begin {array} {cc}
\ mathrm {H} _ {M M} -\ mathrm {E} &\ mathrm {H} _ {M L} -\ mathrm {ES} _ {M L}\
\ mathrm {H} _ {M L} -\ mathrm {ES} _ {M L} &\ mathrm {H} _ {L} -\ mathrm {E}
\ end {array}\ derecha|=\ izquierda|\ begin {array} {cc}
\ mathrm {E} _ {M} -\ mathrm {E} & amp;\ mathrm {H} _ {M L} -\ mathrm {ES} _ {M L}\
\ mathrm {H} _ {M L} -\ mathrm {ES} _ {M L} &\ mathrm {E} _ {L} -\ mathrm {E}
\ end {array}\ derecha|=0
\]

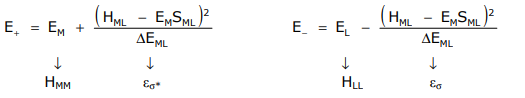
La aproximación de Wolfsberg-Hemholz proporciona un valor para H ML, definido como
H ML = S ML (E L + E M)
Sustituir H ML en las expresiones anteriores por E + y E — rinde,
$$
\ varepsilon_ {\ sigma} =\ frac {E_ {M} {} ^ {2} S_ {M L} {} ^ {2}} {\ Delta E_ {M L}}\ quad\ varepsilon_ {\ sigma *} =\ frac {E_ {L} {} {} ^ {2} S_ {M L} {} {^ {2} {\ Delta E_ {M L}}
\]
La derivación destaca las siguientes reglas generales para la construcción de diagramas MO,
(1) La mezcla orbital atómica M—L es proporcional a la superposición del metal y el ligando orbital, es decir, S ML
corolario A: solo los orbitales de simetría correcta pueden mezclarse y dar una energía de interacción distinta de cero (es decir, S ML ≠ 0)
corolario B: las interacciones σ normalmente dan lugar a mayores energías de interacción que las resultantes de las interacciones π y las interacciones π son mayores que las interacciones δ debido a una unión más direccional a lo largo de la serie S ML (σ) > S ML (π) > S ML (δ)
(2) La mezcla orbital atómica M—L es inversamente proporcional a la diferencia de energía de los orbitales mezcladores (es decir, ΔE ML).
Otro tema de interés para la construcción de MO es,
(3) El orden de los niveles de energía EL y EM casi siempre es:
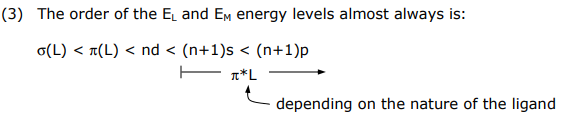
Este orden de energía proviene directamente de las Energías de Ionización Orbital de Valence (VOIE) de átomos metálicos y del grupo principal y espectros PES de ligandos moleculares.
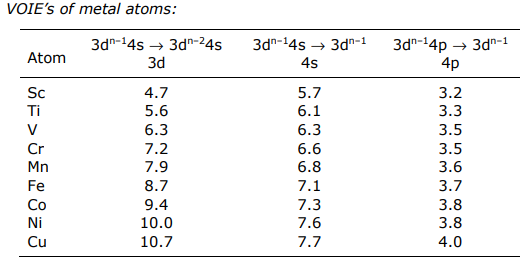
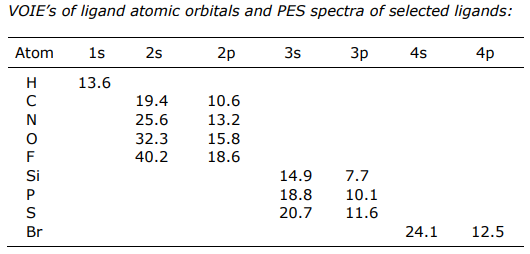
Las energías PES de los ligandos están en los EVs (nota: un VOIE es simplemente lo opuesto a la energía de ionización)
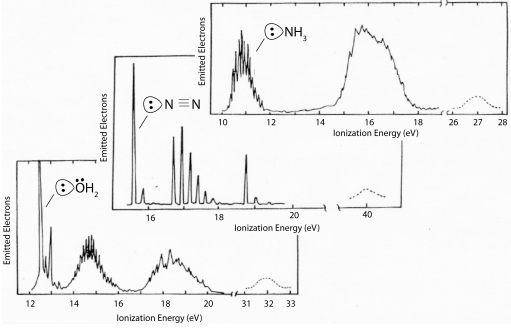
Observaciones generales:
(1) Los orbitales s son generalmente demasiado bajos en energía para participar en la vinculación (ΔE ML (σ) es muy grande)
(2) Los orbitales p llenos son los orbitales fronterizos, y tienen VOI que los colocan debajo de los orbitales metálicos
(3) Para los ligandos moleculares, dado que los orbitales fronterizos comprenden orbitales s y p, aquí los orbitales de ligando demasiado llenos tienen energías que se estabilizan en relación con los orbitales metálicos


