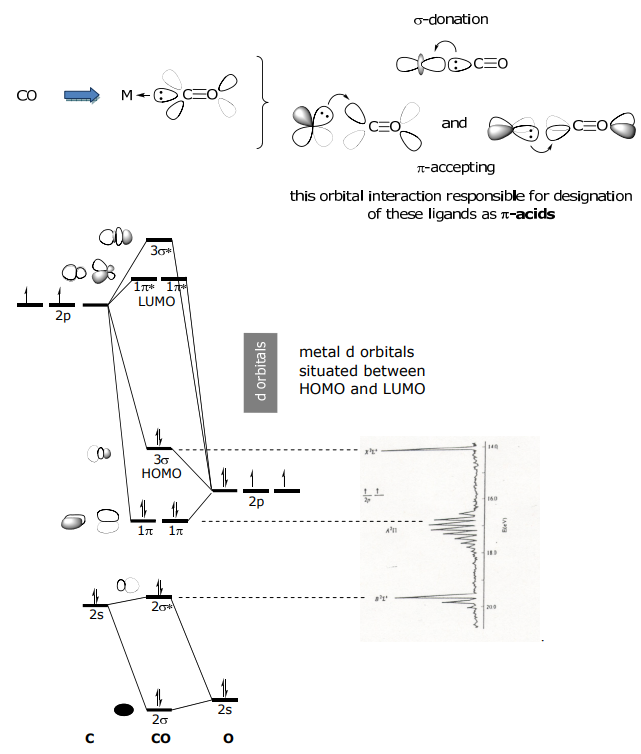
1.11: Orbitales moleculares fronterizos de ligandos σ-donador, donador π y aceptor π-aceptor
- Page ID
- 74680
Antes de abordar el negocio del complejo, se debe considerar la naturaleza de los orbitales de frontera ligando. Existen tres clases generales de ligandos, definidos por sus orbitales fronterizos: ligandos donadores σ, ligandos donadores π y ligandos aceptores π-aceptores.
ligandos donadores σ-
Estos ligandos donan dos e-s de una órbita de simetría σ-simetría:
H — (1s 2), NH 3 (2a 1 lp), PR 3 (2a 1 lp), CH 3 - (2a 1 lp), OH 2 (b 1 lp)
Tenga en cuenta que algunos de estos ligandos son atómicos, mientras que otros son LCAO-MOS. Los orbitales fronterizos para la unión al metal son así orbitales atómicos o moleculares, dependiendo de la naturaleza del ligando.
Como ejemplo de un ligando molecular, considérese el ligando de amoníaco. El amoníaco se forma a partir del LCAO entre los orbitales de valencia de un nitrógeno central y los tres orbitales 1s de tres hidrógenos,
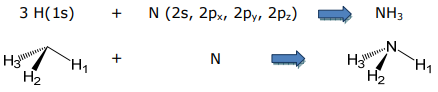
Para iniciar este problema, se deben determinar las combinaciones lineales adaptadas a la simetría de los tres orbitales 1s. De ahí que la base se derivará de los orbitales H. Debido a que los orbitales H (1s) solo pueden formar enlaces σ, la elección de 3 enlaces σ N-H es un conjunto de bases apropiado,
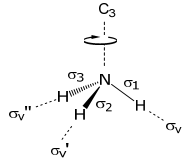
Las propiedades de transformación de los enlaces σ (en simetría C3v) son las siguientes:
\[ E \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 0 & 1 & 0 \\ 0 & 0 & 1 \\ 1 & 0 & 0 \end{bmatrix} \]
\[ C_{3} \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 1 & 0 & 0 \\ 0 & 1 & 0 \\ 0 & 0 & 1 \end{bmatrix} \]
\[ σ_{v} \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} σ_{1} \\ σ_{2} \\ σ_{3} \end{bmatrix} \rightarrow \begin{bmatrix} 1 & 0 & 0 \\ 0 & 0 & 1 \\ 0 & 1 & 0 \end{bmatrix} \]
Esta representación de esta base se puede determinar rápidamente al darse cuenta de que sólo los enlaces (o orbitales H (1s)) que no se mueven contribuirán a la traza de la representación matricial,
\ [\ begin {array} {c|ccc}
\ mathrm {C} _ _ {3\ mathrm {v}} &\ mathrm {E} & 2\ mathrm {C} _ {3} & 3\ sigma_ {\ mathrm {v}}
\\ hline\ Gamma_ {\ sigma} & 3 & 0 & 1
\ end {array}\ fila derecha a_ {1} + e\]
Proyectando las SALC a1 y e de los orbitales 3H, nos damos cuenta de que las propiedades de transformación de los orbitales H se conservan en el subgrupo rotacional C3,
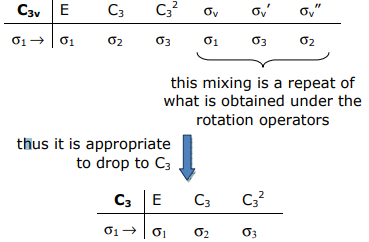
La aplicación del operador de proyección en el grupo de puntos C3 cíclicos es una tarea fácil: simplemente puede leer las proyecciones,
\ begin {alineado}
&\ mathrm {P} ^ {\ mathrm {a} _ {1}}\ izquierda (\ sigma_ {1}\ derecha)\ fila derecha 1\ cdot\ mathrm {E}\ sigma_ {1} +1\ cdot\ mathrm {C} _ _ {3}\ sigma_ {1} +1\ cdot\ mathrm {C} _ {3} ^ {2}\ sigma_ {1} =\ sigma_ {1} +\ sigma_ {2} +\ sigma_ {3}\\
&\ mathrm {P} ^ {\ mathrm {e} (1)}\ izquierda (\ sigma_ {1}\ derecha)\ fila derecha 1\ cdot\ mathrm {E}\ sigma_ {1} +\ izquierda (\ varepsilon^ {*}\ derecha)\ mathrm {C} _ {3}\ sigma_ {1} +\ varepsilon\ mathrm {C} _ {3} ^ {2}\ sigma_ {1} =\ sigma_ {1} +\ varepsilon\ mathrm {3} ^ {2}\ sigma_ {1} = psilon^ {*}\ sigma_ {2} +\ varepsilon\ sigma_ {3}\\
&\ mathrm {P} ^ {\ mathrm {e} (2)}\ izquierda (\ sigma_ {1}\ derecha)\ fila derecha 1\ cdot\ mathrm {E}\ sigma_ {1} + \ varepsilon\ mathrm {C} _ {3}\ sigma_ {1} +\ izquierda (\ varepsilon^ {*}\ derecha)\ mathrm {C} _ {3} ^ {2}\ sigma_ {1} =\ sigma_ {1} +\ varepsilon\ sigma_ {2} +\ varepsilon^ {*\ sigma_ {3}
\ final {alineado}
Tomando combinaciones lineales apropiadas y normalizando,
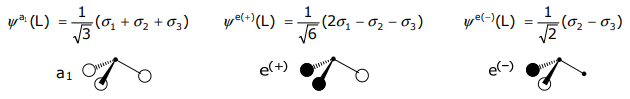
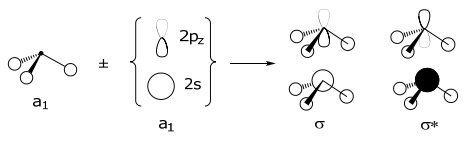
Solo orbitales de la misma simetría pueden formar un LCAO; así el SALC a1 de los orbitales 3H (1s) solo puede combinarse con los orbitales a1 de la N central (es decir, los orbitales de valencia 2s y 2p z),
el 2p y orbital se combina con e (+), es ortogonal a e (—), mientras que lo contrario es cierto para 2p x orbital,
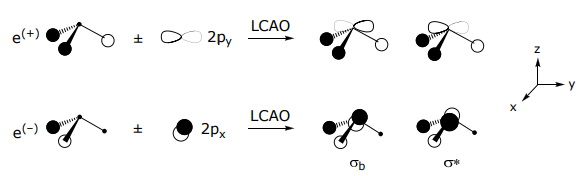
El MO se construye superponiendo orbitales de la misma simetría. Cuanto mayor sea el solapamiento, mayor será la división entre los orbitales. Obsérvese que la SALC a 1 participa en dos tipos de interacciones σ, una con la orbital 2s y otra con la órbita 2p z de nitrógeno. El orbital de mayor energía, el ligando HOMO orbital, se utiliza para la unión al metal. Este orbital también está compuesto por dos tipos de interacciones: (i) es Lσ (a 1) —N (2s) antiadherentes y (ii) Lσ (a 1) —N (2p z) enlazando en carácter. La energía de los orbitales atómicos se muestra entre paréntesis.
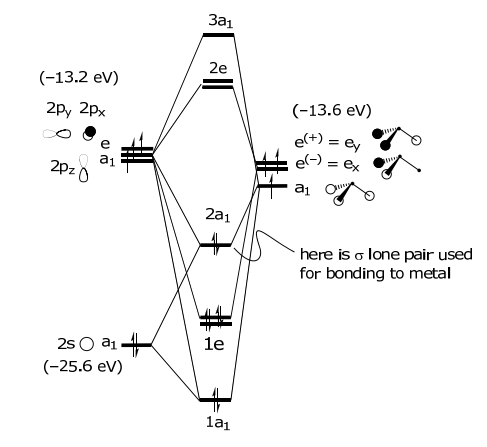
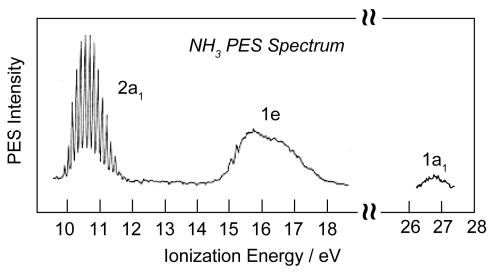
Los argumentos de hibridación simples predicen dos energías de enlace diferentes para NH 3: (1) el par solitario y (2) el enlace σ N-H. El diagrama MO por otro lado predice tres energías diferentes. El espectro fotoelectrónico del NH 3 exhibe tres energías de ionización, verificando así el modelo de unión MO.
Un segundo ligando molecular es el agua. El ligando tiene dos pares solitarios, pero solo se usa uno en la unión al metal. La razón de esta asimetría electrónica y por qué solo un par solitario está disponible para la unión se hace evidente a partir de la estructura electrónica de la molécula de agua.
El conjunto de bases para el agua son los orbitales 2H (1s) y los orbitales atómicos O (2s, 2p z, 2p x, 2p y). La combinación lineal adaptada a simetría apropiada para los orbitales 2H (1s) se puede determinar usando los enlaces σ anteriores.
\ begin {alineado}
&\ begin {array} {c|cccc}
\ mathbf {C} _ {\ mathbf {2 v}} &\ mathrm {E} &\ mathrm {C} _ _ {2} &\ sigma_ {\ mathrm {v}} (\ mathrm {xz}) &\ sigma_ {\ mathrm {v}} (\ mathrm {yz})\\\ hline\ Gamma_ {\ sigma} & 2 & 0 &\ fila derecha a_ {1} +
b_ {1}\\
\ hline\ sigma_ {1}\ fila derecha &\ sigma_ {1} &\ sigma_ {2} &\ sigma_ {1} &\ sigma_ {2}
\ end {array}\
\ end {alineado}
Aplicando el operador de proyección,
\ begin {alineado}
&\ mathrm {P} ^ {\ mathrm {a} _ {1}}\ izquierda (\ sigma_ {1}\ derecha)\ derecha)\ fila derecha 1\ cdot\ overbrackets {{\ mathrm {E}\ sigma_ {1}} ^ {\ sigma_ {1}} +1\ cdot\ overbrackets {{\ mathrm {C} _ _ {2}\ sigma_ {1}}} ^ {\ sigma_ {2}} +1\ cdot\ overbrackets {{\ sigma (\ mathrm {xz})\ cdot\ sigma_ {1}}} ^ {\ sigma_ {1}} +1\ cdot\ overbrackets { {\ sigma (\ mathrm {yz})\ cdot\ sigma_ {1}}} ^ {\ sigma_ {2}}\ fila derecha\ psi_ {\ mathrm {a} _ {1}} =\ frac {1} {\ sqrt {2}}\ izquierda (\ sigma_ {1} +\ sigma_ {2}\ derecha)\\
& mathrm {P} ^ {\ mathrm {b} _ {1}}\ izquierda (\ sigma_ {1}\ derecha)\ fila derecha 1\ cdot\ mathrm {E}\ sigma_ {1} + (-1)\ cdot\ mathrm {C} _ {2}\ sigma_ {1} +1\ cdot\ sigma (\ mathrm {xz})\ cdot\ sigma_ {1} + (-1)\ cdot\ sigma (\ mathrm {yz})\ cdot\ sigma_ {1}\ fila derecha\ psi_ {\ mathrm {b}} =\ frac {1} {\ sqrt {2}}\ izquierda (\ sigma_ {1} -\ sigma_ {2}\ derecha)
\ end {alineado}
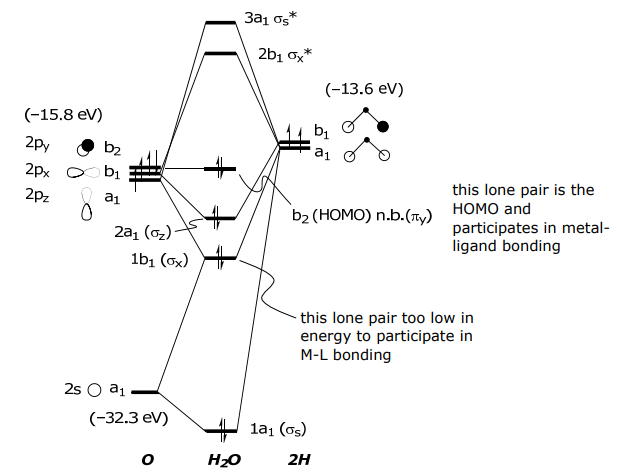
Los orbitales s y pz en O tienen simetría a1 y así se mezclarán con el Lσ (a 1), el p x tiene simetría b 1 y se mezclarán con Lσ (b 1) y el orbital p y es rigurosamente no unido, es decir, no tiene una contraparte de simetría del átomo O, y por lo tanto no El LCAO se forma usando este orbital.
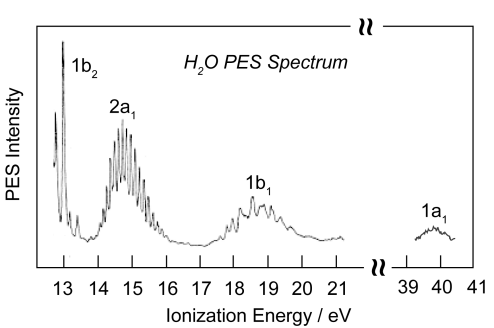
Nuevamente, se muestra que el cuadro de hibridación simple de unión es incorrecto, y se corrobora el modelo de unión MO.
donadores π-
donadores π Además de donar densidad de electrones a un metal a través de un enlace σ-s, se pueden proporcionar e — s al metal a través de una interacción de simetría π. Los ligandos donadores de π incluyen X — (haluro), amida (NR 2 —), sulfuro (S2 —), óxido (O 2—), alcóxido ( RO —).
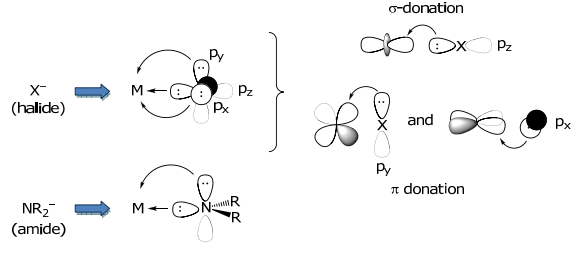
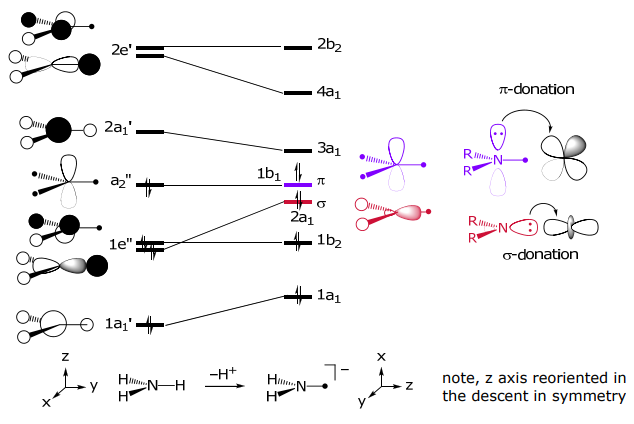
La amida MO puede construirse comenzando con el MO de NH 3 “plano”, seguido de su perturbación al eliminar H +,
aceptores π-
Esta clase de ligandos donan e — s de un orbital σ y aceptan e — s del metal a un orbital π* vacío. El CO es el arquetipo de esta clase de ligandos. Otros aceptores π-son NO +, CN —, CNR. Considera el diagrama MO de CO a continuación; el HOMO está lleno y de σ-simetría, el LUMO está vacío y de simetría π*.