4.3: Oxígeno y óxidos (Parte 1)
- Page ID
- 71794
a) Oxígeno
El dioxígeno, O 2, es un gas incoloro e inodoro (bp -183.0 °C) que ocupa 21% del aire (relación volumétrica). Dado que los átomos de oxígeno también son los componentes principales del agua y las rocas, el oxígeno es el elemento más abundante en la superficie de la Tierra. A pesar de su abundancia, se estableció como un elemento tan tarde como el siglo XVIII. Dado que ahora se consume una inmensa cantidad de gas oxígeno para la producción de acero, se separa en grandes cantidades del aire licuado.
Los isótopos de oxígeno son 16 O (99.762% de abundancia), 17 O (0.038%) y 18 O (0.200%). 17 O tiene espín nuclear I = 5/2 y es un nucleido importante para las mediciones de RMN. El 18 O se utiliza como trazador para rastrear reactivos o para el estudio de mecanismos de reacción. También es útil para la asignación de líneas de absorción en espectros infrarrojos o Raman por medio de efectos isotópicos.
Como ya se describió en la sección 2.3 (e), el dioxígeno, O 2, en estado fundamental tiene dos espines desapareados en sus orbitales moleculares, muestra paramagnetismo y se denomina dioxígeno triplete. En el estado excitado, los espines se emparejan y el dioxígeno se vuelve diamagnético, lo que se llama dioxígeno singlete. El dioxígeno singlete es importante en la química sintética, ya que tiene una reactividad de oxidación característica. El dioxígeno singlete se genera en una solución mediante una reacción de transferencia de energía a partir de un complejo fotoactivado o por la pirólisis de ozónidos (compuestos O 3).
El ion superóxido, O 2 -, y el ion peróxido, O 2 2-, son los aniones del dioxígeno (Tabla\(\PageIndex{3}\)). Se pueden aislar como sales de metales alcalinos. Existe otro estado, O 2 +, llamado catión dioxígeno (1+), y puede aislarse como una sal con aniones adecuados.
| Orden de bonos | Compuesto | Distancia O-O (Å) | c/ (O-O) (cm -1) | |
|---|---|---|---|---|
| O 2 + | 2.5 | O 2 [ASf 6] | 1.123 | 1858 |
| O 2 | 2.0 | 1.207 | 1554 | |
| O 2 - | 1.5 | K [O 2] | 1.28 | 1145 |
| O 2 - | 1.0 | Na 2 [O 2] | 1.49 | 842 |
El ozono, O 3, es un alótropo de oxígeno que es un gas inestable con un olor irritante. El ozono es una molécula doblada de tres átomos (117°) y tiene reactividades únicas. En los últimos años se ha descubierto que el ozono juega un papel importante en la interceptación de la radiación ultravioleta perjudicial del sol en la zona atmosférica superior, y en la protección de la vida en la Tierra de los daños fotoquímicos. Ahora está claro que los clorofluorocarbonos, frecuentemente utilizados como refrigerantes o como limpiadores de componentes electrónicos, destruyen la capa de ozono, y se están tomando medidas a escala global para hacer frente a este grave problema ambiental.
b) Óxidos de hidrógeno
El oxígeno es altamente reactivo y las reacciones directas con muchos elementos forman óxidos. El agua es un óxido de hidrógeno y es de vital importancia para el medio ambiente global y la vida en general.
Agua H 2 O
El noventa y siete por ciento del agua en la Tierra está presente como agua de mar, 2% como hielo de la zona polar, y el agua dulce representa solo la pequeña fracción restante. Las propiedades químicas y físicas fundamentales del agua son muy significativas para la química. Las principales propiedades físicas se muestran en la Tabla\(\PageIndex{1}\). La mayoría de las propiedades inusuales del agua son causadas por sus fuertes enlaces de hidrógeno. Las propiedades físicas del agua difieren considerablemente con la presencia de isótopos de hidrógeno. Se conocen al menos nueve polimorfos de hielo y sus estructuras cristalinas dependen de las condiciones de congelación del hielo.
El agua tiene un ángulo de unión de 104.5° y una distancia de enlace de 95.7 pm como molécula libre. Se describe en la Sección 3.4 (b) que la autodisociación del agua genera ion oxonio, H 3 O +. Más moléculas de agua se suman a H 3 O + para formar [H (OH 2) n] + (H 5 O 2 +, H 7 O 3 +, H 9 O 4 + y H 13 O 6 +), y se han determinado las estructuras de las diversas especies.
Peróxido de hidrógeno H 2 O 2
El peróxido de hidrógeno es un líquido casi incoloro (mp -0.89 °C y bp (extrapolado) 151.4 °C) que es altamente explosivo y peligroso en altas concentraciones. Por lo general, se utiliza como solución diluida pero ocasionalmente se utilizan soluciones acuosas al 90%. Dado que se consume en grandes cantidades como agente blanqueador para fibra y papel, se ha establecido un proceso sintético industrial a gran escala. Este proceso aplica reacciones catalíticas muy sutiles para producir una solución diluida de peróxido de hidrógeno a partir del aire e hidrógeno usando una antraquinona sustituida. Esta solución diluida se concentra después.
Cuando se prepara peróxido de deuterio en un laboratorio, se aplica la siguiente reacción.
\[K_{2}S_{2}O_{8} + 2 D_{2} O \rightarrow D_{2} O + 2 KDSO_{4}\]
El peróxido de hidrógeno se descompone en oxígeno y agua en presencia de catalizadores como el dióxido de manganeso, MnO 2. El peróxido de hidrógeno puede ser un oxidante o un reductor dependiendo de sus co-reactivos. Su potencial de reducción en una solución ácida expresado en un diagrama Latimer (consulte la Sección 3.3 (c)) es
\[O_{2} \xrightarrow{+0.70} H_{2}O_{2} \xrightarrow{+1.76} H_{2} O\]
c) Óxidos de silicio
Los óxidos de silicio se forman tomando tetraedros SiO 4 como unidades estructurales y compartiendo los átomos de oxígeno de la esquina. Se clasifican por el número de átomos de oxígeno que comparten esquinas en los tetraedros SiO 4, ya que esto determina su composición y estructura. Cuando los tetraedros SiO 4 se conectan por compartir esquinas, las estructuras de los compuestos poliméricos se convierten en una cadena, un anillo, una capa o tridimensional dependiendo de los modos de conexión de las unidades adyacentes. Se adopta la expresión fraccionaria para mostrar los modos de puenteo. A saber, el numerador en la fracción es el número de oxígenos puente y el denominador es 2, lo que significa que un átomo de oxígeno es compartido por dos tetraedros. Las fórmulas empíricas son las siguientes y cada estructura se ilustra en la Figura\(\PageIndex{9}\) en forma de coordinación-poliedro.
- Se construye un puente con un átomo de oxígeno. (SiO 3 O 1/2) 3- = Si 2 O 7 6-
- Los puentes se construyen con dos átomos de oxígeno. (SiO 2 O 2/2) n 2n- = (SiO 3) n 2n-
- Los puentes se construyen con tres átomos de oxígeno. (SiOO 3/2) n - = (Si 2 O 5) n 2n-
- Amalgamación de modos puente con tres átomos de oxígeno y dos átomos de oxígeno. [(Si 2 O 5) (SiO 2 O 2/2) 2] n 6- = (Si 4 O 11) n 6-
- Los puentes se construyen con cuatro átomos de oxígeno. (SiO 4 /2) n = (SiO 2) n
Los silicatos con diversas estructuras de entrecruzamiento están contenidos en rocas naturales, arena, arcilla, suelo, etc.

Aluminosilicatos
Existen muchos minerales en los que algunos átomos de silicio de minerales de silicato son reemplazados por átomos de aluminio. Se llaman aluminosilicatos. Los átomos de aluminio reemplazan a los átomos de silicio en los sitios tetraédricos u ocupan las cavidades octaédricas de los átomos de oxígeno, complicando las estructuras. La sustitución de un silicio tetravalente por un aluminio trivalente provoca una escasez de carga que se compensa con la oclusión de cationes adicionales como H +, Na +, Ca 2 +, etc. Los feldespatos son un mineral de aluminosilicato típico, y KalSi 3 O También se conocen bien 8 (ortoclasa) y NaAlSi 3 O 8 (albita). Los feldespatos toman estructuras tridimensionales en las que se comparten todas las esquinas de los tetraedros SiO 4 y AlO 4.
Por otro lado, se forman capas bidimensionales si se alinean [AlSiO 5] 3- unidades, y se construyen minerales estratificados como la mica si se insertan iones de 6 coordenadas entre capas. Si el número de átomos de oxígeno en las capas no es suficiente para formar octaedros regulares entre capas, los grupos hidróxido se unen a los iones intersticiales Al 3 +. Moscovita, Kal 2 (OH) 2 Si 3 AlO 10, es un tipo de mica con tal estructura y se puede pelar completamente en capas.
Zeolita
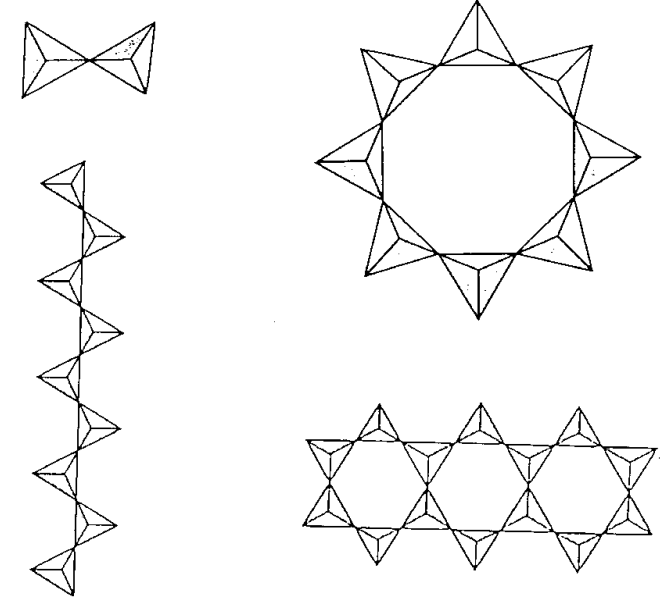
Uno de los aluminosilicatos importantes es la zeolita. Las zeolitas están presentes como minerales naturales y también muchos tipos de zeolitas se preparan sintéticamente en grandes cantidades. Los tetraedros SiO 4 y AlO 4 están unidos por puentes de oxígeno, y forman agujeros y túneles de varios tamaños. Las estructuras son compuestos de las unidades estructurales básicas del MO 4 tetraédrico. Como se muestra en la Figura\(\PageIndex{10}\), las unidades básicas son cubos con 8 MO 4 condensados, prismas hexagonales con 12 MO 4 condensados y octaedros truncados con 24 MO 4 condensados.
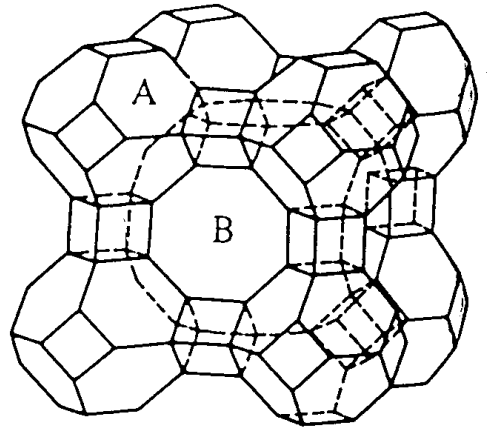
Los átomos de silicio o aluminio se localizan en las esquinas de los poliedros y los átomos de oxígeno puente en la mitad de cada borde (cabe señalar que esta expresión es diferente del modelo poliedro de óxidos).
Cuando estos polihdra están unidos, se forman varios tipos de estructuras de zeolita. Por ejemplo, los octaedros truncados llamados\(\beta\) jaulas son los marcos básicos de zeolita sintética A, Na 12 (Al 12 Si 12 O 48)] • 27H 2 O, y las porciones de cuadrilátero están conectadas a través de cubos. Se puede observar que se forma un túnel octogonal B cuando ocho octaedros truncados se unen de esta manera. La estructura en la que las partes hexagonales se conectan a través de prismas hexagonales es faujasita, NaCa 0.5 (Al 2 Si 5 O 14)] • 10H 2 O.
Los cationes de metales alcalinos o alcalinotérreos existen en los agujeros, y el número de estos cationes aumenta con el contenido de aluminio para compensar la deficiencia de carga. Las estructuras de las zeolitas tienen muchas grietas en las que están contenidos cationes y agua. Utilizando esta propiedad de intercambio catiónico, las zeolitas se utilizan en grandes cantidades como suavizantes de agua dura. Como las zeolitas deshidratadas por calentamiento absorben el agua de manera eficiente, también se utilizan como desecantes de solventes o gases. Las zeolitas a veces se llaman tamices moleculares, ya que los tamaños de los agujeros y túneles cambian con los tipos de zeolitas y es posible segregar moléculas orgánicas según sus tamaños. Las zeolitas pueden fijar las direcciones de más de dos moléculas en sus cavidades y pueden ser utilizadas como catalizadores para reacciones selectivas.
Por ejemplo, la zeolita sintética ZSM-5 es útil como catalizador para convertir metanol en gasolina. Esta zeolita se prepara hidrotérmicamente en un autoclave (recipiente de reacción de alta presión) a ca. 100 °C utilizando luminato metasódico, NaAlO 2, como fuente de óxido de aluminio y sol de sílice como fuente de óxido de silicio con bromuro de tetrapropilamonio, Pr 4 NBr, presente en la reacción. El papel de esta sal de amonio es una especie de molde para formar agujeros de zeolita de un tamaño fijo. Cuando la sal de amonio se elimina por calcinación a 500 °C, la estructura de la zeolita permanece.
d) Óxidos de nitrógeno
Se describirá secuencialmente una variedad de óxidos de nitrógeno de menor a mayor número de oxidación (Cuadro\(\PageIndex{4}\)).
| 1 | 2 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|
| 2 | Li 2 O | BeO | B 2 O 3 | CO CO 2 |
N 2 O NO NO 2 |
||||
| 3 | Na 2 O Na 2 O 2 NaO 2 |
MgO | Al 2 O 3 | SiO 2 | P 4 O 6 P 4 O 10 |
SO 2 SO 3 |
Cl 2 O ClO 2 |
||
| 4 | K 2 O K 2 O 2 KO 2 |
CaO | ZnO | Ga 2 O 3 | GeO 2 | Como 4 O 6 Como 4 O 10 |
SeO 2 SeO 3 |
||
| 5 | Rb 2 O Rb 2 O 2 Rb 9 O 2 |
SRo | CDo | En 2 O 3 | SnO 2 | Sb 4 O 6 Sb 4 O 10 |
TeO 2 TeO 3 |
I 2 O 5 | XEo 3 XEo 4 |
| 6 | Cs 2 O Cs 11 O 3 |
BAo | HGo | Tl 2 O Tl 2 O 3 |
PbO PbO 2 |
Bi 2 O 3 |
Monóxido de dinitrógeno, N 2 O
Óxido de nitrógeno monovalente. La pirólisis del nitrato amónico genera este óxido de la siguiente manera.
\[NH_{4}NO_{3} \xrightarrow{250 \;^{o} C} N_{2} O + 2 H_{2} O\]
Aunque el número de oxidación es una formalidad, es un aspecto interesante y simbólico de la versatilidad del número de oxidación del nitrógeno que NH 4 NO 3 forma un óxido de nitrógeno monovalente (+1 es la mitad del promedio de -3 y +5 para NH 4 y NO 3, respectivamente). Las distancias de enlace N-N-O de la recta N 2 O son 112pm (N-N) y 118pm (N-O), correspondientes al orden de enlace 2.5 y 1.5°, respectivamente. N 2 O (16e) es isoelectrónico con dióxido de carbono CO 2 (16e). Este compuesto también se llama gas de la risa y es ampliamente utilizado para la analgesia.
Óxido nítrico, NO
Un óxido de nitrógeno divalente. Esto se obtiene por reducción de nitrito de la siguiente manera.
\[KNO_{2} + KI + H_{2}SO_{4} \rightarrow NO + K_{2}SO_{4} + H_{2} O + \frac{1}{2} I_{2}\]
Al tener un número impar de electrones de valencia (11 electrones), es paramagnético. La distancia N-O es de 115pm y el enlace tiene carácter de doble enlace. El electrón desapareado en el\(\pi^{*}\) orbital antienlace más alto se elimina fácilmente, y el NO se convierte en NO + (nitrosonio), que es isoelectrónico con CO. Dado que un electrón se pierde del orbital antienlace, el enlace N-O se vuelve más fuerte. Los compuestos NOBF 4 y NOHSO 4 que contienen este catión se utilizan como oxidantes de 1 electrón.
Aunque el NO es paramagnético como monómero en fase gaseosa, la dimerización en la fase ondensa conduce al diamagnetismo. Es único como ligando de complejos de metales de transición y forma complejos como [Fe (CO) 2 (NO) 2], en el que NO es un ligando neutro de 3 electrones. Aunque M-N-O es recto en este tipo de complejos, el ángulo M-N-O se dobla a 120° ~ 140° en [Co (NH 3) 5 NO] Br 2, en el que NO - coordina como un ligando de 4 electrones. Recientemente ha quedado claro que el óxido nítrico tiene diversas funciones de control biológico, como la acción deprimente de la presión arterial, y llama la atención como el segundo material inorgánico después del Ca 2 + para desempeñar un papel en la transducción de señales.
Trióxido de dinitrógeno, N 2 O 3
El número de oxidación del nitrógeno es +3, y este es un compuesto inestable que se descompone en NO y NO 2 a temperatura ambiente. Se genera cuando se condensan cantidades equivalentes de NO y NO 2 a bajas temperaturas. Es azul claro en estado sólido y azul oscuro en estado líquido pero el color se desvanece a temperaturas más altas.
Dióxido de nitrógeno, NO 2
Un compuesto de nitrógeno con número de oxidación +4. Es un compuesto de electrones impares con un electrón desapareado, y es de color marrón rojizo oscuro. Se encuentra en equilibrio con el tetróxido de dinitrógeno dímero incoloro, N 2 O 4. La proporción de NO 2 es de 0.01% a -11 °C, y aumenta gradualmente a 15.9% en su punto de ebullición (21.2 °C), y se convierte en 100% a 140 ° C.
N 2 O 4 se puede generar por la pirólisis de nitrato de plomo de la siguiente manera.
\[2 Pb(NO_{3})_{2} \xrightarrow{400 \;^{o} C} 4 NO_{2} + 2 PbO + O_{2}\]
Cuando el NO 2 se disuelve en agua, se forman ácido nítrico y ácido nitroso.
\[2 NO_{2} + H_{2}O \rightarrow HNO_{3} + HNO_{2}\]
Por oxidación de un electrón, se forma NO 2 + (nitroilo) y el ángulo O-N-O cambia de 134° a 180° en el NO 2 neutro. Por otro lado, por reducción de un electrón, se forma NO2- (nitrito) y el ángulo se dobla a 115°.
El pentóxido de dinitrógeno, N 2 O 5, se obtiene cuando el ácido nítrico concentrado se deshidrata cuidadosamente con pentóxido de fósforo a bajas temperaturas. Se sublima a 32.4 °C, ya que forma ácido nítrico al disolverse en agua, también se le puede llamar anhídrido nítrico.
\[N_{2} O_{5} + H_{2} O \rightarrow 2 HNO_{3}\]
Aunque asume una estructura de par iónico NO 2 NO 3 y los iones NO 2 + rectos y NO 3 planos se localizan alternativamente en la fase sólida, es molecular en la fase gaseosa.
Oxoácidos
Los oxiácidos de nitrógeno incluyen ácido nítrico, HNO 3, ácido nitroso, HNO 2 y ácido hiponitroso, H 2 N 2 O 2. El ácido nítrico, HNO 3, es uno de los ácidos más importantes en la industria química, junto con el ácido sulfúrico y el ácido clorhídrico. El ácido nítrico es producido industrialmente por el proceso de Ostwald, que es la reacción de oxidación del amoníaco en la que el número de oxidación del nitrógeno aumenta de -3 a +5. Debido a que la energía de Gibbs de la conversión directa de dinitrógeno al intermedio NO 2 es positiva, y por lo tanto la reacción es desfavorable termodinámicamente, el dinitrógeno se reduce primero a amoníaco, y éste se oxida luego a NO 2.
\[\stackrel{0}{N_{2}} \rightarrow \stackrel{-3}{NH_{3}} \rightarrow \stackrel{+4}{NO_{2}} \rightarrow \stackrel{+5}{HNO_{3}}\]
Ácido nítrico, HNO 3
El ácido nítrico comercial es una solución acuosa de ca .70% y la destilación al vacío del mismo en presencia de pentóxido de fósforo da ácido nítrico puro. Al ser un agente oxidante srong a la vez que es un ácido fuerte, puede disolver metales (cobre, plata, plomo, etc.) que no se disuelven en otros ácidos. El oro y el platino pueden incluso disolverse en una mezcla de ácido nítrico y ácido clorhídrico (aqua regia). El ion nitrato, NO 3 -, y el ion nitrito, NO 2 -, toman diversas formas de coordinación cuando se coordinan como ligandos en complejos de metales de transición.
Ácido nitroso, HNO 2
Aunque no se aíslan como un compuesto puro, las soluciones acuosas son ácidos débiles (pK a = 3.15 a 25 °C) y reactivos importantes. Dado que el NaNO 2 se usa industrialmente para la producción de hidroxilamina (NH 2 OH) y también se usa para la diazotidación de aminas aromáticas, es importante para la fabricación de colorantes azoicos y fármacos. Entre las diversas formas de coordinación de los isómeros NO 2 - ahora conocidos, los ligandos monodentados nitro (N-coordinación) y nitrito (O-coordinación) ya se habían descubierto en el siglo XIX.
e) Óxidos de fósforo
Se han determinado las estructuras de los óxidos de fósforo P 4 O 10, P 4 O 9, P 4 O 7 y P 4 O 6.
El pentóxido de fósforo, P 4 O 10, es un sólido blanco cristalino y sublimable que se forma cuando el fósforo se oxida completamente. Cuatro átomos de fósforo forman un tetraedro y están puenteados por átomos de oxígeno (consultar la Figura\(\PageIndex{12}\)). Dado que un átomo de oxígeno terminal está unido a cada átomo de fósforo, el poliedro de coordinación del oxígeno también es un tetraedro. Cuando se calienta el P 4 O 10 molecular, se forma un isómero vitrificado. Se trata de un polímero compuesto por tetraedros similares de óxido de fósforo con la misma composición que están conectados entre sí en láminas. Al ser muy reactivo con el agua, el pentóxido de fósforo es un poderoso agente deshidratante. Se utiliza no sólo como desecante, sino que también tiene notables propiedades de deshidratación, y N 2 O 5 o SO 3 se pueden formar por deshidratación de HNO 3 o H 2 SO 4, respectivamente. El pentóxido de fósforo forma ácido ortofosfórico, H 3 PO 4, cuando reacciona con suficiente agua, pero si se usa agua insuficiente, se producen diversos tipos de ácidos fosfóricos condensados dependiendo de la cantidad de agua reaccionante.
El trióxido de fósforo, P 4 O 6, es un óxido molecular, y su estructura tetraédrica es el resultado de la eliminación de solo los átomos de oxígeno terminales del pentóxido de fósforo. Cada fósforo es tri-coordinado. Este compuesto se forma cuando el fósforo blanco se oxida a bajas temperaturas en oxígeno insuficiente. Los óxidos con composiciones intermedias entre pentóxido de fósforo y trióxido tienen de 3 a 1 átomos de oxígeno terminales y sus estructuras han sido analizadas.
Aunque el arsénico y el antimonio dan óxidos moleculares As 4 O 6 y Sb 4 O 6 que tienen estructuras similares a P 4 O 6, el bismuto forma un óxido polimérico de composición Bi 2 O 3.
Ácido fosfórico
Ácido ortofosfórico, H 3 PO 4
Es uno de los principales ácidos utilizados en la industria química, y es producido por la reacción de hidratación del pentóxido de fósforo, P 4 O 10. El ácido fosfórico comercial suele ser de 75-85% de pureza. El ácido puro es un compuesto cristalino (p.f. 42.35 °C). Un átomo de oxígeno terminal y tres grupos OH están unidos al átomo de fósforo en el centro de un tetraedro. Los tres grupos OH liberan protones haciendo que el ácido sea tribásico (pK 1 = 2.15). Cuando dos moléculas de ácido ortofosfórico se condensan por la eliminación de una molécula de H 2 O, se forma ácido pirofosfórico, H 4 P 2 O 7.
Ácido fosfónico, H 3 PO 3
Este ácido también se llama ácido fosforoso y tiene H en lugar de uno de los grupos OH del ácido ortofosfórico. Dado que solo hay dos grupos OH, es un ácido dibásico.
Ácido fosfínico, H 3 PO 2
También se le llama ácido hipofosforoso, y dos de los grupos OH en el ácido ortofosfórico son reemplazados por átomos de H. El grupo OH restante muestra acidez monobásica. Si los tetraedros PO4 en los ácidos de fósforo anteriores se unen por puentes O, se forman muchos ácidos fosfóricos condensados. El trifosfato de adenosina (ATP), el ácido desoxirribonucleico (ADN), etc., en los que los restos de ácido trifósforo se combinan con la adenosina son compuestos de fósforo que son fundamentalmente importantes para los organismos vivos.
f) Óxidos de azufre
Dióxido de azufre, SO 2
Esta se forma por la combustión de azufre o compuestos de azufre. Se trata de un gas incoloro y venenoso (bp -10.0 °C) y como emisión industrial es una de las mayores causas de problemas ambientales. Sin embargo, es muy importante industrialmente como material fuente de azufre. El dióxido de azufre es una molécula angular, y recientemente se ha demostrado que toma varios modos de coordinación como ligando para metales de transición. Es un disolvente no acuoso similar al amoníaco líquido, y se utiliza para reacciones especiales o como disolvente para mediciones especiales de RMN.
Trióxido de azufre, SO 3
Se produce por oxidación catalítica de dióxido de azufre y se utiliza para la fabricación de ácido sulfúrico. El reactivo comercial habitual es un líquido (bp 44.6 °C). El monómero en fase gaseosa es una molécula plana. Se encuentra en equilibrio con un trímero de anillo (\(\gamma\)-SO 3 = S 3 O 9) en fase gaseosa o líquida. En presencia de una cantidad diminuta de agua SO 3 cambia a\(\beta\) -SO 3, que es un alto polímero cristalino con una estructura helicoidal. \(\alpha\)-SO 3 también se conoce como un sólido de estructura laminar aún más complicada. Todos reaccionan violentamente con el agua para formar ácido sulfúrico.
Ácidos de azufre
Aunque hay muchos oxiácidos de azufre, la mayoría de ellos son inestables y no se pueden aislar. Están compuestos por una combinación de enlaces S=O, S-OH, S-O-S y S-S con un átomo central de azufre. Como el número de oxidación de los átomos de azufre varía ampliamente, están involucrados diversos equilibrios redox.
Ácido sulfúrico, H 2 SO 4
Es un importante compuesto básico producido en la mayor cantidad de todos los compuestos inorgánicos. El ácido sulfúrico puro es un líquido viscoso (p.f. 10.37 °C), y se disuelve en agua con la generación de una gran cantidad de calor para dar soluciones fuertemente ácidas.
Ácido tiosulfúrico, H 2 S 2 O 3
Aunque se genera si el tiosulfato se acidifica, el ácido libre es inestable. El ion S 2 O 3 2- se deriva de la sustitución de uno de los átomos de oxígeno de SO 4 2- por azufre, y es ligeramente reductor.
Ácido sulfuroso, H 2 SO 3
La sal es muy estable aunque el ácido libre no ha sido aislado. El ion SO 3 2- que tiene simetría piramidal C 3v es un agente reductor. En el ácido ditiónico, H 2 S 2 O 6, y el ion ditionita S 2 O 6 2-, el número de oxidación del sulfer es +5, y se forma un enlace S-S. Este es un agente reductor muy fuerte.
g) Óxidos metálicos
Los óxidos de todos los elementos metálicos son conocidos y muestran una amplia gama de propiedades en términos de estructuras, acidez y basicidad, y conductividad. A saber, un óxido puede exhibir estructuras moleculares, de cadena unidimensional, de capa bidimensional o tridimensionales. Existen óxidos básicos, anfóteros y ácidos dependiendo de la identidad del elemento metálico. Además, el rango de propiedades físicas que se muestran también es amplio, desde aislantes, hasta semicondutores, conductores metálicos y superconductores. Las composiciones de óxido metálico pueden ser simplemente estequiométricas, estequiométricas pero no simples, o a veces no estequiométricas. Por lo tanto, es mejor clasificar los óxidos de acuerdo a cada propiedad. Sin embargo, dado que las estructuras dan la información más útil para comprender las propiedades físicas y químicas, los óxidos típicos se clasifican primero de acuerdo con la dimensionalidad de sus estructuras (Tabla\(\PageIndex{4}\), Tabla\(\PageIndex{5}\)).
| Número de oxidación | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|
| +1 | Ti 2 O l | Cu 2 O Ag 2 O |
|||||||
| +2 | TiO | VO NbO |
MnO | FeO | CoO | NiO | CuO Ag 2 O 2 |
||
| +3 | Sc 2 O 3 Y 2 O 3 |
Ti 2 O 3 | V 2 O 3 | Cr 2 O 3 | Fe 2 O 3 | Rh 2 O 3 | |||
| +4 | TiO 2 ZrO 2 HfO 2 |
VO 2 NbO 2 TaO 2 |
CrO 2 MoO 2 WO 2 |
MnO 2 tCo 2 ReO 2 |
RuO 2 Oso 2 |
RHo 2 iRO 2 |
Pto 2 | ||
| +5 | V 2 O 5 i Nb 2 O 5 Ta 2 O 5 |
||||||||
| +6 | CrO 3 c MoO 3 l WO 3 |
ReO 3 | |||||||
| +7 | Re 2 O 7 l | ||||||||
| +8 | RuO 4 m OsO 4 m |
m molecular, cadena c, capa l, otros 3-demencias.

