2.1.2: Descubrimiento de partículas subatómicas y el átomo de Bohr
- Page ID
- 81217
Espectros de absorción y emisión de hidrógeno
Cuando se pasa una descarga eléctrica de alto voltaje a través de una muestra de gas hidrógeno (H 2) a baja presión, el resultado son átomos de hidrógeno aislados individuales que emiten una luz roja. A diferencia de la radiación de cuerpo negro, el color de la luz emitida por los átomos de hidrógeno no depende en gran medida de la temperatura del gas en el tubo. Cuando la luz emitida pasa a través de un prisma, solo se observan unas pocas líneas estrechas de longitudes de onda particulares, llamadas espectro de líneas, en lugar de un rango continuo de longitudes de onda (Figura\(\PageIndex{1}\)). La luz emitida por los átomos de hidrógeno es roja debido a que, de sus cuatro líneas características, la línea más intensa en su espectro se encuentra en la porción roja del espectro visible, a 656 nm.
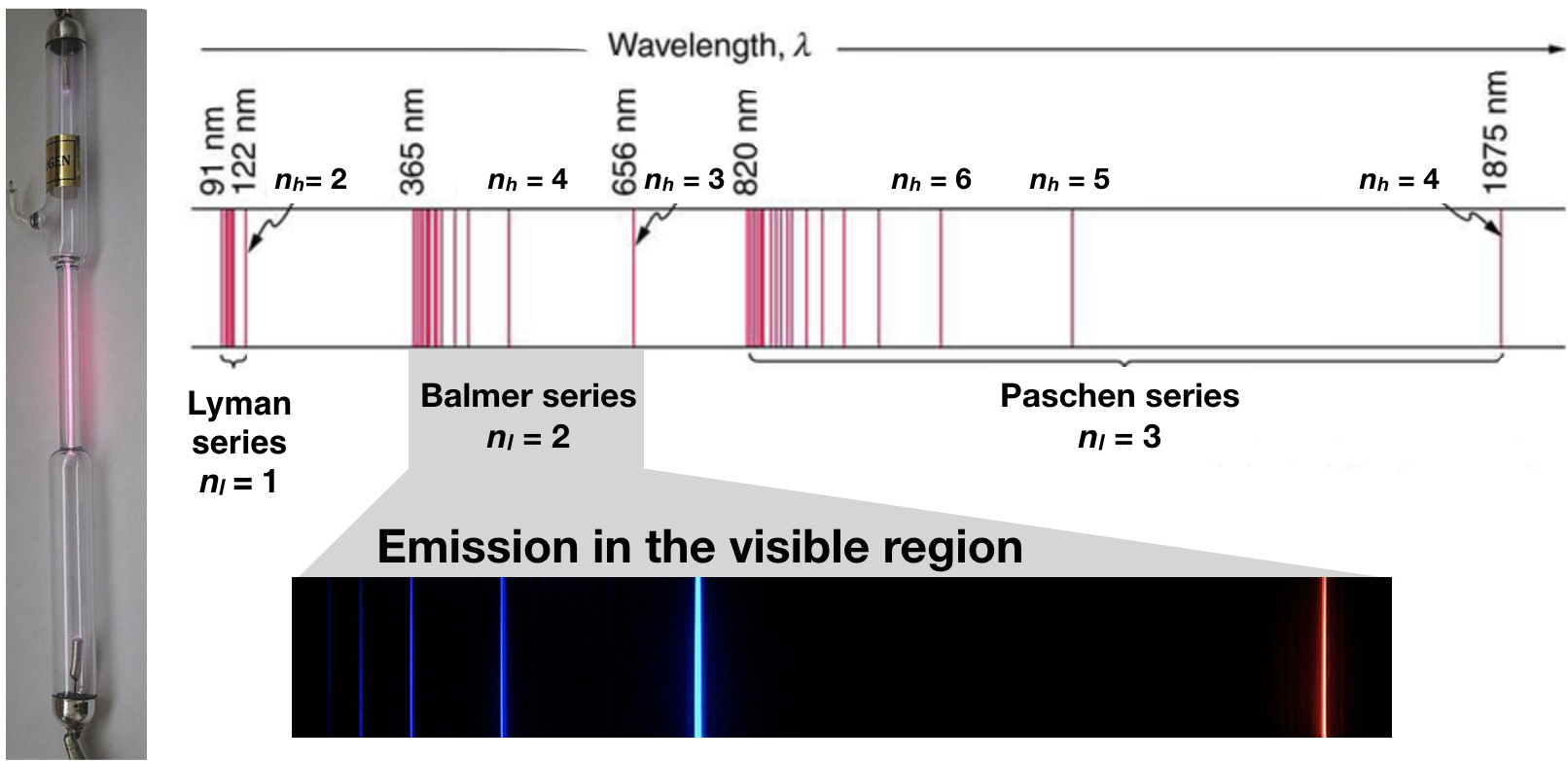
La serie Balmer
En 1885, un profesor suizo de matemáticas, Johann Balmer (1825—1898), demostró que las frecuencias de las líneas observadas en la región visible del espectro lineal de hidrógeno se ajustan a una ecuación simple que puede expresarse de la siguiente manera:
\[ u=constant\; \left ( \dfrac{1}{2^{2}}-\dfrac{1}{n^{^{2}}} \right ) \label{6.3.1} \]
donde n = 3, 4, 5, 6. En consecuencia, estas líneas son conocidas como la serie Balmer. El físico sueco Johannes Rydberg (1854-1919) posteriormente reafirmó y amplió el resultado de Balmer en la ecuación de Rydberg:
\[ \dfrac{1}{\lambda }=R_H\; \left ( \dfrac{1}{n_l^{2}}-\dfrac{1}{n_h^{2}} \right ) \label{6.3.2} \],
donde\(n_l\) y\(n_h\) son enteros positivos, y\(n_h > n_l\)\(R_H\), la constante de Rydberg, tiene un valor de 1.09737 × 10 7 m −1. Al igual que la ecuación de Balmer, la ecuación simple de Rydberg describió las longitudes de onda de las líneas visibles en el espectro de emisión de hidrógeno (con\(n_l = 2, n_h = 3, 4, 5,…\)). Más importante aún, la ecuación de Rydberg también predijo las longitudes de onda de otras series de líneas que se observarían en el espectro de emisión de hidrógeno: una en el ultravioleta (\(n_l = 1, n_h = 2, 3, 4,…\)) y otra en la infrarroja (\(n_l = 3, n_h = 4, 5, 6\)).
Otras series
Los resultados dados por Balmer y Rydberg para el espectro en la región visible del espectro electromagnético comienzan con\(n_h = 3\), y\(n_l=2\).
¿Hay una serie diferente con la siguiente fórmula (e.g.,\(n_l=1\))?
\[\dfrac{1}{\lambda} = R_{\textrm H} \left(\dfrac{1}{1^2} - \dfrac{1}{n^2} \right ) \label{1.5.2} \]
Los valores para\(n_h\) y número de onda\( u\) para esta serie serían:
| \(n_h\) | 2 | 3 | 4 | 5 |
|---|---|---|---|---|
| \ (n_h\)” alcance="fila” style="vertical-align:middle; ">\(\lambda\) (nm) | 121 | 102 | 97 | 94 |
| \ (n_h\)” alcance="fila” style="vertical-align:middle; ">\(\widetilde{ u}\) (cm -1) | 82,2291 | 97,530 | 102,864 | 105,332 |
¿Sabes en qué región de la radiación electromagnética se encuentran estas líneas? Por supuesto, estas líneas están en la región UV, y no son visibles, pero son detectadas por instrumentos; estas líneas forman una serie de Lyman. Las existencias de la serie Lyman y la serie de Balmer sugieren la existencia de más series. Por ejemplo, la serie con\(n_2^2 = 3\) y\(n_1^2\) = 4, 5, 6, 7,... se llama la serie Pashen.
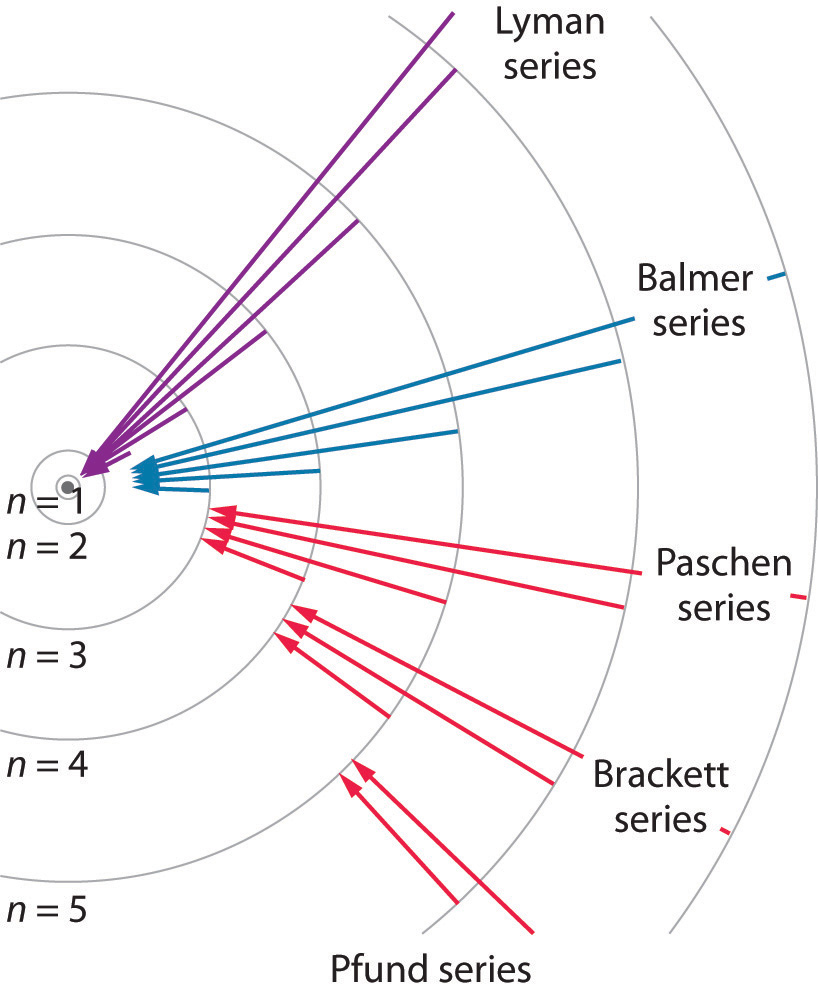
Las líneas espectrales se agrupan en series según\(n_1\) los valores. Las líneas se nombran secuencialmente a partir de la longitud de onda más larga/frecuencia más baja de la serie usando letras griegas dentro de cada serie. Por ejemplo, la línea (\(n_1=1/n_2=2\)) se llama “Lyman-alfa” (Ly-α), mientras que la línea (\(n_1=3/n_2=7\)) se llama “Paschen-delta” (PA-δ). Las primeras seis series tienen nombres específicos:
- Serie Lyman con\(n_1 = 1\)
- Serie Balmer con\(n_1 = 2\)
- Serie Paschen (o serie Bohr) con\(n_1 = 3\)
- Serie Brackett con\(n_1 = 4\)
- Serie Pfund con\(n_1 = 5\)
- Serie Humphreys con\(n_1 = 6\)
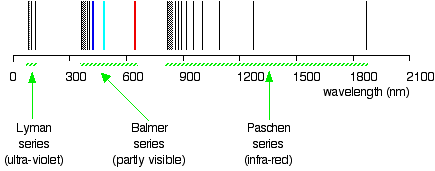
La serie espectral de hidrógeno basada en la ecuación de Rydberg (en una escala logarítmica).
La llamada serie de líneas Lyman en el espectro de emisión de hidrógeno corresponde a transiciones de varios estados excitados a la órbita n = 1. Calcular la longitud de onda de la línea de menor energía en la serie Lyman a tres cifras significativas. ¿En qué región del espectro electromagnético se produce?
Dado: órbita de menor energía en la serie Lyman
Preguntado por: longitud de onda de la línea Lyman de menor energía y región correspondiente del espectro
Estrategia:
- Sustituir los valores apropiados en Ecuación\(Ref{2.1.2.2}\) (la ecuación de Rydberg) y resolver para\(\lambda\).
- Localizar la región del espectro electromagnético correspondiente a la longitud de onda calculada.
Solución:
Podemos usar la ecuación de Rydberg (Ecuación\(Ref{2.1.2.2}\) para calcular la longitud de onda:
\[ \dfrac{1}{\lambda }=R_H \left ( \dfrac{1}{n_l^{2}} - \dfrac{1}{n_h^{2}}\right ) \nonumber \]
A Para la serie Lyman,\(n_1 = 1\).
\[ \begin{align*} \dfrac{1}{\lambda } &=R_H \left ( \dfrac{1}{n_l^{2}} - \dfrac{1}{n_h^{2}}\right ) \\[4pt] &=1.097 \times m^{-1}\left ( \dfrac{1}{1}-\dfrac{1}{4} \right )\\[4pt] &= 8.228 \times 10^{6}\; m^{-1} \end{align*} \nonumber \]
Los espectroscopistas suelen hablar de energía y frecuencia como equivalentes. La unidad cm -1 (números de onda) es particularmente conveniente. Podemos convertir la respuesta en la parte A a cm -1.
\[ \begin{align*} \widetilde{ u} &=\dfrac{1}{\lambda } \\[4pt] &= 8.228\times 10^{6}\cancel{m^{-1}}\left (\dfrac{\cancel{m}}{100\;cm} \right ) \\[4pt] &= 82,280\: cm^{-1} \end{align*} \nonumber \]
y
\[\lambda = 1.215 \times 10^{−7}\; m = 122\; nm \nonumber \]
Esta línea de emisión se llama Lyman alfa y es la línea de emisión atómica más fuerte del sol; impulsa la química de la atmósfera superior de todos los planetas produciendo iones al separar electrones de átomos y moléculas. Es completamente absorbido por el oxígeno en la estratosfera superior, disociando las moléculas de O 2 a átomos de O, que reaccionan con otras moléculas de O 2 para formar ozono estratosférico (O 3).
B Esta longitud de onda se encuentra en la región ultravioleta del espectro.
La serie Pfund de líneas en el espectro de emisión de hidrógeno corresponde a transiciones de estados más excitados a\(n_1 = 5\). Calcular la longitud de onda de la segunda línea en la serie Pfund a tres cifras significativas. ¿En qué región del espectro se encuentra?
- Contestar
-
\(4.65 \times 10^3\, nm\); infrarrojos
La discusión anterior presenta solo una descripción fenomenológica de las líneas de emisión de hidrógeno. Balmer y Rydberg pudieron predecir dónde podrían ocurrir las líneas de emisión, pero no pudieron explicar por qué las líneas siguieron este patrón usando alguna teoría útil. Para una explicación de por qué los átomos demuestran espectros de emisión discretos, se desarrollaron teorías cuánticas.
El modelo Bohr
En 1913, un físico danés, Niels Bohr (1885—1962; Premio Nobel de Física, 1922), propuso un modelo teórico para el átomo de hidrógeno que explicaba su espectro de emisión. El modelo de Bohr requirió solo una suposición: El electrón se mueve alrededor del núcleo en órbitas circulares que solo pueden tener ciertos radios permitidos. El modelo anterior del átomo de Rutherford también había asumido que los electrones se movían en órbitas circulares alrededor del núcleo y que el átomo se mantenía unido por la atracción electrostática entre el núcleo cargado positivamente y el electrón cargado negativamente. Aunque ahora sabemos que la suposición de órbitas circulares era incorrecta, la perspicacia de Bohr también postuló que el electrón solo podía ocupar ciertas regiones del espacio.
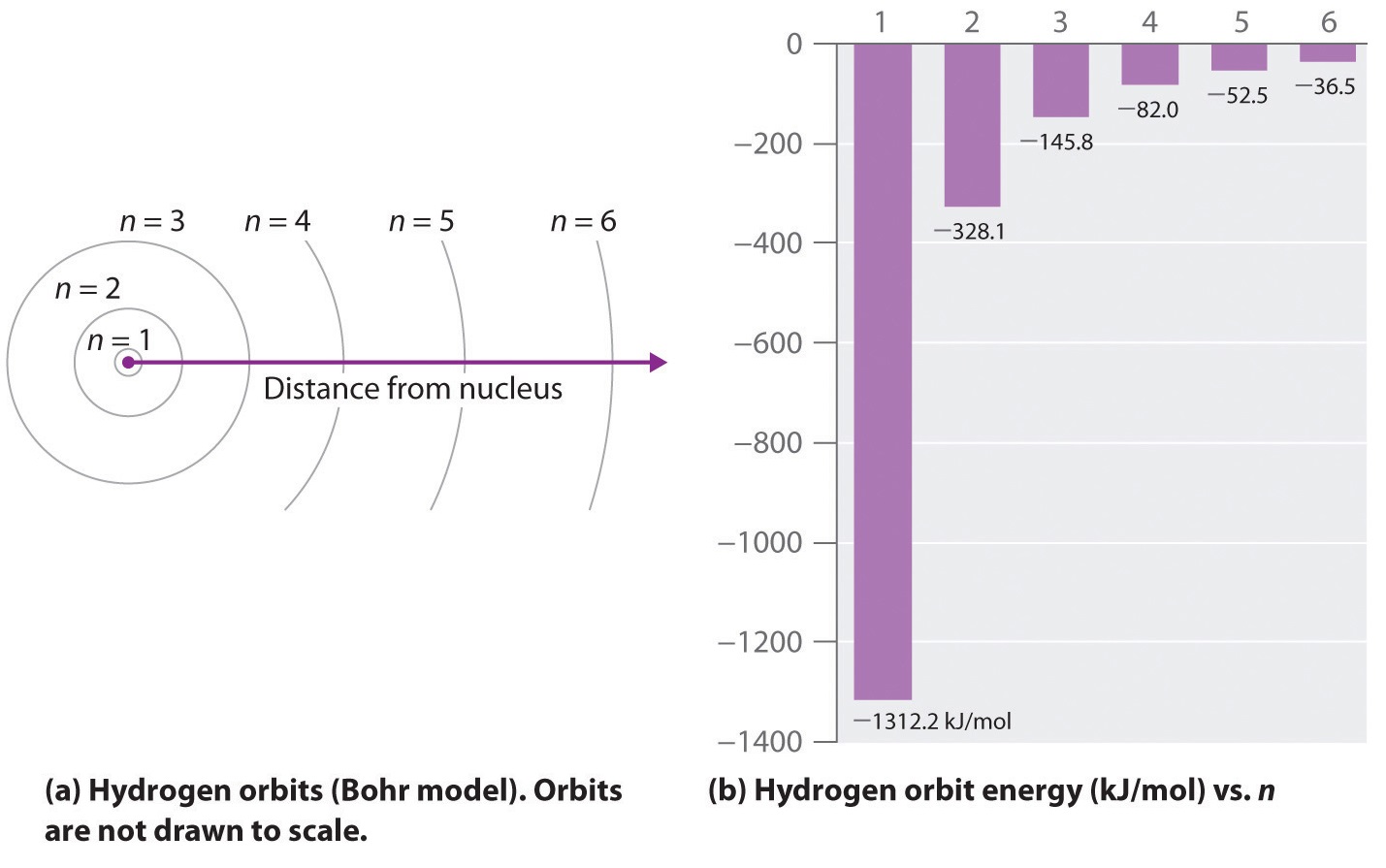
Utilizando la física clásica, Niels Bohr demostró que la energía de un electrón en una órbita particular viene dada por
\[ E_{n}=\dfrac{-R_Hhc}{n^{2}} \label{2.1.2.4} \]
donde\(R_H\) es la constante de Rydberg, h es la constante de Planck, c es la velocidad de la luz, y n es un entero positivo correspondiente al número asignado a la órbita, con n = 1 correspondiente a la órbita más cercana al núcleo. En este modelo n = ∞ corresponde al nivel donde la energía que sostiene el electrón y el núcleo juntos es cero. En ese nivel, el electrón se desune del núcleo y el átomo se ha separado en un ion cargado negativamente (el electrón) y un ion cargado positivamente (el núcleo). En este estado el radio de la órbita también es infinito. El átomo ha sido ionizado.
Durante la ocupación nazi de Dinamarca en la Segunda Guerra Mundial, Bohr escapó a Estados Unidos, donde se asoció con el Proyecto de Energía Atómica.

En sus últimos años, se dedicó a la aplicación pacífica de la física atómica y a resolver los problemas políticos derivados del desarrollo de las armas atómicas.
A medida que n disminuye, la energía que mantiene unidos al electrón y al núcleo se vuelve cada vez más negativa; el radio de la órbita se contrae y se necesita más energía para ionizar el átomo. La órbita con n = 1 es la menor acostada y más apretada. El signo negativo en la Ecuación\(\ref{6.3.3}\) indica que el par electrón-núcleo está más estrechamente unido (es decir, a una energía potencial más baja) cuando están cerca uno del otro que cuando están muy separados. Debido a que un átomo de hidrógeno con su electrón en esta órbita tiene la energía más baja posible, este es el estado fundamental (la disposición más estable de electrones para un elemento o un compuesto) para un átomo de hidrógeno. A medida que n aumenta, el radio de la órbita aumenta; el electrón está más alejado del protón, lo que resulta en una disposición menos estable con mayor energía potencial (Figura\(\PageIndex{2a}\)). Un átomo de hidrógeno con un electrón en una órbita con n > 1 se encuentra, por lo tanto, en un estado excitado, definido como cualquier disposición de electrones que sea mayor en energía que el estado fundamental. Cuando un átomo en estado excitado experimenta una transición al estado fundamental en un proceso llamado decaimiento, pierde energía al emitir un fotón cuya energía corresponde a la diferencia de energía entre los dos estados (Figura\(\PageIndex{1}\)).
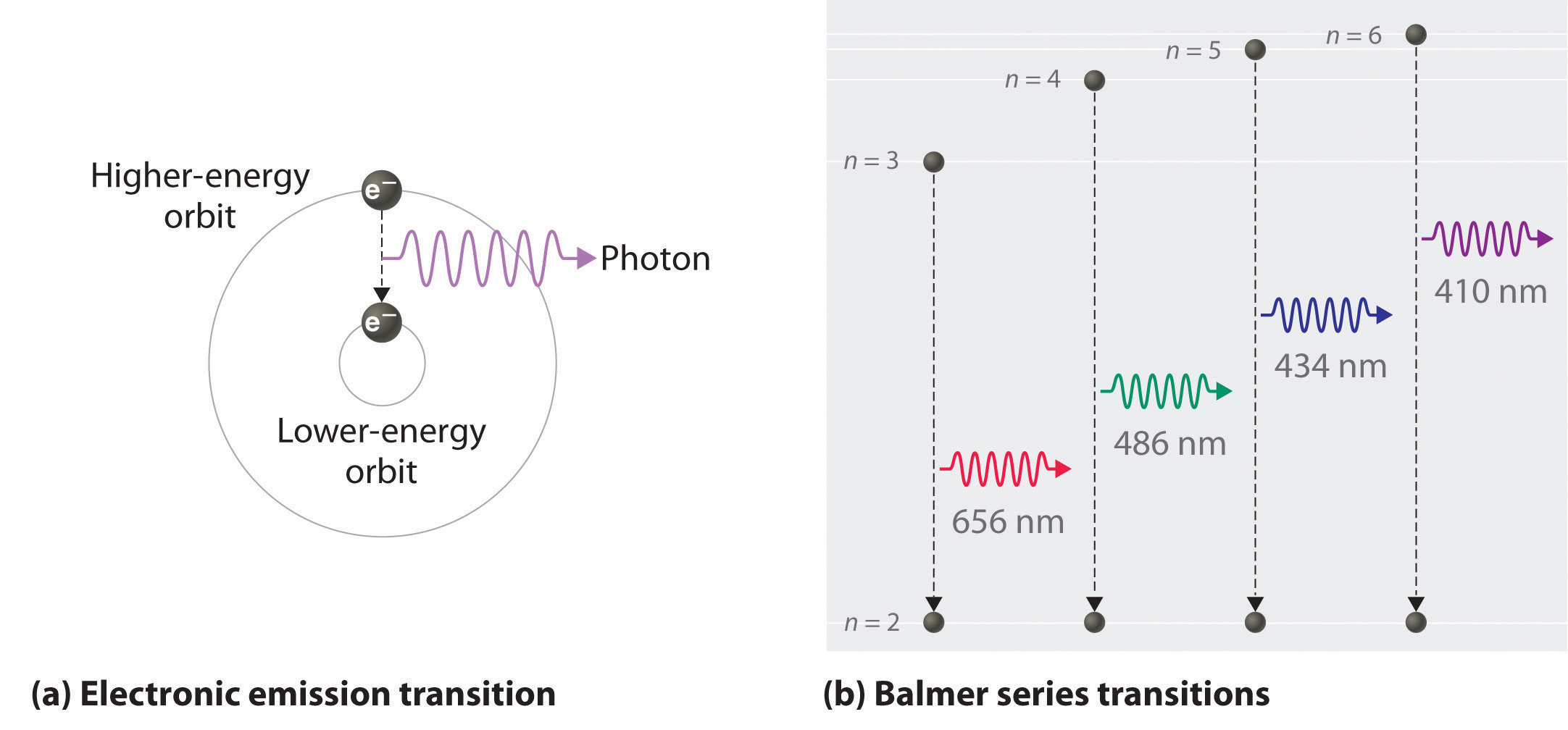
Entonces la diferencia de energía (Δ E) entre dos órbitas o niveles de energía cualesquiera viene dada por\( \Delta E=E_{n_l}-E_{n_h} \), donde\(n_l\) está la órbita final y\(n_h\) la órbita inicial. Sustituir de la ecuación de Bohr (Ecuación 2.1.2.4) para cada valor energético da
\[ \Delta E=E_{final}-E_{initial}=-\dfrac{R_H hc}{n_h^{2}}-\left ( -\dfrac{R_H hc}{n_l^{2}} \right )=-R_H hc\left ( \dfrac{1}{n_h^{2}} - \dfrac{1}{n_l^{2}}\right ) \label{6.3.4} \]
Si n h > n l, la transición es de un estado de mayor energía (órbita de mayor radio) a un estado de menor energía (órbita de menor radio), como lo muestra la flecha discontinua en la parte (a) de la Figura\(\PageIndex{3}\). Sustituyendo hc /λ por Δ E da
\[ \Delta E = \dfrac{hc}{\lambda }=-R_H hc\left ( \dfrac{1}{n_h^{2}} - \dfrac{1}{n_l^{2}}\right ) \label{6.3.5} \]
Cancelando hc en ambos lados da
\[ \dfrac{1}{\lambda }=-R_H \left ( \dfrac{1}{n_h^{2}} - \dfrac{1}{n_l^{2}}\right ) \label{6.3.6} \]
Excepto por el signo negativo, esta es la misma ecuación que Rydberg obtuvo experimentalmente. El signo negativo en Ecuaciones\(\ref{6.3.5}\) e\(\ref{6.3.6}\) indica que la energía se libera\(n_h\) a medida que el electrón se mueve de órbita en órbita\(n_l\) porque la órbita\(n_h\) está a una energía más alta que la órbita\(n_l\). Bohr calculó el valor de\(R_H\) a partir de constantes fundamentales como la carga y masa del electrón y la constante de Planck y obtuvo un valor de 1.0974 × 10 7 m −1, el mismo número que Rydberg había obtenido al analizar los espectros de emisión.
Ahora podemos entender la base física de la serie de líneas Balmer en el espectro de emisión de hidrógeno (\(\PageIndex{3b}\)); las líneas de esta serie corresponden a transiciones de órbitas de mayor energía (n > 2) a la segunda órbita (n = 2). Así, los átomos de hidrógeno en la muestra han absorbido energía de la descarga eléctrica y decaído de un estado excitado de mayor energía (n > 2) a un estado de menor energía (n = 2) al emitir un fotón de radiación electromagnética cuya energía corresponde exactamente a la diferencia de energía entre los dos estados ( Figura\(\PageIndex{3a}\)). La transición n = 3 a n = 2 da lugar a la línea a 656 nm (rojo), la transición n = 4 a n = 2 a la línea a 486 nm (verde), la transición n = 5 a n = 2 a la línea a 434 nm (azul), y la transición n = 6 a n = 2 a la línea a 410 nm (violeta). Debido a que una muestra de hidrógeno contiene un gran número de átomos, la intensidad de las diversas líneas en un espectro lineal depende del número de átomos en cada estado excitado. A la temperatura en el tubo de descarga de gas, hay más átomos en los niveles n = 3 que en los niveles n ≥ 4. En consecuencia, la transición n = 3 a n = 2 es la línea más intensa, produciendo el color rojo característico de una descarga de hidrógeno (Figura\(\PageIndex{1a}\)). Otras familias de líneas son producidas por transiciones de estados excitados con n > 1 a la órbita con n = 1 o a órbitas con n ≥ 3. Estas transiciones se muestran esquemáticamente en la Figura\(\PageIndex{4}\):
En aplicaciones contemporáneas, las transiciones de electrones se utilizan en el cronometraje que necesita ser exacto. Los sistemas de telecomunicaciones, como los teléfonos celulares, dependen de señales de temporización que son precisas dentro de una millonésima de segundo por día; lo mismo ocurre con los dispositivos que controlan la red eléctrica estadounidense. Las señales del sistema de posicionamiento global (GPS) deben ser precisas dentro de una billonésima de segundo por día, lo que equivale a ganar o perder no más de un segundo en 1,400,000 años. Cuantificar el tiempo requiere encontrar un evento con un intervalo que se repita de forma regular.
Para lograr la precisión requerida para los propósitos modernos, los físicos se han vuelto hacia el átomo. El estándar actual utilizado para calibrar relojes es el átomo de cesio. Los átomos de cesio superenfriados se colocan en una cámara de vacío y se bombardean con microondas cuyas frecuencias se controlan cuidadosamente. Cuando la frecuencia es exactamente la correcta, los átomos absorben suficiente energía para someterse a una transición electrónica a un estado de mayor energía. La decadencia a un estado de menor energía emite radiación. La frecuencia de microondas se ajusta continuamente, sirviendo como péndulo del reloj.
En 1967, el segundo se definió como la duración de 9,192 mil 631,770 oscilaciones de la frecuencia resonante de un átomo de cesio, llamado reloj de cesio. Actualmente se están realizando investigaciones para desarrollar la próxima generación de relojes atómicos que prometen ser aún más precisos. Dichos dispositivos permitirían a los científicos monitorear las señales electromagnéticas que se desvanecen débiles producidas por las vías nerviosas en el cerebro y permitirían a los geólogos medir variaciones en los campos gravitacionales, que provocan fluctuaciones en el tiempo, que ayudarían en el descubrimiento de petróleo o minerales.
La llamada serie de líneas Lyman en el espectro de emisión de hidrógeno corresponde a transiciones de varios estados excitados a la órbita n = 1. Calcular la longitud de onda de la línea de menor energía en la serie Lyman a tres cifras significativas. ¿En qué región del espectro electromagnético se produce?
Dado: órbita de menor energía en la serie Lyman
Preguntado por: longitud de onda de la línea Lyman de menor energía y región correspondiente del espectro
Estrategia:
- Sustituir los valores apropiados en la Ecuación 2.1.2.4 (la ecuación de Rydberg) y resolver para\(\lambda\).
- Utilice la Figura 2.2.1 para ubicar la región del espectro electromagnético correspondiente a la longitud de onda calculada.
Solución:
Podemos usar la ecuación de Rydberg para calcular la longitud de onda:
\[ \dfrac{1}{\lambda }=-R_H \left ( \dfrac{1}{n_h^{2}} - \dfrac{1}{n_l^{2}}\right ) \nonumber \]
A Para la serie Lyman,/(n_l = 1\). La línea de menor energía se debe a una transición de la órbita n = 2 a n = 1 porque son las más cercanas en energía.
\[ \dfrac{1}{\lambda }=-R_H \left ( \dfrac{1}{n_h^{2}} - \dfrac{1}{n_l^{2}}\right )=1.097\times m^{-1}\left ( \dfrac{1}{1}-\dfrac{1}{4} \right )=8.228 \times 10^{6}\; m^{-1} \nonumber \]
Resulta que los espectroscopistas (las personas que estudian espectroscopía) utilizan cm -1 en lugar de m -1 como unidad común. La longitud de onda es inversamente proporcional a la energía, pero la frecuencia es directamente proporcional como lo muestra la fórmula de Planck, E=h\( u \).
Los espectroscopistas suelen hablar de energía y frecuencia como equivalentes. La unidad cm -1 es particularmente conveniente. El rango infrarrojo es aproximadamente 200 - 5,000 cm -1, el visible de 11,000 a 25,000 cm -1 y el UV entre 25,000 y 100,000 cm -1. Las unidades de cm -1 se llaman números de onda, aunque la gente suele referirse a la unidad como centímetros inversos. Podemos convertir la respuesta en la parte A a cm -1.
\[ \widetilde{ u} =\dfrac{1}{\lambda }=8.228\times 10^{6}\cancel{m^{-1}}\left (\dfrac{\cancel{m}}{100\;cm} \right )=82,280\: cm^{-1} \nonumber \]
y
\[\lambda = 1.215 \times 10^{−7}\; m = 122\; nm \nonumber \]
Esta línea de emisión se llama Lyman alfa. Como la línea de emisión atómica más fuerte del sol, impulsa la química de la atmósfera superior de todos los planetas, produciendo iones al separar electrones de átomos y moléculas. Es completamente absorbido por el oxígeno en la estratosfera superior, disociando las moléculas de O 2 a átomos de O que reaccionan con otras moléculas de O 2 para formar ozono estratosférico.
B Esta longitud de onda se encuentra en la región ultravioleta del espectro.
La serie Pfund de líneas en el espectro de emisión de hidrógeno corresponde a transiciones de estados excitados superiores a la órbita n = 5. Calcular la longitud de onda de la segunda línea en la serie Pfund a tres cifras significativas. ¿En qué región del espectro se encuentra?
- Contestar
-
4.65 × 10 3 nm; infrarrojo
El modelo de Bohr del átomo de hidrógeno dio una explicación exacta de su espectro de emisión observado. Las siguientes son sus contribuciones clave a nuestra comprensión de la estructura atómica:
- Los electrones pueden ocupar sólo ciertas regiones del espacio, llamadas órbitas.
- Las órbitas más cercanas al núcleo son más bajas en energía.
- Los electrones pueden moverse de una órbita a otra absorbiendo o emitiendo energía, dando lugar a espectros característicos.
Desafortunadamente, Bohr no pudo explicar por qué el electrón debería restringirse a órbitas particulares. Además, a pesar de muchas conjeturas, como suponer que las órbitas podrían ser elipses en lugar de círculos, su modelo no pudo explicar cuantitativamente los espectros de emisión de ningún elemento que no sea hidrógeno (Figura\(\PageIndex{5}\)). De hecho, el modelo de Bohr sólo funcionaba para especies que contenían un solo electrón: H, He +, Li 2 +, y así sucesivamente. Los científicos necesitaban un cambio fundamental en su forma de pensar sobre la estructura electrónica de los átomos para avanzar más allá del modelo Bohr.



Los Estados Energéticos del Átomo de Hidrógeno
Hasta ahora, hemos considerado explícitamente solo la emisión de luz por átomos en estados excitados, lo que produce un espectro de emisión (un espectro producido por la emisión de luz por átomos en estados excitados). Lo contrario, la absorción de luz por los átomos de estado fundamental para producir un estado excitado, también puede ocurrir, produciendo un espectro de absorción (un espectro producido por la absorción de luz por los átomos de estado fundamental).
Cuando un átomo emite luz, decae a un estado de energía inferior; cuando un átomo absorbe la luz, se excita a un estado de energía superior.
Si la luz blanca pasa a través de una muestra de hidrógeno, los átomos de hidrógeno absorben energía a medida que un electrón se excita a niveles de energía más altos (órbitas con n ≥ 2). Si la luz que emerge se pasa a través de un prisma, forma un espectro continuo con líneas negras (correspondientes a que no pasa luz a través de la muestra) a 656, 468, 434 y 410 nm. Estas longitudes de onda corresponden a las transiciones n = 2 a n = 3, n = 2 a n = 4, n = 2 a n = 5, y n = 2 a n = 6 transiciones. Por lo tanto, cualquier elemento tiene tanto un espectro de emisión característico como un espectro de absorción característico, que son esencialmente imágenes complementarias.

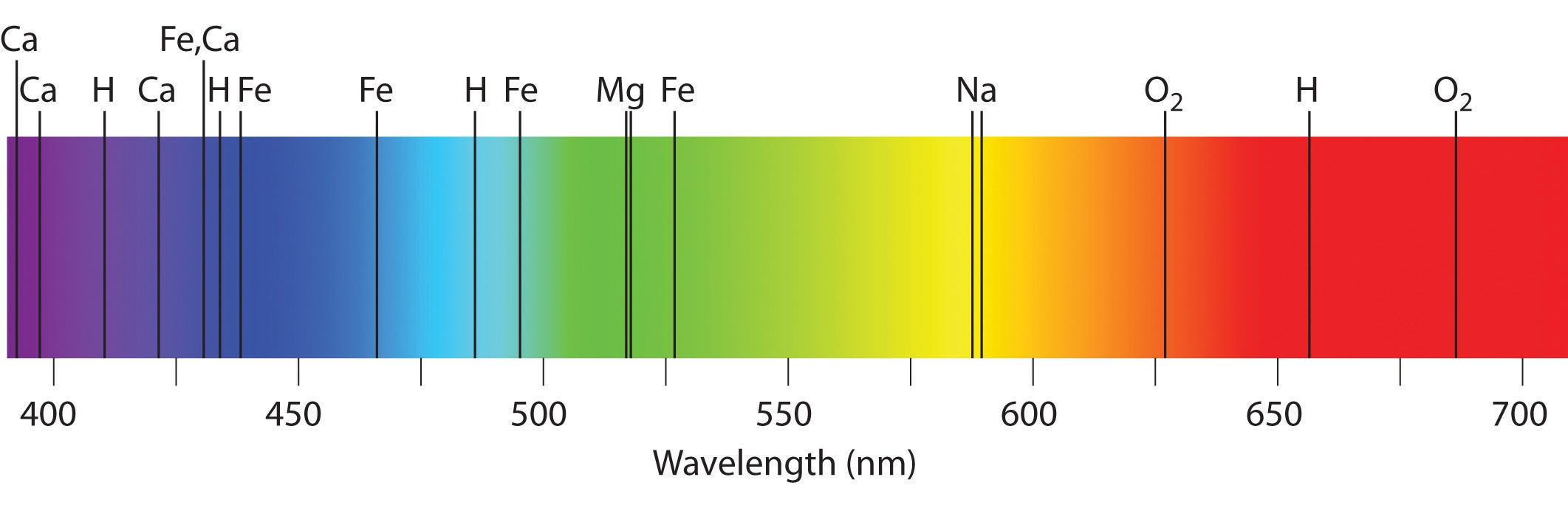
Los espectros de emisión y absorción forman la base de la espectroscopia, que utiliza espectros para proporcionar información sobre la estructura y la composición de una sustancia u objeto. En particular, los astrónomos utilizan espectros de emisión y absorción para determinar la composición de las estrellas y la materia interestelar. Como ejemplo, considere el espectro de luz solar que se muestra en la Figura\(\PageIndex{7}\). Dado que el sol es muy caluroso, emite luz en forma de espectro de emisión continua. Superpuesta en el espectro, sin embargo, hay una serie de líneas oscuras principalmente resultantes de la absorción de frecuencias específicas de luz por átomos más fríos en la atmósfera exterior del sol. Al comparar estas líneas con los espectros de elementos medidos en la Tierra, ahora sabemos que el sol contiene grandes cantidades de hidrógeno, hierro y carbono, junto con cantidades menores de otros elementos. Durante el eclipse solar de 1868, el astrónomo francés Pierre Janssen (1824-1907) observó un conjunto de líneas que no coincidían con las de ningún elemento conocido. Sugirió que se debían a la presencia de un nuevo elemento, al que llamó helio, del griego helios, que significa “sol”. El helio (He) finalmente fue descubierto en minerales de uranio en la Tierra en 1895. Las partículas alfa son núcleos de helio. Las partículas alfa emitidas por los núcleos de uranio radiactivo recogen electrones de las rocas para formar átomos de helio.
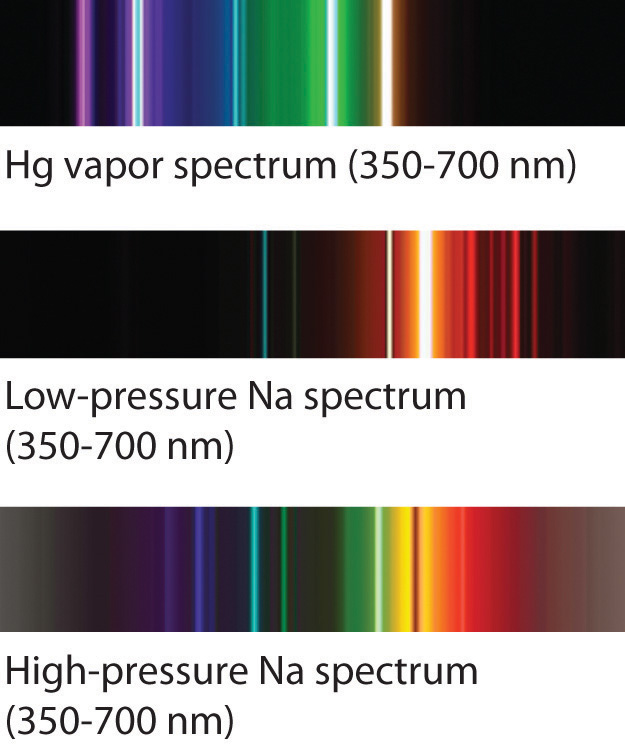
El familiar color rojo de los letreros de neón utilizados en la publicidad se debe al espectro de emisión de neón mostrado en la parte (b) en la Figura\(\PageIndex{5}\). De igual manera, los colores azul y amarillo de ciertas luces de la calle son causados, respectivamente, por descargas de mercurio y sodio. En todos estos casos, una descarga eléctrica excita los átomos neutros a un estado de mayor energía, y se emite luz cuando los átomos descomponen al estado fundamental. En el caso del mercurio, la mayoría de las líneas de emisión están por debajo de 450 nm, lo que produce una luz azul (parte (c) en la Figura\(\PageIndex{5}\)). En el caso del sodio, las líneas de emisión más intensas se encuentran a 589 nm, lo que produce una luz amarilla intensa.
Resumen
Existe una conexión íntima entre la estructura atómica de un átomo y sus características espectrales. Los átomos de los elementos individuales emiten luz solo a longitudes de onda específicas, produciendo un espectro lineal en lugar del espectro continuo de todas las longitudes de onda producidas por un objeto caliente. Niels Bohr explicó el espectro lineal del átomo de hidrógeno asumiendo que el electrón se movía en órbitas circulares y que se permitían órbitas con solo ciertos radios. Las líneas en el espectro se debieron a transiciones en las que un electrón se movía de una órbita de mayor energía con un radio mayor a una órbita de menor energía con menor radio. La órbita más cercana al núcleo representaba el estado fundamental del átomo y era más estable; las órbitas más alejadas eran estados excitados de mayor energía. Las transiciones de un estado excitado a un estado de menor energía resultaron en la emisión de luz con solo un número limitado de longitudes de onda. Los átomos también pueden absorber la luz de ciertas energías, lo que resulta en una transición del estado fundamental o un estado excitado de menor energía a un estado excitado de mayor energía. Esto produce un espectro de absorción, que tiene líneas oscuras en la misma posición que las líneas brillantes en el espectro de emisión de un elemento. El modelo de Bohr revolucionó la comprensión del átomo pero no pudo explicar los espectros de átomos más pesados que el hidrógeno.
Colaboradores y Atribuciones
Modified by Joshua Halpern (Howard University)


