2.3.1: Energía de ionización
- Page ID
- 81231
La energía de ionización (IE) es la energía requerida para eliminar un electrón de un átomo o catión neutro en su fase gaseosa. IE también se conoce como potencial de ionización.
\[A^{n+}_{(g)} \longrightarrow A^{(n+1)+}_{(g)} + e^- \hspace{1cm} IE = \Delta U \nonumber \]
Conceptualmente, la energía de ionización es la afinidad de un elemento por su electrón más externo (un electrón que ya tiene en su caparazón de valencia).
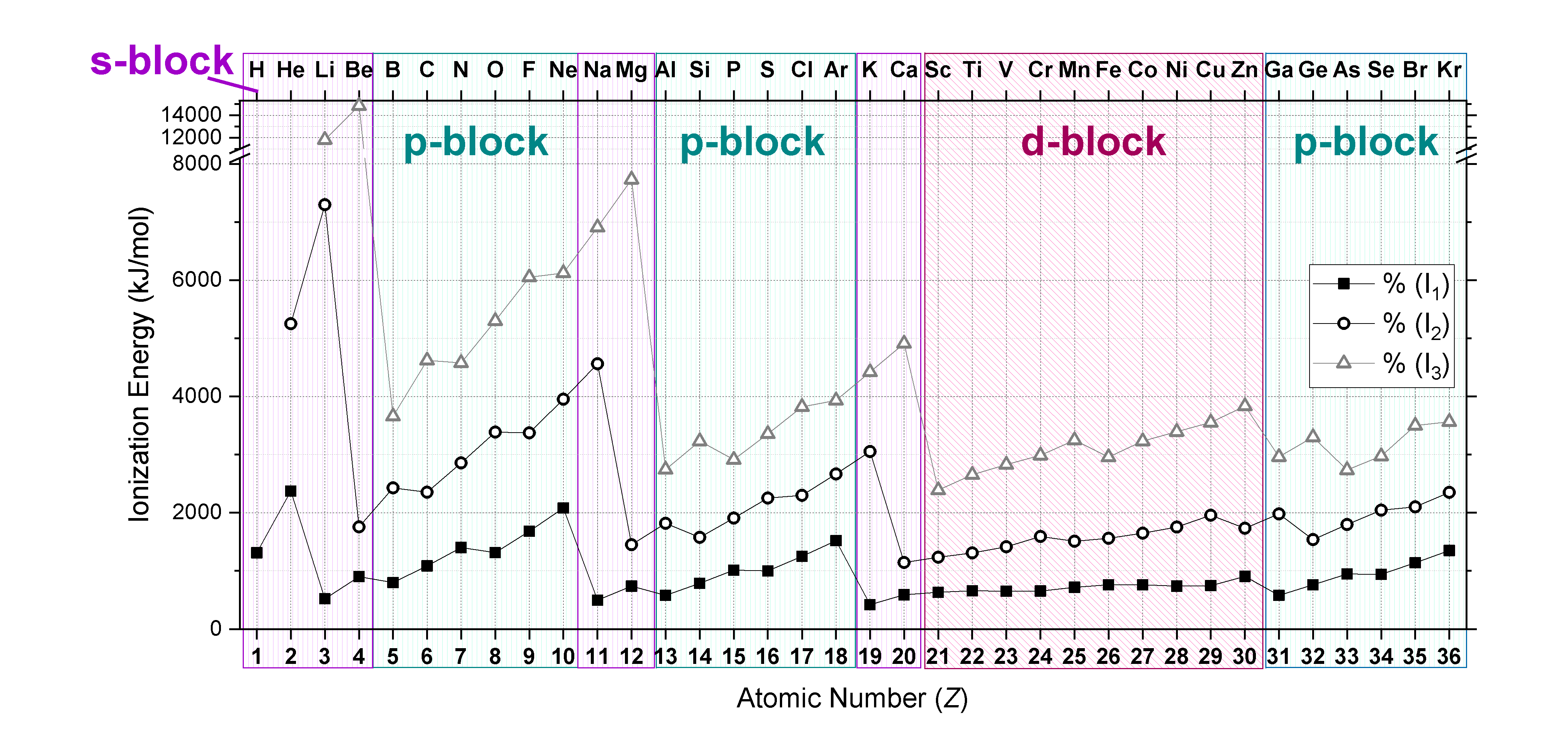
Energías de ionización 1ª, 2ª y 3ª
El símbolo\(I_1\) representa la primera energía de ionización (energía requerida para quitar un electrón de un átomo neutro, donde\(n=0\)). El símbolo\(I_2\) representa la segunda energía de ionización (energía requerida para quitar un electrón de un átomo con una carga +1,\(n=2\).)
- Primera Energía de Ionización,\(I_1\) (elemento general, A):\[ A_{(g)} \rightarrow A^{1+}_{(g)} + e^- \nonumber\]
- Segunda Energía de Ionización,\(I_2\) (elemento general, A):\[ A^{1+}_{(g)} \rightarrow A^{2+}_{(g)} + e^- \nonumber\]
- Tercera Energía de Ionización,\(I_3\) (elemento general, A):\[ A^{2+}_{(g)} \rightarrow A^{3+}_{(g)} + e^- \nonumber\]
Cada energía de ionización sucesiva es mayor que la energía anterior. Esto quiere decir que siempre\(I_1 < I_2 < I_3 < ... < I_n\) será cierto. Por ejemplo, la energía de ionización aumenta a medida que se quitan los electrones sucesivos\(\ce{Mg}\).
\[ Mg \,_{(g)} \rightarrow Mg^+\,_{(g)} + e^- \;\;\; I_1= 738\, kJ/mol \nonumber \]
\[Mg^+ \,_{(g)} \rightarrow Mg^{2+}\,_{(g)} + e^- \;\;\; I_2= 1451\, kJ/mol \nonumber \]
La energía de ionización se correlaciona con la fuerza de atracción entre el núcleo cargado positivamente y los electrones de valencia cargados negativamente. Cuanto mayor es la energía de ionización, más fuerte es la fuerza de atracción entre el núcleo y los electrones de valencia, y más energía se requiere para eliminar un electrón de valencia. Cuanto menor es la energía de ionización, más débil es la fuerza de atracción entre el núcleo y los electrones de valencia, y menos energía requerida para eliminar un electrón de valencia.
Tendencias periódicas generales en la afinidad electrónica
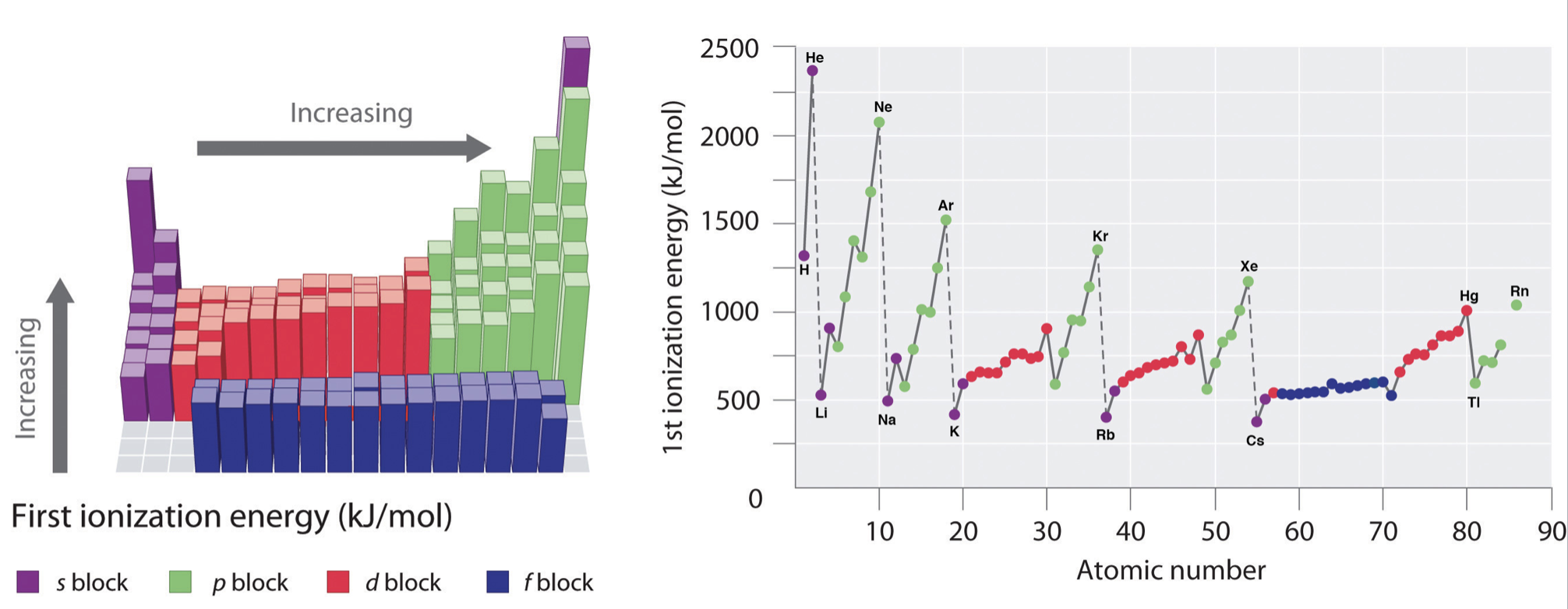
En general, las energías de ionización aumentan de izquierda a derecha y disminuyen en un grupo; sin embargo, existen variaciones en estas tendencias que se esperarían a partir de los efectos de penetración y blindaje. Las tendencias en la primera energía de ionización se muestran en la Figura\(\PageIndex{1}\) y se resumen a continuación.
- A lo largo de un periodo: A medida que Z* aumenta a lo largo de un periodo, la energía de ionización de los elementos generalmente aumenta de izquierda a derecha. Sin embargo, hay pausas o variación en las tendencias en los siguientes casos:
- El IE es especialmente bajo cuando la eliminación de un electrón crea una subcapa p recién vacía (los ejemplos incluyen\(I_1\) B, Al, Sc)
- La energía IE es especialmente baja cuando la eliminación de un electrón da como resultado una subcapa p o d medio llena (los ejemplos incluyen\(I_1\) O, S)
- IE aumenta más gradualmente a través de las subconchas d y f en comparación con las subconchas s y p-. Esto se debe a que los electrones d- y f- son débilmente penetrantes y experimentan especialmente bajo Z*.
- De un periodo al siguiente: Hay una disminución especialmente grande en IE con el inicio de cada nuevo periodo (de He a Li o de Ne a Na por ejemplo). Esto es consistente con la idea de que IE es especialmente bajo cuando la eliminación de un electrón crea una subcapa s recién vacía.
- Gases nobles: Los gases nobles poseen energías de ionización muy altas. Tenga en cuenta que el helio tiene la mayor energía de ionización de todos los elementos.
- Abajo un grupo: Aunque Z* aumenta bajando un grupo, no hay una tendencia confiable en IE bajando cualquier grupo; en algunos casos IE aumenta bajando un grupo, mientras que en otros casos IE disminuye bajando un grupo.
En la Figura se muestran las gráficas\(I_3\) del\(I_1, I_2,\) y de elementos desde hidrógeno hasta kriptón (primeros cuatro periodos)\(\PageIndex{2}\). Observe eso\(I_3>I_2>I_1\). ¡También observe que las tendencias mencionadas anteriormente para\(I_1\) mantener ciertas para ionizaciones posteriores cuando se consideran configuraciones de electrones!