2.3.2: Afinidad de Electrones
- Page ID
- 81236
Definiciones de afinidad de electrones
Según la IUPAC, existen dos definiciones diferentes, pero equivalentes, de afinidad electrónica (EA). 1
La afinidad electrónica se puede definir como la energía requerida cuando un electrón se elimina de un anión gaseoso. La reacción como se muestra en la ecuación\(\ref{EA1}\) es endotérmica (positiva\(\Delta U\)) para elementos excepto gases nobles y metales alcalinotérreos. Bajo esta definición, cuanto más positivo es el valor de EA, mayor es la afinidad de un átomo por los electrones.
\[A^{-}_{(g)} \longrightarrow A_{(g)} + e^- \hspace{1cm} EA = \Delta U \label{EA1} \]
La reacción mostrada en la Ecuación\(\ref{EA1}\) es similar a las que definen la energía de ionización. Por esta razón, el EA también se describe como la energía de ionización cero.
Una definición alternativa y más común es el reverso microscópico de Ecuación\(\ref{EA1}\). Esta definición más común establece que la afinidad electrónica es la energía liberada cuando se agrega un electrón a un átomo gaseoso, como se muestra en la Ecuación\(\ref{EA2}\). La reacción como se muestra en la ecuación\(\ref{EA2}\) es exotérmica (negativa\(\Delta U\)) para elementos excepto gases nobles y metales alcalinotérreos. Cuanto más negativo sea este valor de EA, mayor será la afinidad de un átomo por los electrones.
\[A_{(g)} + e^- \longrightarrow A^{-}_{(g)} \hspace{1cm} EA = \Delta U \label{EA2} \]
Conceptualmente, esta segunda definición es bastante similar al concepto de electronegatividad; pero a diferencia de la electronegatividad, la EA es una medida cuantitativa bien definida.
Tendencias en la afinidad de electrones
Para esta discusión, usaremos la definición de EA que es consistente con que sea una energía de ionización cero: un valor más positivo (mayor) significa que el EA es mayor (lo que significa una afinidad más fuerte hacia un electrón).
- A lo largo de un periodo: Similar a la energía de ionización, la EA generalmente aumenta en una fila de la tabla periódica; esta observación es consistente con el aumento de la carga nuclear efectiva (Z*) de izquierda a derecha a lo largo de un período. Sin embargo, hay variaciones a lo largo de un período que son similares a las variaciones en la energía de ionización y que pueden explicarse por blindaje, penetración y configuración electrónica.
- Abajo de un grupo: Al igual que el caso de las tendencias de energía de ionización, la EA no disminuye consistentemente bajando una columna de la tabla periódica a pesar de que\(Z^*\) aumenta a la baja de un grupo.
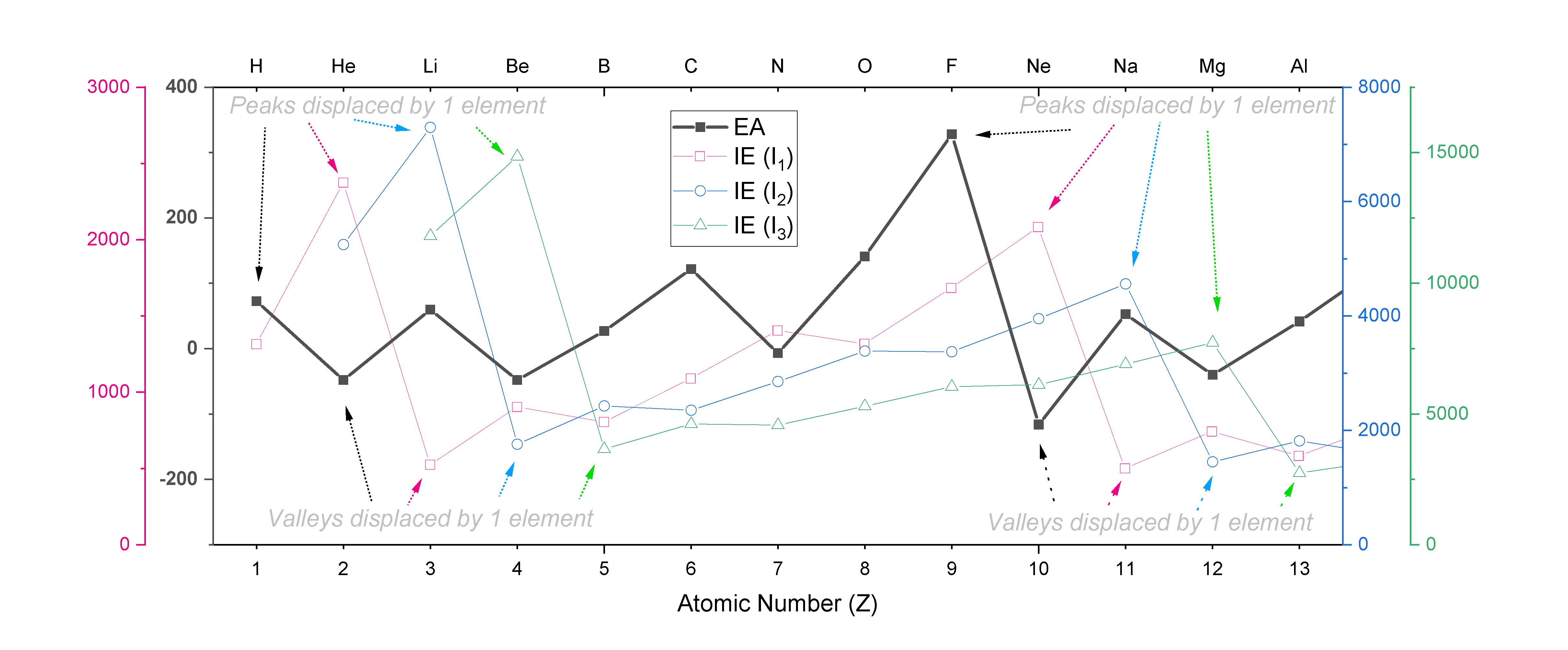
La tendencia en EA sigue un patrón en zig-zag similar al que se ve con las energías de ionización, excepto que se desplaza en una unidad de la tendencia en\(I_1\), dos unidades de\(I_2\), y así sucesivamente. Por ejemplo, EA alcanza su pico en F, mientras que\(I_1\) los picos en Ne,\(I_2\) picos en Na y\(I_3\) picos en Mg. Se muestra una gráfica de EA para los primeros 13 elementos superpuesta en parcelas de\(I_1, I_2\) y\(I_3\) en la Figura\(\PageIndex{1}\)., donde se indican los cambios en los picos y valles dentro de cada tendencia en zig-zag.
Fuentes
- IUPAC. Compendio de Terminología Química, 2a ed. (el “Libro de Oro”). Compilado por A. D. McNaught y A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versión en línea (2019-) creado por S. J. Chalk. ISBN 0-9678550-9-8. doi.org/10.1351/libro de oro.
- Afinidad de electrones (página de datos), Wikipedia. es.wikipedia.org/wiki/Electron_affinity_ (data_page) Accedido 12/3/19.

