2.3.3: Radios covalentes e iónicos
- Page ID
- 81230
Medición de Radio
Existen varios métodos que se pueden utilizar para determinar radios de átomos e iones:
- Radios atómicos no polares: El radio de un átomo se deriva de las longitudes de enlace dentro de moléculas no polares; la mitad de la distancia entre los núcleos de dos átomos dentro de un enlace covalente.
- radio de van der Waals: El radio de un átomo se determina por colisión con otros átomos.
- Radios cristalinos: El radio atómico o iónico se determina mediante mapas de densidad electrónica a partir de datos de rayos X.
La medición del tamaño atómico o iónico dependerá de una serie de factores, incluyendo el carácter covalente de la unión en cualquier molécula en particular, el número de coordinación, el estado físico (líquido, sólido, gas), la identidad de los átomos/iones cercanos, la variación en la estructura cristalina y las distorsiones dentro del cristal regular estructuras. Debes tener en cuenta que el tamaño de un átomo o ion es una medida “borrosa”, y el radio bajo un conjunto diferente de condiciones probablemente cambiará ligeramente.
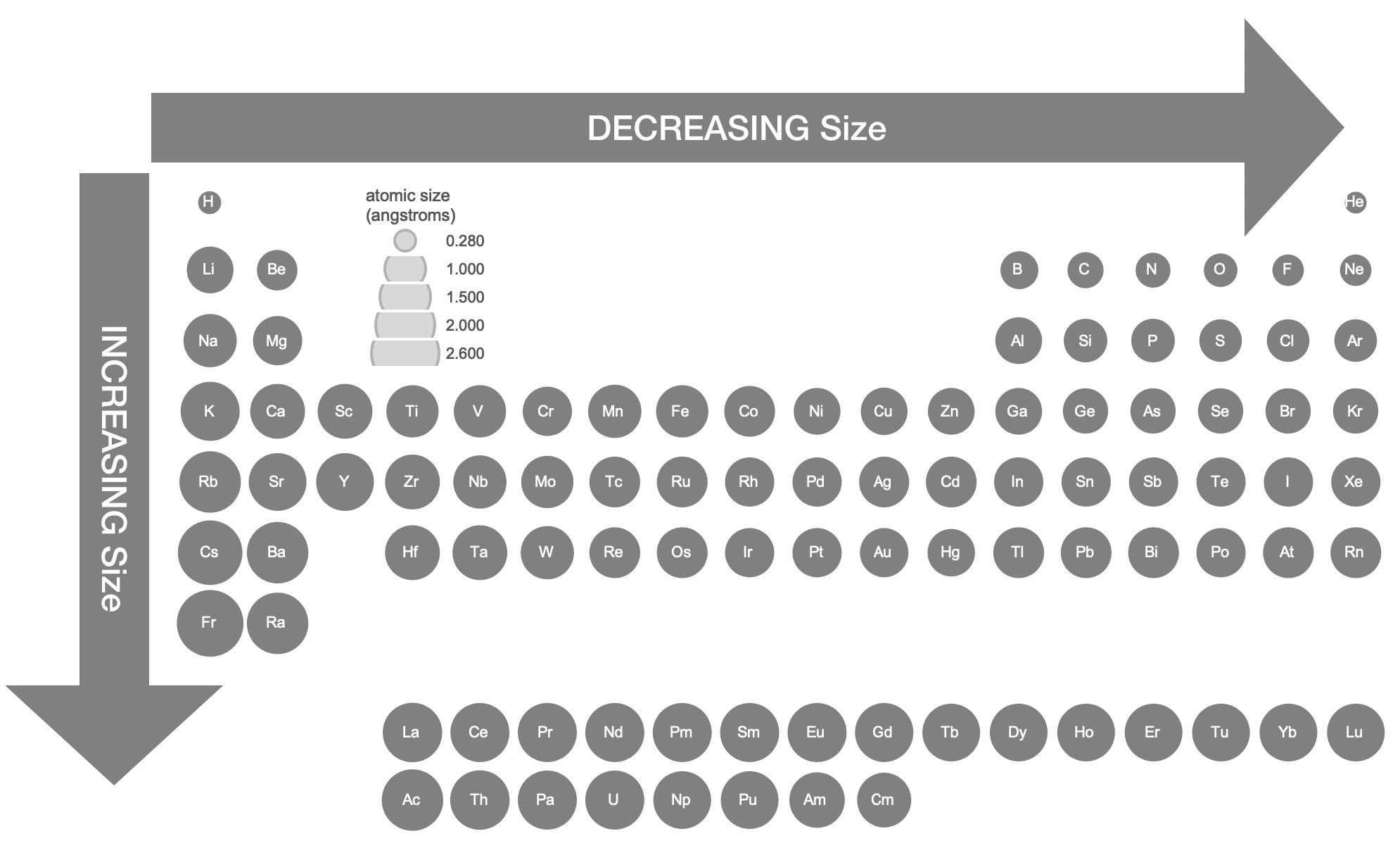
Independientemente, los radios atómicos e iónicos medidos revelan tendencias obvias en la tabla periódica y entre átomos e iones. Los tamaños atómicos relativos mostrados en la Figura\(\PageIndex{1}\) se derivaron de datos cristalográficos. 1
Tendencias en Radio Atómico
El tamaño atómico generalmente disminuye gradualmente de izquierda a derecha a lo largo de un período de elementos. A medida que aumenta la carga nuclear (Z), esperamos que también aumente la carga nuclear efectiva (Z*) de los electrones de valencia. El aumento de Z acerca los electrones al núcleo. Sin embargo, con cada unidad adicional de Z, también hay un electrón adicional. El cambio de tamaño es un equilibrio de una compresión causada por el aumento de Z y una expansión en el número de electrones. Como resultado, el radio atómico disminuye gradualmente a lo largo de un período.
El tamaño atómico generalmente aumenta bajando un grupo. A medida que los electrones de valencia ocupan conchas de nivel superior debido al creciente número cuántico (n), el tamaño aumenta a pesar de que Z y Z* están aumentando bajando del grupo.
Tendencias en el Radio Iónico
Las tendencias en el radio iónico siguen las tendencias generales en el radio atómico para iones de la misma carga. El radio iónico varía con la carga del ion (y el número de electrones) y la configuración electrónica (por ejemplo, espín alto o espín bajo).
Cationes
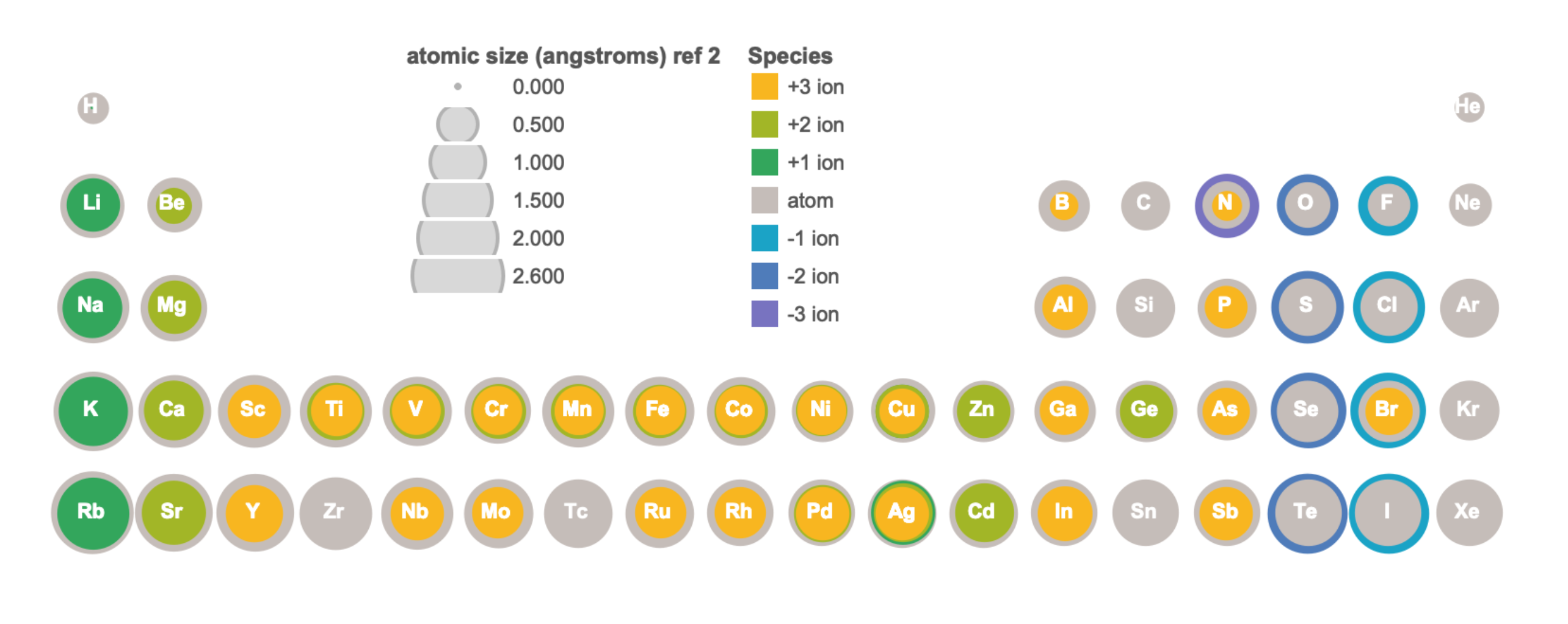
En comparación con sus átomos, los cationes tienen la misma Z pero menos electrones. La eliminación de electrones de un átomo para formar un catión da como resultado un aumento significativo en la carga nuclear efectiva, lo que resulta en que todos los demás electrones sean atraídos más fuertemente hacia el núcleo y tengan un nivel de energía más bajo. El resultado es una contracción en tamaño del átomo al catión. La Figura ilustra\(\PageIndex{2}\) visualmente el tamaño relativo de los átomos y algunos cationes de los cuatro primeros periodos; los datos están disponibles en formato tabular en la Figura\(\PageIndex{3}\).
Aniones
En comparación con sus átomos, los aniones tienen la misma Z pero más electrones. La adición de electrones a un átomo para formar un anión da como resultado una disminución de la carga nuclear efectiva, lo que corresponde a una disminución de la fuerza de atracción entre el núcleo y los electrones. Una menor fuerza de atracción conduce a la expansión, donde el tamaño del átomo se hace mayor en la formación de un anión. La Figura ilustra\(\PageIndex{2}\) visualmente el tamaño relativo de los átomos y algunos aniones de los cuatro primeros periodos, mientras que los datos están disponibles en formato tabular en la Figura\(\PageIndex{3}\).
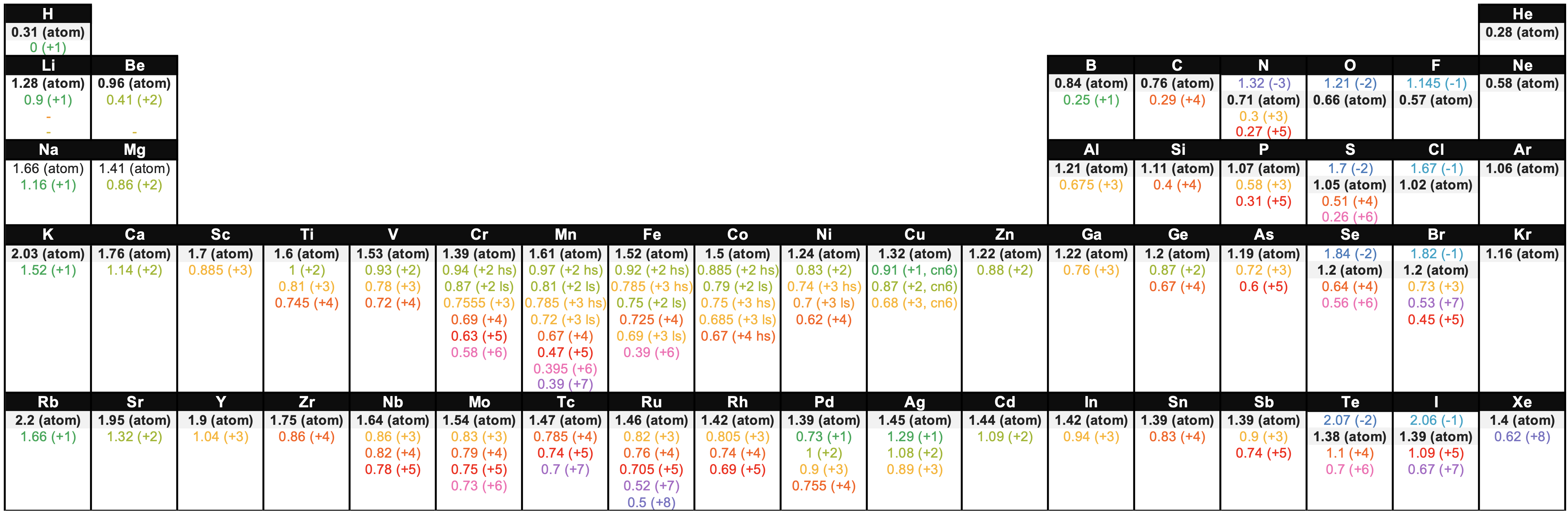 Figura\(\PageIndex{3}\). Esta figura muestra radios (en Angstroms) de átomos e iones de los primeros cuatro periodos de la tabla periódica. Los radios de cada elemento se listan de mayor a menor, la carga iónica se indica entre paréntesis (); hs = espín alto, ls = espín bajo, cn6 = número de coordinación es 6. Datos de fuentes 1-3.
Figura\(\PageIndex{3}\). Esta figura muestra radios (en Angstroms) de átomos e iones de los primeros cuatro periodos de la tabla periódica. Los radios de cada elemento se listan de mayor a menor, la carga iónica se indica entre paréntesis (); hs = espín alto, ls = espín bajo, cn6 = número de coordinación es 6. Datos de fuentes 1-3.Referencias
- Cordero, Beatriz, Verónica Gómez, Ana E. Platero-Prats, Marc Reves, Jorge Echeverria, Eduard Cremades, Flavia Barragan, y Santiago Álvarez. “Radios Covalentes Revisitados”. Dalton Transacciones, núm. 21 (2008): 2832—38. doi:10.1039/b801115j.
- R. D. Shannon (1976). “Radios iónicos efectivos revisados y estudios sistemáticos de distancias interatómicas en haluros y calcogenuros”. Acta Cristalogr A. 32 (5): 751—767. Código Bibcode: 1976Accra.. 32.. 751S. doi: 10.1107/S0567739476001551.
- Artículos de Wikipedia sobre Radio Atómico y Radio Iónico.

