3.1.4: Lewis no logra predecir casos inusuales - Boro y berilio
- Page ID
- 81285
Dos casos notables en los que la teoría de Lewis no logra predecir la estructura son los casos de berilio (\(\ce{Be}\)) y boro (\(\ce{B}\)). Estos dos átomos están en el período 2 (\(n=2\)) de la tabla periódica y sus átomos tienen las configuraciones de electrones de valencia de\(2s^2\) y\(2s^22p^1\), respectivamente.
Berilio
Las estructuras de puntos electrónicos de Lewis se muestran a continuación para\(\ce{BeX2}\), donde\(\ce{X}\) está uno de los halógenos,\(\ce{F}\) o\(\ce{Cl}\).
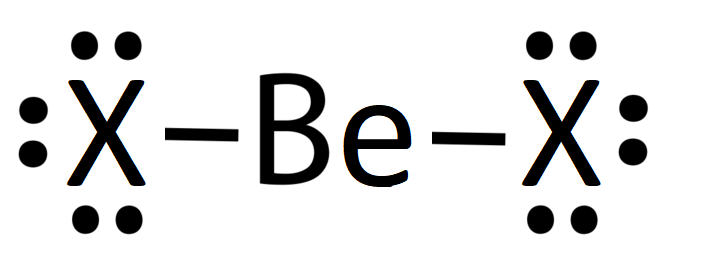
Cada una de las estructuras anteriores predeciría una geometría lineal para la\(\ce{BeX2}\) molécula. Juntas, las tres estructuras de resonancia sugieren un carácter de doble enlace parcial en el enlace Be-X, lo que da como resultado una longitud de enlace intermedia entre un enlace simple y doble.
Hay problemas con cada una de estas estructuras de resonancia. La estructura de la izquierda predeciría solo cuatro electrones alrededor\(\ce{Be}\); así, el átomo no cumple con la regla del octeto. La estructura de la izquierda sugiere múltiples enlaces para el halógeno (\(\ce{X}\)) y alta separación de carga con carga formal en cada átomo. La estructura en el medio es una mezcla de estos problemas. Ninguna de estas situaciones es ideal según la teoría de Lewis. Además, los datos experimentales no son consistentes con ninguna de estas estructuras ni con su híbrido de resonancia (excepto en el caso de\(\ce{BeCl2}\) temperaturas muy altas).
Resulta que el monómero de\(\ce{BeX2}\) sí existe, pero sólo a temperaturas muy altas y bajas presiones. Incluso en condiciones extremas, el monómero no es particularmente estable debido a la deficiencia de electrones alrededor\(\ce{Be}\).
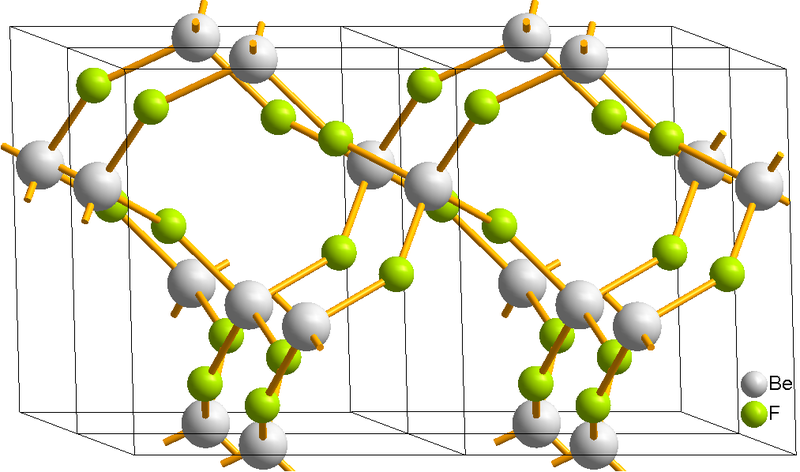
BeF 2
A temperatura y presión ambiente, BeF 2 es un sólido que se parece al cuarzo (Figura\(\PageIndex{1}\)) El Be es de cuatro coordenadas con geometría tetraédrica; cada F es de dos coordenadas y la longitud de unión Be-F es de 1.54 Å. Esta estructura es posible debido a una red tridimensional extendida en el sólido donde las unidades BeF 2 adyacentes están unidas entre sí, como se muestra en la Figura\(\PageIndex{1}\).

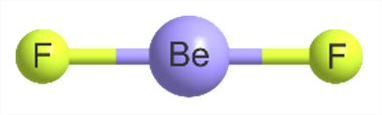
En fase líquida,\(\ce{BeF2}\) tiene una estructura tetraédrica fluctuante donde intercambian iones Be y F. La fase de vapor se alcanza a temperaturas superiores a 1000 °C (a ~ 1 atm). En fase vapor,\(\ce{BeF2}\) existe como un monómero con geometría lineal y una longitud de enlace de 1.43 Å, consistente con un doble enlace entre\(\ce{Be}\) y\(\ce{F}\).
BecL 2
A temperatura y presión ambiente,\(\ce{BeCl2}\) es un sólido. Como se\(\ce{BeF2}\) describió anteriormente,\(\ce{BeCl2}\) tiene cuatro coordenadas, Be tetraédricas y Cl de dos coordenadas. A diferencia de BeF 2, el BeCl 2 sólido es un polímero unidimensional que consiste en tetraédrico de borde compartido.
En la fase gaseosa, BeCl 2 existe como un dímero con dos átomos de cloro que unen dos átomos de Be. En el dímero, los átomos Be son de 3 coordenadas. Los átomos de Cl puente son de dos coordenadas, mientras que los átomos de Cl terminales son de una coordenada. A temperaturas más altas en fase vapor, también existe el monómero lineal.
Boro (\(2s^22p^1\))
Predicción basada en estructuras de Lewis:
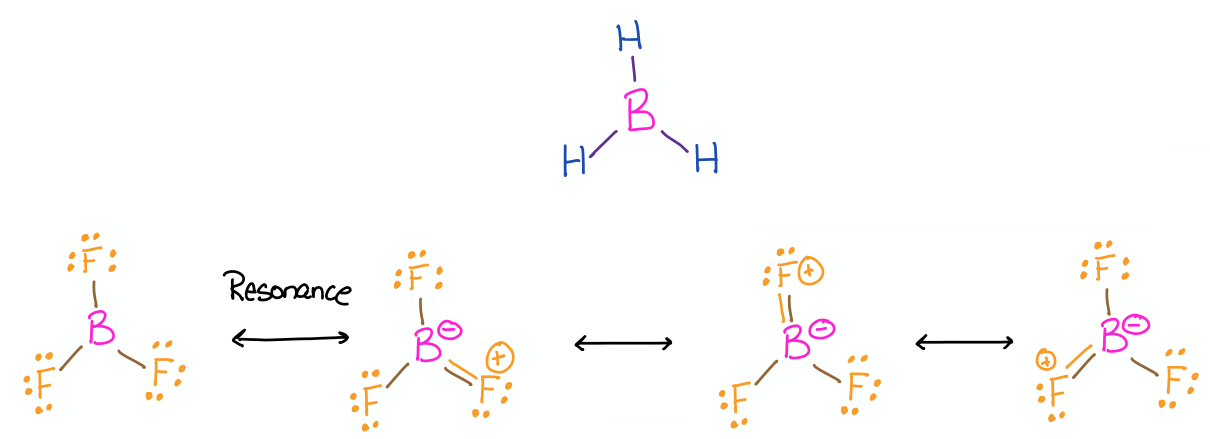
Las estructuras de Lewis de\(\ce{BH3}\) y\(\ce{BF3}\) fueron descritas en el Ejercicio 3.1.2, y se dibujan nuevamente a continuación por conveniencia.
Trihaluros de boro
Los trihaluros de boro, como\(\ce{BF3}\), tienen propiedades que son predichas en gran medida por las estructuras de Lewis y la teoría de VSEPR. La estructura de Lewis\(\ce{BF3}\) incluye varias estructuras de resonancia. La estructura con solo enlaces simples es la representación más común para esta molécula debido a que la separación de carga mostrada en las otras estructuras se considera desfavorable. El enlace B-F altamente polarizado tiene un momento dipolar opuesto a las cargas formales indicadas que se muestran en las estructuras de resonancia con dobles enlaces entre boro y flúor.
El híbrido de resonancia\(\ce{BF3}\) predice carácter de doble enlace parcial entre boro y flúor, por lo que una longitud de enlace más corta que un enlace simple. Usando las estructuras de Lewis y la teoría VSEPR, se predeciría una geometría plana trigonal alrededor del boro. De hecho, la estructura real de\(\ce{BF3}\) es un monómero con geometría plana trigonal y con longitud de enlace que es más corta que un enlace simple. El caso también es similar a las estructuras de otros trihaluros de boro.
Los trihaluros de boro son deficientes en electrones en el centro del boro y reaccionan fácilmente con las bases de Lewis. En otras palabras, son ácidos fuertes de Lewis (electrófilos).
Trihidruro de boro (BH 3 es realmente B 2 H 6)
Las propiedades del trihidruro de boro (\(\ce{BH3}\)) no son predichas por las simples predicciones realizadas a través de estructuras de Lewis y VSEPR. El monómero, BH 3, no es estable, pero cuando se disuelve en presencia de una base de Lewis, BH 3 puede formar un aducto ácido-base estable. En su forma pura, el compuesto realmente existe como un gas dimérico con una unidad molecular de B 2 H 6 (¡intente dibujar una estructura de Lewis válida para eso!). Su estructura inesperada incluye dos H que unen los dos átomos de boro en enlaces 3-center-2-electrón. Puedes leer más sobre B 2 H 6 en la página de Wikipedia de Diborane (6). La unión única observada para el boro se describe más en el Capítulo 8 y el Capítulo 15.


