3.2: Repulsión de pares de electrones de carcasa de valencia
- Page ID
- 81278
Introducción a VSEPR
El modelo Valence Shell Electron Repulsion (VSEPR) puede predecir la estructura de la mayoría de las moléculas e iones poliatómicos en los que el átomo central es un no metal; también funciona para algunas estructuras en las que el átomo central es un metal. VSEPR se basa en estructuras de punto de electrones de Lewis (discutidas en la Sección 3.1); las estructuras de Lewis solo predicen la conectividad, mientras que la estructura de Lewis y VSEPR juntos pueden predecir la geometría de cada átomo en una molécula. La idea principal de la teoría VSEPR es que los pares de electrones (en enlaces y en pares solitarios) se repelen entre sí. Los pares de electrones (en enlaces y en pares solitarios) se denominan “grupos”. Debido a que los electrones se repelen electrostáticamente, la disposición más estable de los grupos de electrones (es decir, el que tiene la energía más baja) es la que minimiza la repulsión. Los grupos se posicionan alrededor del átomo central de una manera que produce la estructura molecular con la energía más baja. Es decir, la repulsión entre grupos alrededor de un átomo favorece una geometría en la que los grupos están lo más alejados posible entre sí. Aunque VSEPR es simplista porque no tiene en cuenta las sutilezas de las interacciones orbitales que influyen en las formas moleculares, predice con precisión las estructuras tridimensionales de un gran número de compuestos.
Podemos usar el modelo VSEPR para predecir la geometría alrededor de los átomos en una molécula poliatómica o ion enfocándonos en el número de pares de electrones (grupos) alrededor de un átomo central de interés. Los grupos incluyen electrones unidos y no unidos; un enlace simple, un doble enlace, un triple enlace, un par solitario de electrones, o incluso un solo electrón desapareado, cada uno cuenta como un grupo. A la molécula o ion poliatómico se le da una designación A X m E n, donde A es el átomo central, X es un átomo unido, E es un grupo de electrones de valencia no enlazante (generalmente un par solitario de electrones), y m y n son números enteros. El número de grupos es igual a la suma de m y n. Usando esta información, podemos describir la geometría molecular alrededor de un átomo central, es decir, la disposición de los átomos unidos en una molécula o ion poliatómico. Las geometrías que se predicen a partir de VSEPR cuando un átomo central solo tiene grupos enlazados (n = 0) se listan a continuación en la Tabla\(\PageIndex{1}\). Los casos en los que los pares solitarios contribuyen a los grupos totales (n\(\geq\) 1) se discuten en la siguiente sección sobre la repulsión de pares solitarios.
|
Grupos alrededor del átomo central (m + n) |
Nombre de geometría | Croquis de geometría | Ángulo de enlace previsto | Ejemplo |
|---|---|---|---|---|
| 2 | lineal | 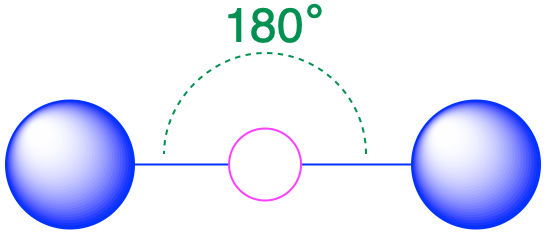 |
180° | 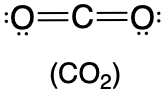 |
| 3 | plano trigonal | 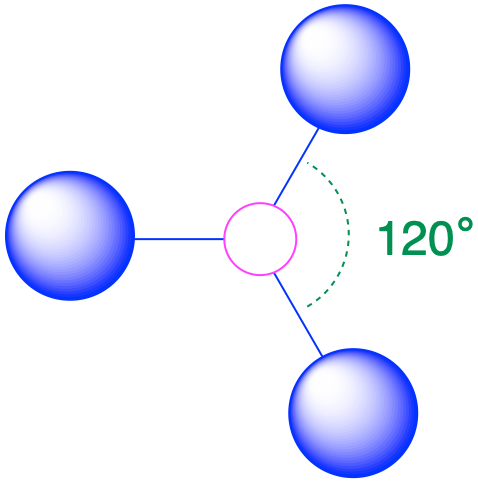 |
120° | 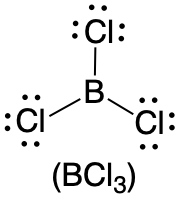 |
| 4 | tetraedro | 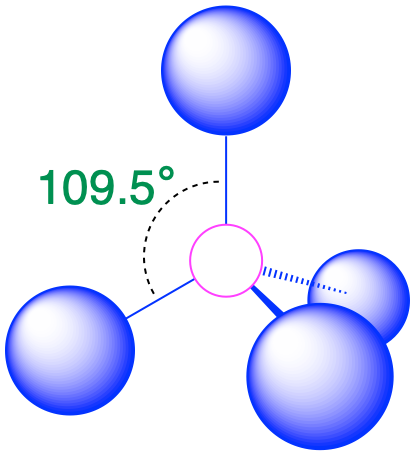 |
109.5° | 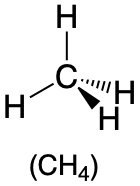 |
| 5 | bipirámide trigonal | 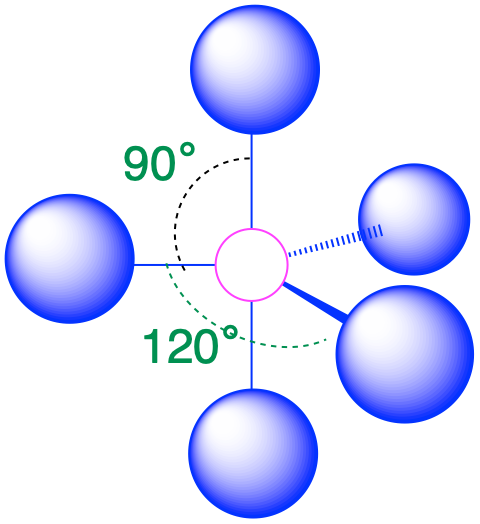 |
90° y 120° | 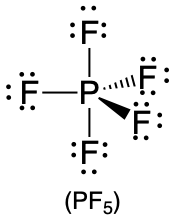 |
| 6 | octaedro | 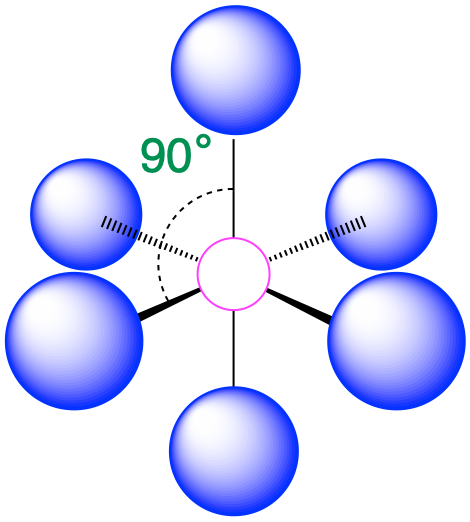 |
90° | 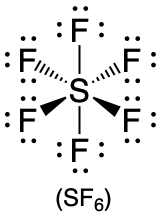 |
| 7 | bipirámide pentagonal | 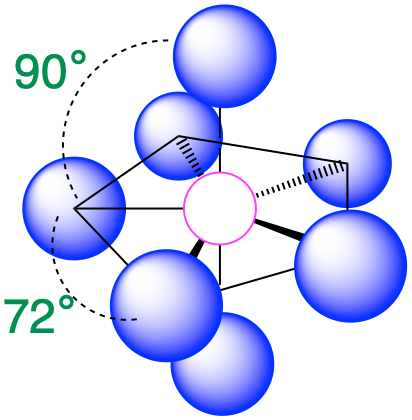 |
90° y 72° |  |
| 8 | antiprisma cuadrado | 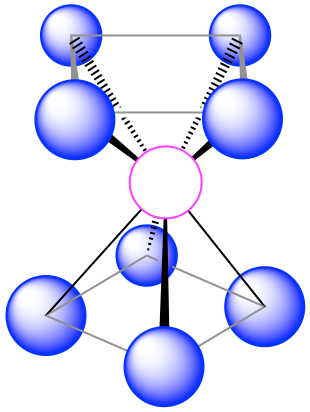 |
70.5°, 99.6° y 109.5° | 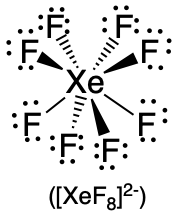 |
Practica
Puedes seguir estos cuatro pasos para predecir la geometría alrededor de un átomo usando VSEPR:
- Dibujar la estructura electrónica de Lewis de la molécula o ion poliatómico.
- Para el átomo central de interés, asigne la designación AX m E n y el número total de grupos (m + n).
- Determinar la disposición del grupo de electrones alrededor del átomo central que minimiza las repulsiones.
- Describir la geometría molecular.
Utilice el procedimiento anterior para completar los ejercicios a continuación
Predecir la geometría alrededor del átomo central en BeH 2 y CO 2.
- Responder BeH 2
-
1. El átomo central, el berilio, aporta dos electrones de valencia, y cada átomo de hidrógeno aporta uno. La estructura de electrones de Lewis es

2. Hay dos grupos alrededor del átomo central, y ambos grupos son enlaces simples. Así BeH 2 se designa como AX 2.
3. Vemos en Table\(\PageIndex{1}\) que el arreglo que minimiza las repulsiones coloca a los grupos separados 180°.
4. De la Tabla\(\PageIndex{1}\) vemos que con dos pares de unión, la geometría molecular que minimiza las repulsiones en BeH 2 es lineal.
- Respuesta CO 2
-
1. El átomo central, el carbono, aporta cuatro electrones de valencia, y cada átomo de oxígeno aporta seis. La estructura de electrones de Lewis es
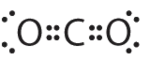
2. El átomo de carbono forma dos dobles enlaces. Cada doble enlace se cuenta como un grupo, por lo que hay dos grupos alrededor del átomo central. Una vez más, ambos grupos alrededor del átomo central son enlaces, por lo que el CO 2 se designa como AX 2.
3. Al igual que BeH 2, la disposición que minimiza las repulsiones coloca a los grupos separados 180°.
4. VSEPR solo reconoce grupos alrededor del átomo central (el carbono). Así, los pares solitarios en los átomos de oxígeno no influyen en la geometría molecular. Con dos grupos unidos en el átomo central y sin pares solitarios, la geometría molecular del CO 2 es lineal (Tabla\(\PageIndex{1}\)). La estructura de\(\ce{CO2}\) se muestra en la Tabla\(\PageIndex{1}\).
Predecir la geometría alrededor del átomo central en BCl 3 y CO 3 2-.
- Responder BCl 3
-
1. El átomo central, el boro, aporta tres electrones de valencia, y cada átomo de cloro aporta siete electrones de valencia. La estructura de electrones de Lewis es
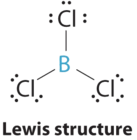
2. Hay tres grupos alrededor del átomo central y todos son enlaces simples. La estructura se designa como AX 3.
3. Para minimizar las repulsiones, los grupos se colocan separados 120° (Tabla\(\PageIndex{1}\)).
4. De la Tabla\(\PageIndex{1}\) vemos que con tres pares de unión alrededor del átomo central, la geometría molecular de Bcl3 es plana trigonal.
- Respuesta CO 3 2-
-
1. El átomo central, el carbono, tiene cuatro electrones de valencia, y cada átomo de oxígeno tiene seis electrones de valencia. La estructura de electrones de Lewis de una de las tres formas de resonancia se representa como
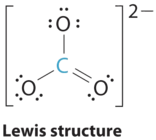
2. La estructura del CO 3 2− es un híbrido de resonancia. Tiene tres bonos idénticos, cada uno con un orden de fianza de\(1 \frac{1}{3}\). Todos los grupos de electrones son enlaces. Con tres grupos de unión alrededor del átomo central, la estructura se designa como AX 3.
3. Minimizamos las repulsiones colocando los tres grupos separados 120° (Tabla\(\PageIndex{1}\)).
4. Vemos en la Tabla\(\PageIndex{1}\) que la geometría molecular del CO 3 2− es plana trigonal con ángulos de unión de 120°.
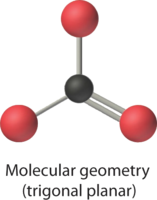
En nuestro siguiente ejemplo nos encontramos con los efectos de los pares solitarios y los enlaces múltiples sobre la geometría molecular por primera vez.
Predecir la geometría alrededor del átomo central en CH 4, PCl 5 y SF 6.
- Respuesta CH 4
-
1. El átomo central, el carbono, aporta cuatro electrones de valencia, y cada átomo de hidrógeno tiene un electrón de valencia, por lo que la estructura completa del electrón de Lewis es
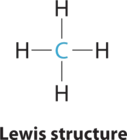
2. Hay cuatro grupos de electrones alrededor del átomo central. Todos los grupos de electrones son pares de unión, por lo que la estructura se designa como AX 4.
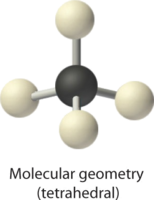
3. Como se muestra en la Tabla\(\PageIndex{1}\), las repulsiones se minimizan al colocar los grupos en las esquinas de un tetraedro con ángulos de unión de 109.5°.
4. Con cuatro pares de unión, la geometría molecular del metano es tetraédrica (Cuadro\(\PageIndex{1}\)).
- Contestar PCl 5
-
1. El fósforo tiene cinco electrones de valencia y cada cloro tiene siete electrones de valencia, por lo que la estructura de electrones de Lewis de PCl 5 es
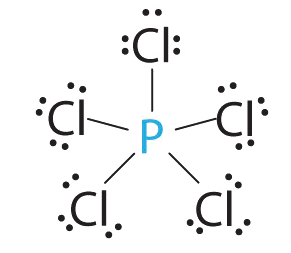
2. Hay cinco grupos de unión alrededor del fósforo, el átomo central. Todos los grupos de electrones son enlaces, por lo que la estructura se designa como AX 5.
3. La estructura que minimiza las repulsiones es una bipirámide trigonal, la cual consiste en dos pirámides trigonales que comparten una base (Tabla\(\PageIndex{1}\)).
4. La geometría molecular del pCl 5 es trigonal bipiramidal, como se muestra a continuación. La molécula tiene tres átomos en un plano en posiciones ecuatoriales y dos átomos por encima y por debajo del plano en posiciones axiales. Las tres posiciones ecuatoriales están separadas 120° entre sí, y las dos posiciones axiales están a 90° con respecto al plano ecuatorial. Las posiciones axial y ecuatorial no son químicamente equivalentes.
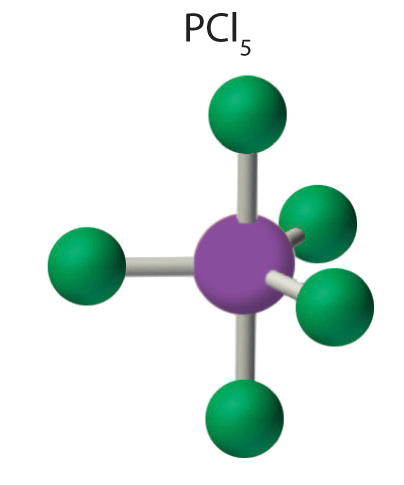
- Respuesta SF 6
-
1. El átomo central, azufre, aporta seis electrones de valencia, y cada átomo de flúor tiene siete electrones de valencia, por lo que la estructura de electrones de Lewis es
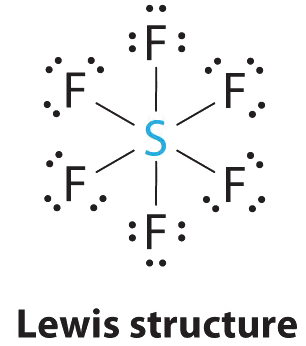
Con una valencia expandida, esta especie es una excepción a la regla del octeto.
2. Hay seis grupos de electrones alrededor del átomo central, cada uno un par de enlaces. Vemos a partir de la Figura\(\PageIndex{2}\) que la geometría que minimiza las repulsiones es octaédrica.
3. Con solo pares de unión, SF 6 se designa como AX 6. Todas las posiciones son químicamente equivalentes, por lo que todas las interacciones electrónicas son equivalentes.
4. Hay seis núcleos, por lo que la geometría molecular de SF 6 es octaédrica.



