3.2.1: Repulsión de Par Solitario
- Page ID
- 81287
En la sección anterior, vimos cómo usar VSEPR para predecir la geometría alrededor de un átomo central en función del número de grupos unidos a un átomo central. Sin embargo, nuestra discusión previa se limitó a los casos simples donde todos los grupos eran grupos unidos (es decir, en la designación A X m E n, n = 0). Cuando todos los grupos son enlaces, las geometrías se pueden predecir usando la información de la Tabla 3.2.1 de la sección anterior. Ahora consideraremos casos en los que uno o más de estos grupos son parejas solitarios.
Los pares solitarios tienen fuerzas repulsivas más fuertes que los grupos unidos.
Cuando uno o más de los grupos es un par solitario de electrones (electrones no enlazados), la geometría experimentalmente observada alrededor de un átomo es ligeramente diferente que en el caso donde todos los grupos son enlaces. Los ángulos de enlace reales son similares, pero no exactamente los mismos, como los predichos basados en el número total de grupos (la geometría “padre”). Cuando hay una mezcla de tipos de grupos (pares solitarios (E) y grupos unidos (X)) hay tres tipos diferentes de ángulos a considerar: ángulos de enlace entre dos átomos unidos (ángulos X-X), ángulos entre un átomo unido y un par solitario ( Ángulos X- E) y ángulos entre dos pares solitarios (ángulos E-E). La evidencia empírica muestra la siguiente tendencia en el grado de ángulos de enlace alrededor de los átomos con una mezcla de tipos de grupos:
Tendencia en los ángulos de unión:
E-E > X-E > X-X
Usando evidencia empírica como guía, podemos predecir que los pares solitarios repelen a otros grupos de electrones con mayor fuerza que los pares unidos. La geometría molecular de las moléculas con pares solitarios de electrones se predice mejor cuando consideramos que la repulsión electrónica creada por pares solitarios es más fuerte que la repulsión de los grupos unidos. Es difícil predecir el ángulo exacto del enlace con base en este principio, pero podemos predecir ángulos aproximados, como se describe y resume a continuación en la Tabla\(\PageIndex{1}\).
| Grupos de electrones (m + n) | |||||
|---|---|---|---|---|---|
|
2 (número estérico = 2) |
3 (número estérico = 3) |
4 (número estérico = 4) |
5 (número estérico = 5) |
6 (número estérico = 6) |
|
|
Geometría padre (0 pares solitarios) A X m |
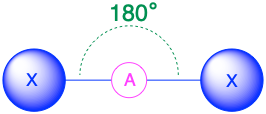
A X 2, lineal 180° |
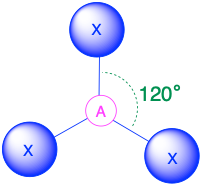
A X 3, trig. plano 120° |
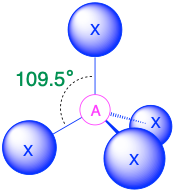
A X 4, tetraedro 109.5° |
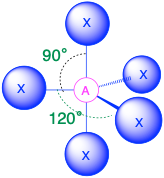
A X 5, trig. bipirámide 90°, 120° |
A X 6, octaedro 90° |
|
1 par solitario A X m E 1 |
A X 2 E 1, doblada <120° |
A X 3 E 1, trig. pirámide <109.5° |
A X 4 E 1, sierra <90°, <120° |
A X 5 E 1, pirámide cuadrada 90°, <90° |
|
|
2 pares solitarios A X m E 2 |
A X 2 E 2, doblado <109.5° |
A X 3 E 2, forma de T <90° |
A X 4 E 2, plano cuadrado 90° |
||
|
3 pares solitarios A X m E 3 |
A X 2 E 3, lineal 180° |
||||
La tabla\(\PageIndex{1}\) resume las geometrías y los ángulos de enlace predichos para los grupos unidos al vecino más cercano en átomos centrales con una mezcla de pares solitarios y grupos unidos. La tabla no cubre todas las situaciones posibles; solo incluye casos en los que hay dos grupos enlazados en los que un ángulo X-X es medible entre vecinos más cercanos. A continuación se ofrece una descripción más detallada de algunos casos seleccionados.
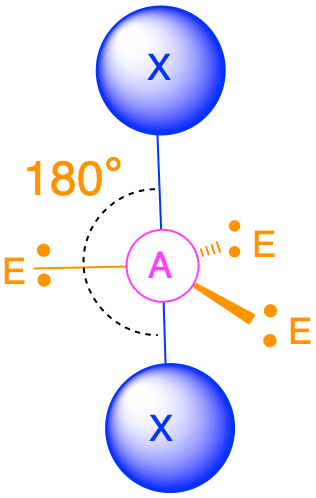
Dos grupos de electrones (m + n = 2)
(Número estérico = 2) En el caso de que solo haya dos grupos de electrones alrededor de un átomo central, esos grupos estarán a 180° el uno del otro. Esto da como resultado una geometría molecular lineal con ángulos de enlace de 180°.
Tres grupos de electrones (m + n = 3)
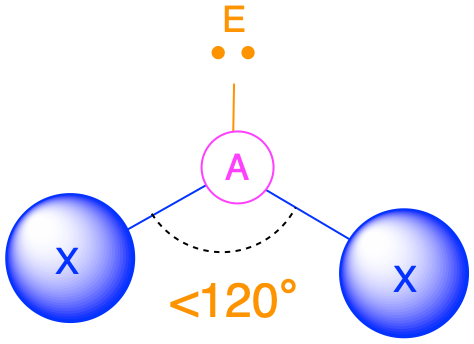
(Número estérico = 3) En el caso de que haya tres grupos de electrones alrededor de un átomo central, esos grupos estarán aproximadamente a 120° entre sí en el espacio. Esto da como resultado una geometría electrónica que es aproximadamente plana trigonal. Hay dos geometrías moleculares diferentes que son posibles en esta categoría:
- Cuando todos los grupos de electrones son enlaces (m = 3 o AX 3), la geometría molecular es un plano trigonal con ángulos de enlace de 120°.
- Cuando hay un par solitario (m=2, n=1 o AX 2 E 1), la geometría molecular se dobla con un ángulo de unión que es ligeramente inferior a 120°.
1. El átomo central, el azufre, tiene 6 electrones de valencia, al igual que cada átomo de oxígeno. Con 18 electrones de valencia, la estructura de electrones de Lewis se muestra a continuación.
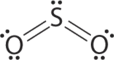
2. Hay tres grupos de electrones alrededor del átomo central: dos dobles enlaces y un par solitario. Inicialmente colocamos los grupos en una disposición plana trigonal para minimizar las repulsiones (Tabla\(\PageIndex{1}\)).
3. Con dos pares de unión y un par solitario, la estructura se designa como AX 2 E. Esta designación tiene un total de tres pares de electrones, dos X y uno E. El par solitario ocupa más espacio alrededor del átomo central que un par de unión (¡incluso dobles enlaces!). Los pares de unión y los pares solitarios se repelen electrostáticamente en el orden BP—BP < LP-BP < LP-LP. En SO 2, tenemos una interacción BP — BP y dos interacciones LP-BP.
4. La geometría molecular se describe únicamente por las posiciones de los núcleos, no por las posiciones de los pares solitarios. Así, con dos núcleos y un par solitario la forma es doblada, o en forma de V, lo que puede verse como una disposición plana trigonal con un vértice faltante. Se espera que el ángulo de unión O-S-O sea inferior a 120° debido al espacio extra ocupado por el par solitario.
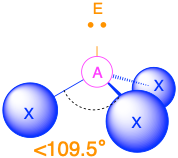
Cuatro grupos de electrones (m + n = 4)
(Número estérico = 4) En el caso de que haya cuatro grupos de electrones alrededor de un átomo central, esos grupos estarán aproximadamente a 109.5° entre sí en el espacio. Esto da como resultado una geometría electrónica que es aproximadamente tetraédrica. Hay tres geometrías moleculares diferentes que son posibles en esta categoría:
- Cuando todos los grupos de electrones son enlaces (m=4 o AX 4), la geometría molecular es un tetraedro con ángulos de enlace de 109.5°.
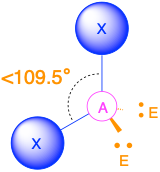
- Cuando hay un par solitario (m=3, n=1 o AX 3 E 1), la geometría molecular es una pirámide trigonal con ángulos de enlace de poco menos de 109.5°.
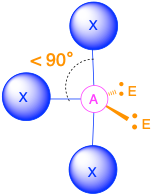
- Cuando hay dos pares solitarios (m=2, n=2 o AX 2 E 2), la geometría molecular se dobla con ángulos de enlace de poco menos de 109.5°.
Una de las limitaciones de las estructuras de Lewis es que representan moléculas e iones en solo dos dimensiones. Con cuatro grupos de electrones, debemos aprender a mostrar moléculas e iones en tres dimensiones.
1. En el amoníaco, el átomo central, el nitrógeno, tiene cinco electrones de valencia y cada hidrógeno dona un electrón de valencia, produciendo la estructura de electrones de Lewis
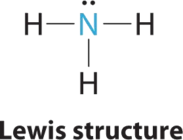
2. Hay cuatro grupos de electrones alrededor del nitrógeno, tres pares de enlace y un par solitario. Las repulsiones se minimizan dirigiendo cada átomo de hidrógeno y el par solitario a las esquinas de un tetraedro.
3. Con tres pares de unión y un par solitario, la estructura se designa como AX 3 E. Esta designación tiene un total de cuatro pares de electrones, tres X y uno E. Esperamos que las interacciones LP-BP provoquen que los ángulos del par de unión se desvíen significativamente de los ángulos de un tetraedro perfecto.
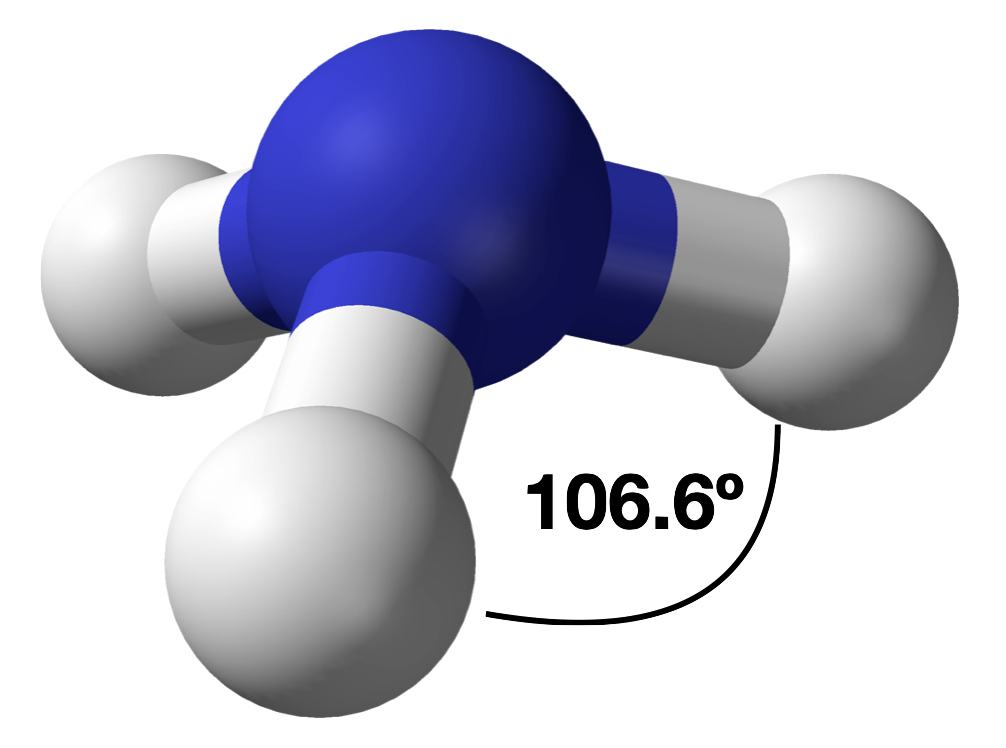
La diferencia en el espacio ocupado por un par solitario de electrones y por un par de unión
Al igual que con SO 2, este modelo compuesto de distribución de electrones y potencial electrostático negativo en amoníaco muestra que un par solitario de electrones ocupa una región de espacio más grande alrededor del átomo de nitrógeno que un par de electrones que se comparte con un átomo de hidrógeno.
4. Hay tres núcleos y un par solitario, por lo que la geometría molecular es piramidal trigonal. En esencia, se trata de un tetraedro al que le falta un vértice. Sin embargo, los ángulos de unión H-N-H son menores que el ángulo ideal de 109.5° debido a la repulsión LP-BP. Los ángulos de unión en amoníaco son 106.6°.
AX 2 E 2 Moléculas: Ejemplo H 2 O
1. El oxígeno tiene seis electrones de valencia y cada hidrógeno tiene un electrón de valencia, produciendo la estructura de electrones de Lewis
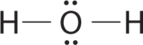
2. Hay cuatro grupos alrededor del átomo de oxígeno central, dos pares de enlace y dos pares solitarios. Las repulsiones se minimizan dirigiendo los pares de unión y los pares solitarios a las esquinas de un tetraedro.
3. Con dos pares de unión y dos pares solitarios, la estructura se designa como AX 2 E 2 con un total de cuatro pares de electrones. Debido a las interacciones LP-LP, LP-BP y BP-BP, esperamos una desviación significativa de los ángulos tetraédricos idealizados.
4. Con dos átomos de hidrógeno y dos pares solitarios de electrones, la estructura tiene interacciones significativas de pares solitarios. Hay dos núcleos alrededor del átomo central, por lo que la forma molecular es doblada, o en forma de V, con un ángulo H-O—H que es incluso menor que los ángulos H—N-H en NH 3, como cabría esperar debido a la presencia de dos pares solitarios de electrones en el átomo central en lugar de uno. Esta forma molecular es esencialmente un tetraedro con dos vértices faltantes.

Cinco grupos de electrones (m + n = 5)
|
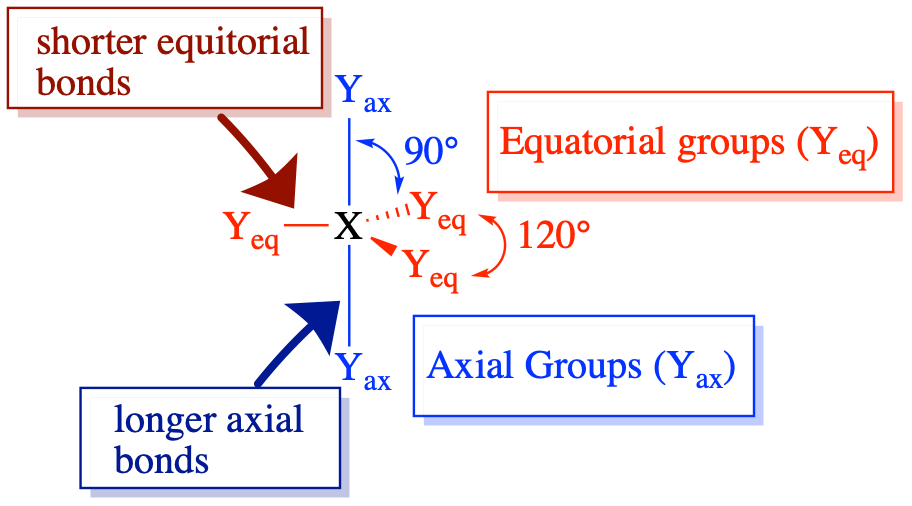
(Número estérico = 5) En el caso de que haya cinco grupos de electrones alrededor de un átomo central, existen dos tipos diferentes de posiciones alrededor del átomo central: posiciones ecuatoriales y posiciones axiales. Los tres ligandos ecuatoriales están a 120° entre sí y a 90° de cada uno de los dos ligandos axiales. Las posiciones axiales tienen tres grupos adyacentes orientados a 90° en el espacio. Por lo tanto, los grupos axiales están más abarrotados que las posiciones ecuatoriales con solo dos grupos adyacentes a 90°. El hacinamiento de posiciones axiales resulta en ligeras diferencias en las distancias de unión; los grupos axiales abarrotados tienen enlaces más largos que los grupos ecuatoriales menos abarrotados Los pares solitarios de electrones generalmente prefieren ocupar posiciones ecuatoriales en lugar de posiciones axiales. La justificación de esta preferencia, según la teoría de VSEPR, es que los pares de electrones solitarios son más repulsivos que los pares de electrones enlazantes, y así los pares solitarios prefieren las posiciones ecuatoriales menos concurridas.
La disposición de cinco grupos alrededor de un átomo central da como resultado una geometría electrónica bipiramidal trigonal. Hay cuatro geometrías moleculares diferentes que son posibles en esta categoría, dependiendo del número de grupos unidos y pares solitarios de electrones:
- Cuando todos los grupos de electrones son enlaces (m=5 o AX 5), la geometría molecular es una bipirámide trigonal con ángulos de enlace de 120° y 90° entre ligandos adyacentes.
- Cuando hay un par solitario (m=4, n=1 o AX 4 E 1), el par solitario ocupa una de las posiciones ecuatoriales. La geometría molecular se denomina sierra de mar con ángulos de unión de poco menos de 120° y ligeramente menores de 90°.
- Cuando hay dos pares solitarios (m=3, n=2 o AX 3 E 2), cada par solitario ocupa una de las tres posiciones ecuatoriales. La geometría molecular es en forma de T con ángulos de unión de poco menos de 120° y ligeramente menores de 90°.
- Cuando hay tres pares solitarios (m=1, n=3 o AX 3 E 2), los pares solitarios ocupan las tres posiciones ecuatoriales. La geometría molecular es lineal con ángulos de enlace de 180°.
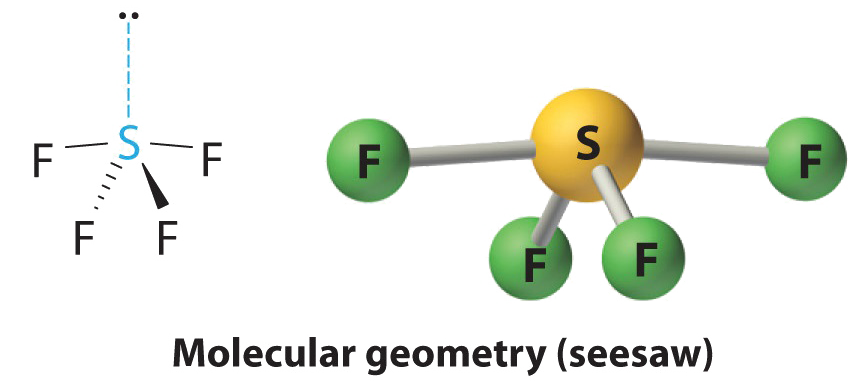
AX 4 E Moléculas: SF 4
1. El átomo de azufre tiene seis electrones de valencia y cada flúor tiene siete electrones de valencia, por lo que la estructura de electrones de Lewis es

Con una valencia expandida, esta especie es una excepción a la regla del octeto.
2. Hay cinco grupos alrededor del azufre, cuatro pares de unión y un par solitario. Con cinco grupos de electrones, la disposición de energía más baja es una bipirámide trigonal.
3. Designamos SF 4 como AX 4 E; tiene un total de cinco pares de electrones. Sin embargo, debido a que las posiciones axial y ecuatorial no son químicamente equivalentes, ¿dónde colocamos el par solitario? Si colocamos el par solitario en la posición axial, tenemos tres repulsiones LP-BP a 90°. Si lo colocamos en posición ecuatorial, tenemos dos repulsiones LP-BP de 90° a 90°. Con menos repulsiones LP-BP de 90°, podemos predecir que la estructura con el par solitario de electrones en la posición ecuatorial es más estable que la que tiene el par solitario en la posición axial. También esperamos una desviación de la geometría ideal porque un par solitario de electrones ocupa más espacio que un par de unión.
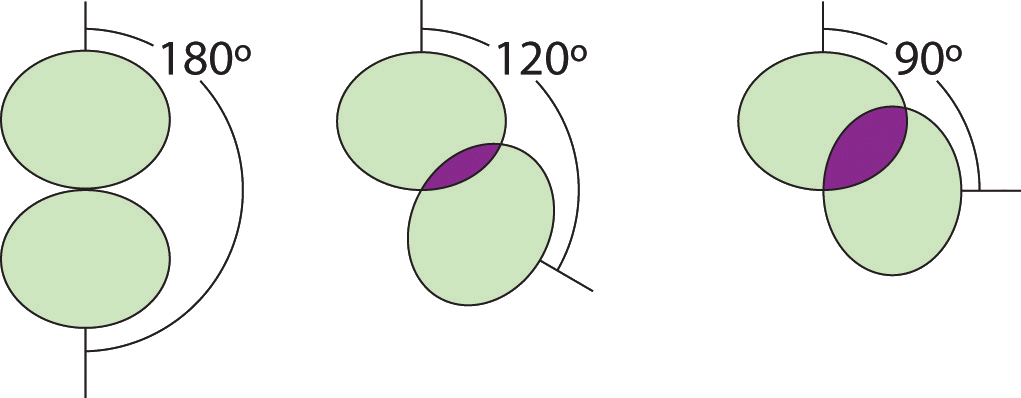
Ilustración del área compartida por dos pares de electrones versus el ángulo entre ellos
A 90°, los dos pares de electrones comparten una región relativamente grande del espacio, lo que conduce a fuertes interacciones electrón-electrón repulsivas.
4. Con cuatro núcleos y un par solitario de electrones, la estructura molecular se basa en una bipirámide trigonal con un vértice ecuatorial faltante; se describe como un bajón. El ángulo axial F —S-F es 173° en lugar de 180° debido al par solitario de electrones en el plano ecuatorial.
AX 3 E 2 Moléculas: BrF 3
1. El átomo de bromo tiene siete electrones de valencia, y cada flúor tiene siete electrones de valencia, por lo que la estructura de electrones de Lewis es
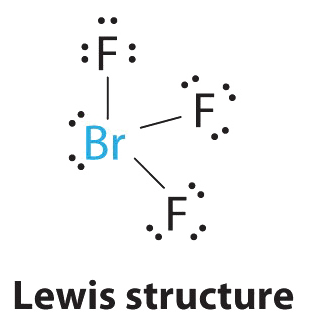
Una vez más, tenemos un compuesto que es una excepción a la regla del octeto.
2. Hay cinco grupos alrededor del átomo central, tres pares de enlace y dos pares solitarios. Volvemos a dirigir los grupos hacia los vértices de una bipirámide trigonal.
3. Con tres pares de unión y dos pares solitarios, la designación estructural es AX 3 E 2 con un total de cinco pares de electrones. Debido a que las posiciones axial y ecuatorial no son equivalentes, debemos decidir cómo organizar los grupos para minimizar las repulsiones. Si colocamos ambos pares solitarios en las posiciones axiales, tenemos seis repulsiones LP-BP a 90°. Si ambos están en las posiciones ecuatoriales, tenemos cuatro repulsiones LP-BP a 90°. Si un par solitario es axial y el otro ecuatorial, tenemos una repulsión LP-LP a 90° y tres repulsiones LP-BP a 90°:

La estructura (c) se puede eliminar porque tiene una interacción LP-LP a 90°. La estructura (b), con menos repulsiones LP-BP a 90° que (a), es menor en energía. Sin embargo, predecimos una desviación en los ángulos de enlace debido a la presencia de los dos pares de electrones solitarios.
4. Los tres núcleos en BrF 3 determinan su estructura molecular, la cual se describe como en forma de T. Se trata esencialmente de una bipirámide trigonal a la que le faltan dos vértices ecuatoriales. El ángulo axial F —Br—F axial es de 172°, menos de 180° debido a las repulsiones LP-BP.
Porque los pares solitarios ocupan más espacio alrededor del átomo central que los pares de unión, las repulsiones electrostáticas son más importantes para los pares solitarios que para los pares de unión.
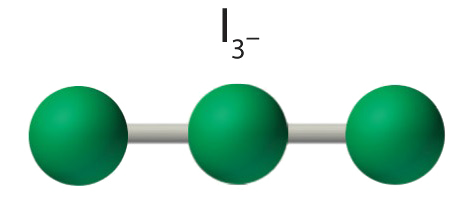
AX 2 E 3 Moléculas: I 3 −
1. Cada átomo de yodo aporta siete electrones y la carga negativa uno, por lo que la estructura de electrones de Lewis es
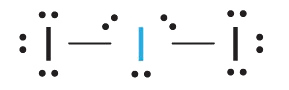
2. Hay cinco grupos de electrones alrededor del átomo central en I 3 −, dos pares de enlace y tres pares solitarios. Para minimizar las repulsiones, los grupos se dirigen a las esquinas de una bipirámide trigonal.
3. Con dos pares de unión y tres pares solitarios, I 3 − tiene un total de cinco pares de electrones y se designa como AX 2 E 3. Ahora debemos decidir cómo organizar los pares solitarios de electrones en una bipirámide trigonal de una manera que minimice las repulsiones. Al colocarlos en las posiciones ecuatoriales se eliminan las repulsiones LP-LP de 90° y se minimiza el número de repulsiones LP-BP de 90°.
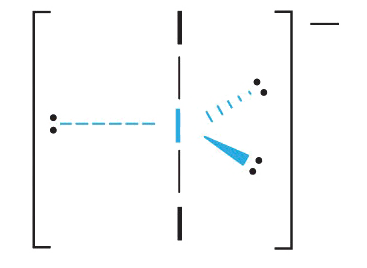
Los tres pares solitarios de electrones tienen interacciones equivalentes con los tres átomos de yodo, por lo que no esperamos ninguna desviación en los ángulos de unión.
4. Con tres núcleos y tres pares solitarios de electrones, la geometría molecular de I 3 − es lineal. Esto puede describirse como una bipirámide trigonal con tres vértices ecuatoriales faltantes. El ion tiene un ángulo I—I—I de 180°, como se esperaba.
Seis grupos de electrones (m + n = 6)
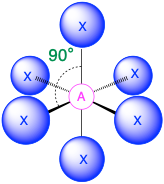
(Número estérico = 6) En el caso de que haya seis grupos de electrones alrededor de un átomo central, los grupos más cercanos estarán aproximadamente a 90° entre sí en el espacio. Esto da como resultado una geometría electrónica que es aproximadamente octaédrica. Hay tres geometrías moleculares relevantes en esta categoría:
- Cuando todos los grupos de electrones son enlaces (m=6 o AX 6), la geometría molecular es un octaedro con ángulos de enlace de 90° entre enlaces adyacentes.
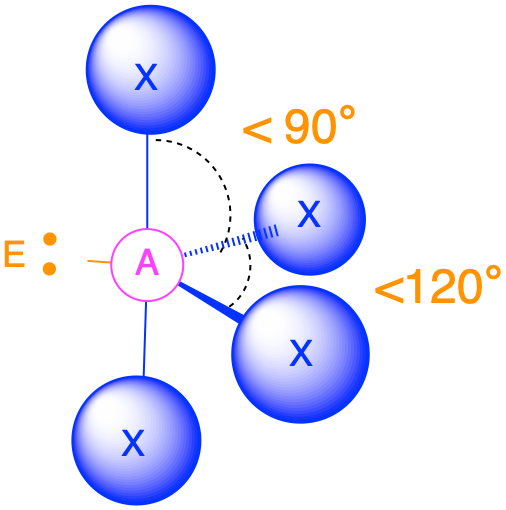
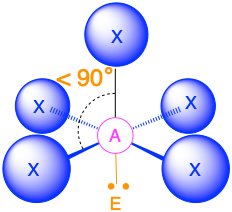
- Cuando hay un par solitario (m=5, n=1 o AX 5 E 1) ahora distinguimos entre las posiciones axial y equitativa; el par solitario se considera que está en una de las posiciones axiales, mientras que el enlace directamente opuesto al par solitario es el enlace axial. La geometría molecular es una pirámide cuadrada con ángulos de unión de 90° entre enlaces ecuatoriales adyacentes y ligeramente menores de 90° entre el enlace axial y los grupos ecuatoriales.
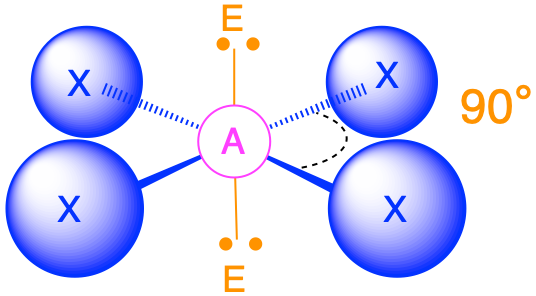
- Cuando hay dos pares solitarios (m=4, n=2 o AX 4 E 2), los pares solitarios son opuestos entre sí y cada uno ocupa una posición axial. La geometría molecular es plana cuadrada con ángulos de unión de 90°.
AX 5 E Moléculas: BrF 5
1. El átomo central, bromo, tiene siete electrones de valencia, al igual que cada flúor, por lo que la estructura de electrones de Lewis es
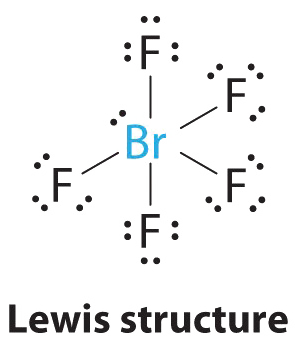
Con su valencia expandida, esta especie es una excepción a la regla del octeto.
2. Hay seis grupos de electrones alrededor del Br, cinco pares de enlace y un par solitario. Colocar cinco átomos de F alrededor de Br mientras se minimizan las repulsiones BP-BP y LP-BP se obtiene la siguiente estructura:
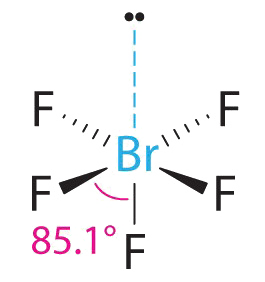
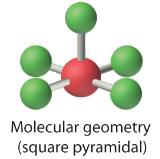
3. Con cinco pares de unión y un par solitario, BrF 5 se designa como AX 5 E; tiene un total de seis pares de electrones. La estructura BrF 5 tiene cuatro átomos de flúor en un plano en posición ecuatorial y un átomo de flúor y el par solitario de electrones en las posiciones axiales. Esperamos que todos los ángulos ecuatoriales F axiales —Br—F sean menores de 90° debido al par solitario de electrones, que ocupa más espacio que los pares de electrones de enlace.
4. Con cinco núcleos rodeando el átomo central, la estructura molecular se basa en un octaedro al que falta un vértice. Esta estructura molecular es piramidal cuadrada. Los ángulos ecuatoriales axiales F —B—F son 85.1°, menores de 90° debido a las repulsiones LP-BP.
AX 4 E 2 Moléculas: iCl 4 −
1. El átomo central, el yodo, aporta siete electrones. Cada cloro aporta siete, y hay una sola carga negativa. La estructura de electrones de Lewis es
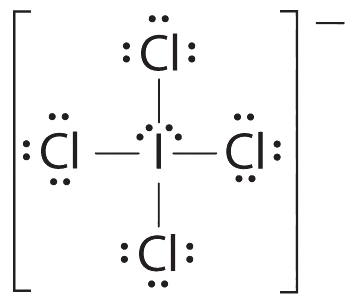
2. Hay seis grupos de electrones alrededor del átomo central, cuatro pares de enlace y dos pares solitarios. La estructura que minimiza las repulsiones LP-LP, LP-BP y BP-BP es
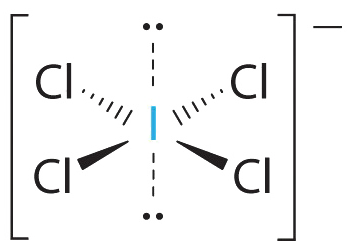
3. iCL 4 − se designa como AX 4 E 2 y tiene un total de seis pares de electrones. Aunque hay pares solitarios de electrones, con cuatro pares de electrones de enlace en el plano ecuatorial y los pares solitarios de electrones en las posiciones axiales, todas las repulsiones LP-BP son las mismas. Por lo tanto, no esperamos ninguna desviación en los ángulos de enlace Cl—I—Cl.
4. Con cinco núcleos, el iCl4− forma una estructura molecular que es plana cuadrada, un octaedro con dos vértices opuestos que faltan.
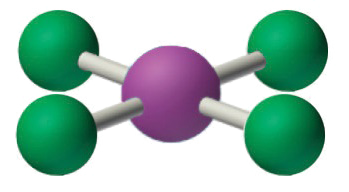
Resumen
La disposición de los átomos unidos en una molécula o ion poliatómico es crucial para comprender la química de una molécula, pero las estructuras de electrones de Lewis no dan información sobre la geometría molecular. El modelo de repulsión de pares de electrones de capa de valencia (VSEPR) nos permite predecir cuál de las posibles estructuras se observa realmente en la mayoría de los casos. VSEPR se basa en la suposición de que los pares de electrones ocupan el espacio, y la estructura de menor energía es la que minimiza las repulsiones entre pares de electrones. En el modelo VSEPR, a la molécula o ion poliatómico se le da una designación AX m E n, donde A es el átomo central, X es un átomo unido, E es un grupo de electrones de valencia no enlazante (generalmente un par solitario de electrones), y m y n son enteros. Cada grupo alrededor del átomo central se designa como un par de enlace (BP) o un par solitario (no enlazante) (LP). A partir de las interacciones BP y LP podemos predecir tanto las posiciones relativas de los átomos como los ángulos entre los enlaces, llamados ángulos de enlace. A partir de esto podemos describir la geometría molecular. El modelo VSEPR se puede utilizar para predecir las formas de muchas moléculas e iones poliatómicos, pero no da información sobre la longitud de los enlaces y la presencia de múltiples enlaces. Una combinación de VSEPR y un modelo de unión, como las estructuras de electrones de Lewis, es necesaria para comprender la presencia de múltiples enlaces.
La relación entre el número de grupos de electrones alrededor de un átomo central, el número de pares solitarios de electrones y la geometría molecular se resume en la Tabla\(\PageIndex{1}\).
Excercises de ejemplo
Utilizando el modelo VSEPR, predecir la geometría molecular de cada molécula o ion.
- PF 5 (pentafluoruro de fósforo, un catalizador utilizado en ciertas reacciones orgánicas)
- H 3 O + (ion hidronio)
Dado: dos especies químicas
Preguntado por: geometría molecular
Estrategia:
- Dibujar la estructura electrónica de Lewis de la molécula o ion poliatómico.
- Determinar la disposición del grupo de electrones alrededor del átomo central que minimiza las repulsiones.
- Asigne una designación AX m E n; luego identifique las interacciones LP-LP, LP-BP o BP-BP y prediga desviaciones en los ángulos de enlace.
- Describir la geometría molecular.
Solución:
- A El átomo central, P, tiene cinco electrones de valencia y cada flúor tiene siete electrones de valencia, por lo que la estructura de Lewis de PF 5 es
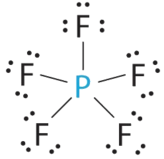
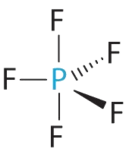
B Hay cinco grupos de unión sobre el fósforo. La estructura que minimiza las repulsiones es una bipirámide trigonal.
C Todos los grupos de electrones son pares de unión, por lo que PF 5 se designa como AX 5. Observe que esto da un total de cinco pares de electrones. Sin repulsiones de pares solitarios, no esperamos que ningún ángulo de enlace se desvíe del ideal.
D La molécula PF 5 tiene cinco núcleos y no hay pares solitarios de electrones, por lo que su geometría molecular es trigonal bipiramidal.
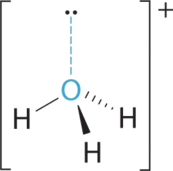
- A El átomo central, O, tiene seis electrones de valencia, y cada átomo H aporta un electrón de valencia. Restar un electrón para la carga positiva da un total de ocho electrones de valencia, por lo que la estructura de electrones de Lewis es
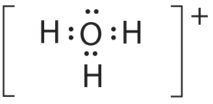
B Hay cuatro grupos de electrones alrededor del oxígeno, tres pares de enlace y un par solitario. Al igual que NH 3, las repulsiones se minimizan dirigiendo cada átomo de hidrógeno y el par solitario a las esquinas de un tetraedro.
C Con tres pares de unión y un par solitario, la estructura se designa como AX 3 E y tiene un total de cuatro pares de electrones (tres X y uno E). Esperamos que las interacciones LP-BP provoquen que los ángulos de los pares de unión se desvíen significativamente de los ángulos de un tetraedro perfecto.
D Hay tres núcleos y un par solitario, por lo que la geometría molecular es piramidal trigonal, en esencia un tetraedro que le falta un vértice. Sin embargo, los ángulos de enlace H-O-H son menores que el ángulo ideal de 109.5° debido a las repulsiones LP-BP:
Utilizando el modelo VSEPR, predecir la geometría molecular de cada molécula o ion.
- XEo 3
- PF 6 −
- NO 2 +
- Responder a
-
piramidal trigonal
- Respuesta b
-
octaédrico
- Respuesta c
-
lineal
Predecir la geometría molecular de cada molécula.
- xEF 2
- SnCl 2
Dado: dos compuestos químicos
Preguntado por: geometría molecular
Estrategia:
Utilice la estrategia dada en Ejemplo\(\PageIndex{1}\).
Solución:
- Un xenón aporta ocho electrones y cada flúor siete electrones de valencia, por lo que la estructura de electrones de Lewis es

B Hay cinco grupos de electrones alrededor del átomo central, dos pares de enlace y tres pares solitarios. Las repulsiones se minimizan colocando los grupos en las esquinas de una bipirámide trigonal.
C A partir de B, xEF 2 se designa como AX 2 E 3 y tiene un total de cinco pares de electrones (dos X y tres E). Con tres pares solitarios alrededor del átomo central, podemos organizar los dos átomos F de tres maneras posibles: ambos átomos F pueden ser axiales, uno puede ser axial y otro ecuatorial, o ambos pueden ser ecuatoriales:
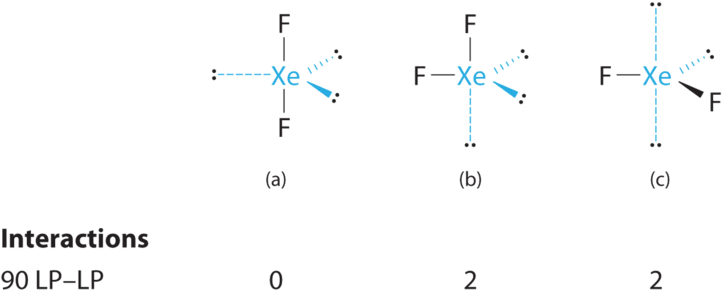
La estructura con la energía más baja es la que minimiza las repulsiones LP-LP. Tanto (b) como (c) tienen dos interacciones LP-LP de 90°, mientras que la estructura (a) no tiene ninguna. Así ambos átomos F están en las posiciones axiales, como los dos átomos de yodo alrededor del yodo central en I 3 −. Todas las interacciones LP-BP son equivalentes, por lo que no esperamos una desviación de 180° ideal en el ángulo de enlace F—Xe—F.
D Con dos núcleos alrededor del átomo central, la geometría molecular de xEF 2 es lineal. Se trata de una bipirámide trigonal con tres vértices ecuatoriales faltantes.
- A El átomo de estaño dona 4 electrones de valencia y cada átomo de cloro dona 7 electrones de valencia. Con 18 electrones de valencia, la estructura de electrones de Lewis es
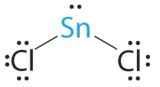
B Hay tres grupos de electrones alrededor del átomo central, dos grupos de enlace y un par solitario de electrones. Para minimizar las repulsiones, los tres grupos se colocan inicialmente en ángulos de 120° entre sí.
C A partir de B designamos SnCl 2 como AX 2 E. Tiene un total de tres pares de electrones, dos X y uno E. Debido a que el par solitario de electrones ocupa más espacio que los pares de enlace, esperamos una disminución en el ángulo de enlace Cl-Sn-Cl debido al aumento de las repulsiones LP-BP.
D Con dos núcleos alrededor del átomo central y un par solitario de electrones, la geometría molecular de SnCl 2 está doblada, como SO 2, pero con un ángulo de enlace Cl-Sn-Cl de 95°. La geometría molecular se puede describir como una disposición plana trigonal con un vértice faltante.
Predecir la geometría molecular de cada molécula.
- SO 3
- xEF 4
- Responder a
-
plano trigonal
- Respuesta b
-
plano cuadrado