3.2.2: Bonos Múltiples
- Page ID
- 81297
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)En las secciones anteriores, vimos cómo predecir la geometría aproximada alrededor de un átomo usando la teoría VSEPR, y aprendimos que los pares solitarios de electrones distorsionan ligeramente los ángulos de enlace de la geometría “padre”. Esta página analiza el efecto de múltiples enlaces (dobles y triples) entre los átomos unidos.
Los enlaces dobles y triples son más repulsivos que los enlaces simples
La teoría de VSEPR predice que los enlaces dobles y triples tienen fuerzas repulsivas más fuertes que los enlaces simples. Al igual que los pares solitarios de electrones, los enlaces múltiples ocupan más espacio alrededor del átomo central que un enlace sencillo. El resultado es que los ángulos de unión están ligeramente distorsionados en comparación con la geometría padre. Dado que un enlace múltiple tiene una densidad de electrones más alta que un enlace sencillo, sus electrones ocupan más espacio que los de un enlace sencillo. Los enlaces dobles y triples distorsionan los ángulos de enlace de una manera similar a lo que hacen los pares solitarios. Debido a la repulsión más fuerte, los enlaces dobles y triples ocupan posiciones similares a las de los pares solitarios en grupos con grupos de 5 y 6 electrones.
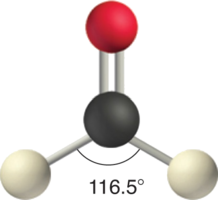
CH 2 O
En una molécula como CH 2 O (AX 3), cuya estructura se muestra a continuación, el doble enlace repele los enlaces simples con mayor fuerza que los enlaces simples se repelen entre sí. Esto provoca una desviación de la geometría ideal (un ángulo de unión H—C—H de 116.5° en lugar de 120°).
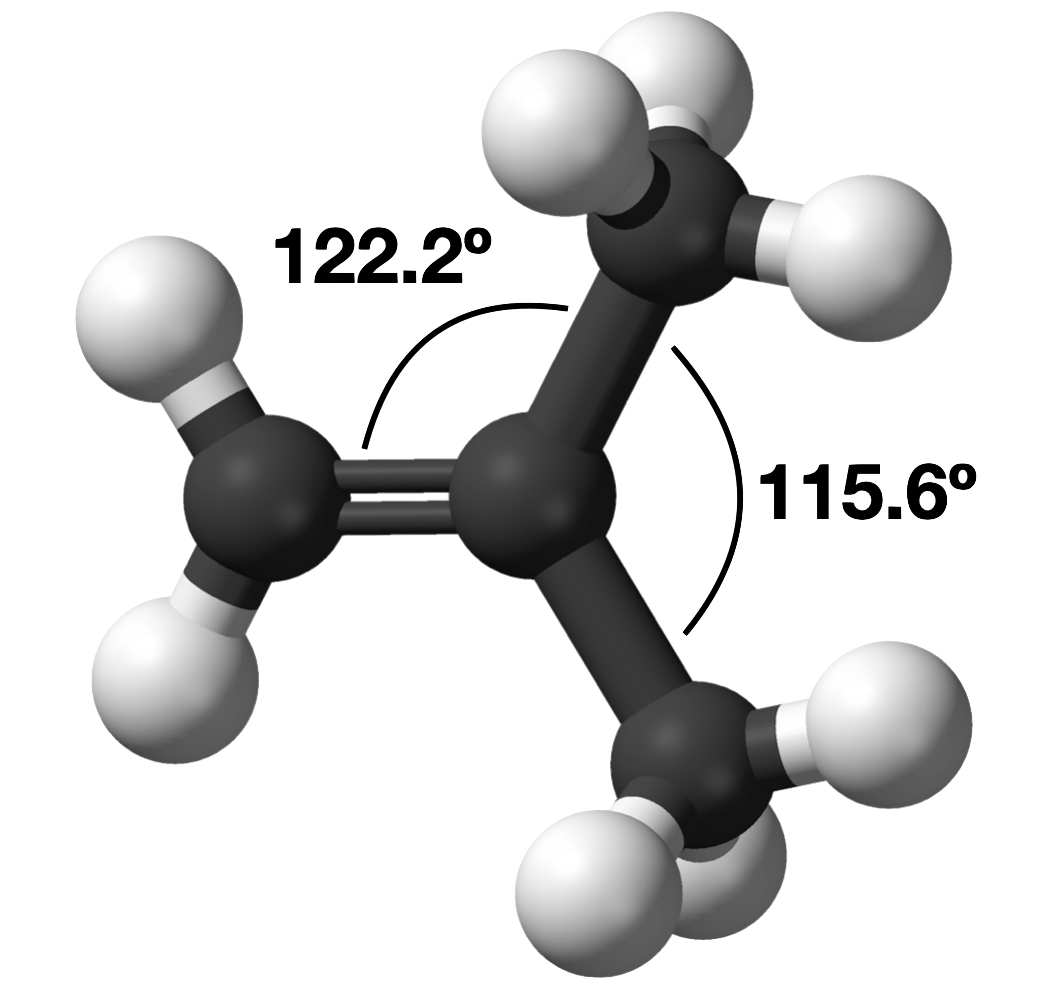
2-metibuteno
En la molécula, CH 2 C (CH 3) 2, el ángulo de enlace metil—C-metilo es 115.6°, que es menor que el ángulo de enlace de 120° que se esperaría de la geometría parental. Por otro lado, el ángulo de enlace acetil-C—metilo es mayor de 120°, con un ángulo de enlace real de 122.2°.
Átomos con ambos pares solitarios y enlaces múltiples
En general, se espera que un par solitario tenga una fuerza repulsiva ligeramente mayor que un enlace múltiple, y que un enlace múltiple tenga una fuerza repulsiva ligeramente mayor que un enlace simple. El orden de la fuerza repulsiva esperada es:
\[\text{lone pair} > \text{double or triple bond} > \text{single bond} \nonumber \]
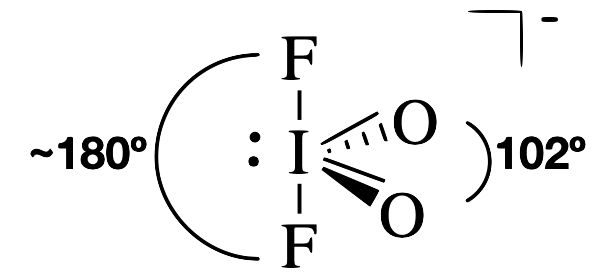
IO 2 F 2 ¯
Con cinco grupos de electrones, la molécula IO 2 F 2 tiene una geometría electrónica bipiramidal (parental) aproximadamente trigonal. El átomo central de yodo tiene un enlace sencillo a cada uno de los átomos de flúor, un doble enlace a cada oxígeno y un par solitario. El par solitario y los dobles enlaces ocuparán más espacio alrededor del yodo que cada uno de los enlaces simples. Así, esperamos que el par solitario y los dobles enlaces ocupen posiciones ecuatoriales alrededor del yodo central. El ángulo de unión O=I=O es 102° (mucho menor que el ángulo de 120° esperado de la geometría padre). Este ángulo dramáticamente menor es el resultado de la mayor repulsión entre el par solitario y el doble enlace.
SEOCL 2
Con cuatro grupos de electrones, la molécula SeOCl 2 tiene cuatro grupos de electrones y geometría electrónica (parental) aproximadamente tetraédrica. Tiene tanto un par solitario como un doble enlace en el átomo central de selenio. Los dos átomos de cloro están unidos individualmente al selenio, mientras que el oxígeno está doble enlazado. El par solitario es más repulsivo, seguido por el oxígeno de doble enlace, y luego los enlaces de cloro. Esto da un ángulo de unión Cl—Se—Cl de 97° y un ángulo de unión Cl—Se—O de 106°; ambos ángulos son menores que los ángulos de 109.5° esperados para la geometría tetraédrica ideal.

Practica
Utilice la teoría VSEPR para predecir las geometrías y dibujar las estructuras de lo siguiente.
- XEoF 4
- NO 2 ¯
- SocL 2
- IOF 3 ¯
- Contestar a
-
Esta molécula tiene seis grupos de electrones alrededor del átomo central de Xe (número estérico 6), y por lo tanto tiene una geometría electrónica (parental) aproximadamente octahédrica. Hay un doble enlace a O y un par solitario, ambos de los cuales son más fuertemente repulsivos que los enlaces simples a F. El doble enlace y el par solitario serán directamente opuestos entre sí, designados como posiciones axiales. El resultado es una geometría molecular piramidal cuadrada. La teoría VSEPR predice ángulos de unión F—Xe—F de 90°. Como regla general, los pares solitarios son ligeramente más repulsivos que los enlaces múltiples, por lo que podríamos esperar que los ángulos de enlace O—Xe—F sean <90°; sin embargo, en este caso se observa que el ángulo de enlace O—Xe—F real es de 91° (no podrías haber predicho lo último).
F4.png)
- Respuesta b
-
Esta molécula tiene tres grupos de electrones alrededor del átomo central: un par solitario y dos dobles enlaces a los átomos de oxígeno. Esto da como resultado un plano electrónico aproximadamente trigonal (geometría padre). Esperamos que el par solitario sea un poco más repulsivo que los dobles enlaces, por lo que esperamos que el ángulo de enlace O—N-O sea ligeramente inferior a 120°. El ángulo O—N-O real es 115°.
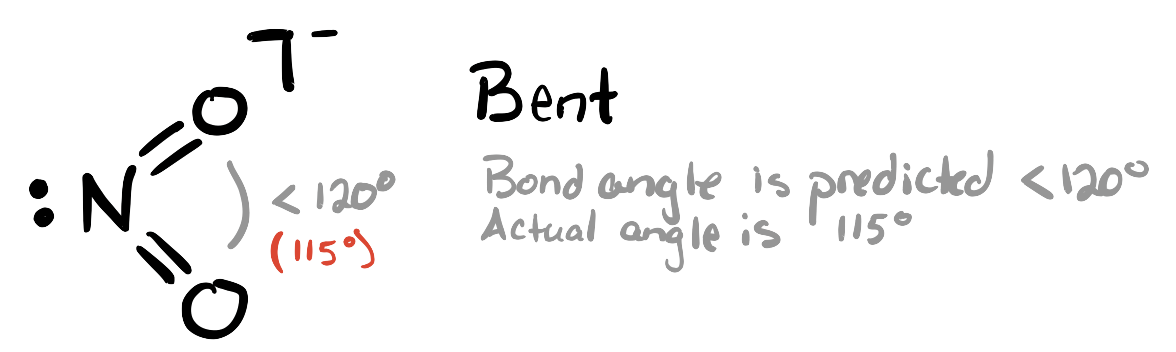
- Respuesta c
-
Esta molécula tiene cuatro grupos de electrones (número estérico 4) con una geometría electrónica (parental) aproximadamente tetraédrica. Cada oxígeno de doble enlace ocupará más espacio alrededor del S central que los átomos de Cl unidos simples. Debemos esperar que los dobles enlaces se repelan entre sí con más fuerza de lo que repelen cada enlace sencillo, siendo la interacción menos repulsiva entre los dos enlaces simples. Se espera que el ángulo de unión para Cl——Cl sea <109.5° de acuerdo con la teoría VSEPR (sin embargo, en realidad es de 111°). Esperaríamos que el ángulo de unión para O—S—O sea mayor que el ángulo para Cl—S-Cl y para Cl—S—O. Se prevé que el ángulo de enlace O—S—O sea >109.5° (y el ángulo de unión real es 120°). La geometría molecular es un tetraedro distorsionado.

- Respuesta d
-
Esta molécula tiene cinco grupos de electrones (número estérico 5) con una geometría electrónica bipiramidal (parental) aproximadamente trigonal. Hay un par solitario, un doble enlace a O, y tres enlaces simples a átomos F alrededor del átomo central de I. El par solitario y el doble enlace son más repulsivos, y deberían ocupar las posiciones ecuatoriales menos concurridas en lugar de las posiciones axiales más abarrotadas. Esto da como resultado una geometría molecular de balancín. Con el par solitario más repulsivo y la fuerza repulsiva ecuatorial más fuerte entre el doble enlace y el par solitario, deberíamos esperar que el ángulo de enlace F ecuatorial —I—O sea menor que el ángulo de 120° esperado para la geometría padre (en realidad es mucho menor, a 98°). Debido a la repulsión entre los átomos F axiales y tanto el par solitario como el doble enlace, debemos esperar que los ángulos de enlace F—S—F se compriman. El axial F —I—F axial es en realidad 168°.

Referencias
- Miessler, G.; Fischer, P.J.; Tarr, D. (2014). Química Inorgánica. Nueva Jersey: Prentice-Hall. pp. 55


