3.4: Enlace de hidrógeno
- Page ID
- 81306
Un enlace de hidrógeno es una fuerza intermolecular (IMF) que forma un tipo especial de atracción dipolo-dipolo cuando un átomo de hidrógeno unido a un átomo fuertemente electronegativo existe en las proximidades de otro átomo electronegativo con un par solitario de electrones. Las fuerzas intermoleculares (IMF) ocurren entre las moléculas. Otros ejemplos incluyen interacciones dipolo-dipolo ordinarias y fuerzas de dispersión. Los enlaces de hidrógeno son generalmente más fuertes que el dipolo-dipolo ordinario y las fuerzas de dispersión, pero más débiles que los enlaces covalentes e iónicos verdaderos.
La evidencia de los enlaces de hidrógeno
Muchos elementos forman compuestos con hidrógeno. Si trazas los puntos de ebullición de los compuestos del grupo 14 elementos con hidrógeno, encuentras que los puntos de ebullición aumentan a medida que vas bajando del grupo.
El aumento en el punto de ebullición ocurre porque las moléculas se están haciendo más grandes con más electrones, y así las fuerzas de dispersión de van der Waals se hacen mayores. Si repites este ejercicio con los compuestos de los elementos en los grupos 15, 16 y 17 con hidrógeno, sucede algo extraño.
Si bien el mismo razonamiento se aplica para el grupo 4 de la tabla periódica, el punto de ebullición del compuesto de hidrógeno con el primer elemento en cada grupo es anormalmente alto. En los casos de\(NH_3\),\(H_2O\) y debe\(HF\) haber algunas fuerzas intermoleculares adicionales de atracción, requiriendo significativamente más energía térmica para romper los IMF. Estas fuerzas intermoleculares relativamente poderosas se describen como enlaces de hidrógeno.
Origen de los enlaces de hidrógeno
Las moléculas capaces de formar enlaces de hidrógeno incluyen las siguientes:
Observe que en cada una de estas moléculas:
- El hidrógeno está unido directamente a átomos altamente electronegativos, lo que hace que el hidrógeno adquiera una carga altamente positiva.
- Cada uno de los átomos altamente electronegativos alcanza una carga negativa alta y tiene al menos un par solitario “activo”. Los pares solitarios en el nivel 2 tienen electrones contenidos en un volumen relativamente pequeño de espacio, lo que resulta en una alta densidad de carga negativa. Los pares solitarios en niveles más altos son más difusos y, dando como resultado una menor densidad de carga y menor afinidad por la carga positiva.
Si no estás familiarizado con la electronegatividad, debes seguir este enlace antes de continuar.
Considera que dos moléculas de agua se acercan entre sí.
El\(\delta^+\) hidrógeno es tan fuertemente atraído por el par solitario que es casi como si estuvieras empezando a formar un enlace coordinado (dativo covalente). No va tan lejos, pero la atracción es significativamente más fuerte que una interacción dipolo-dipolo ordinaria. Los enlaces de hidrógeno tienen aproximadamente una décima parte de la fuerza de un enlace covalente promedio, y se rompen y reforman constantemente en agua líquida. Si se compara el enlace covalente entre el oxígeno y el hidrógeno con un matrimonio estable, el enlace de hidrógeno tiene el estatus de “solo buenos amigos”.
El agua es un ejemplo ideal de enlaces de hidrógeno. Observe que cada molécula de agua puede formar potencialmente cuatro enlaces de hidrógeno con las moléculas de agua circundantes: dos con los átomos de hidrógeno y dos con los átomos de oxígeno. Hay exactamente el número correcto de\(\delta^+\) hidrógenos y pares solitarios para que cada uno de ellos participe en los enlaces de hidrógeno.
Es por ello que el punto de ebullición del agua es mayor que el del amoníaco o fluoruro de hidrógeno. En el caso del amoníaco, la cantidad de enlaces de hidrógeno está limitada por el hecho de que cada nitrógeno solo tiene un par solitario. En un grupo de moléculas de amoníaco, no hay suficientes pares solitarios para dar la vuelta para satisfacer todos los hidrógenos. En el fluoruro de hidrógeno, el problema es la escasez de hidrógenos. En el agua, dos enlaces de hidrógeno y dos pares solitarios permiten la formación de interacciones de enlaces de hidrógeno en una red de moléculas de agua. Así, el agua se considera un sistema de enlace de hidrógeno ideal.
Ejemplos más complejos de enlaces de hidrógeno
La hidratación de iones negativos
Cuando una sustancia iónica se disuelve en agua, las moléculas de agua se agrupan alrededor de los iones separados. Este proceso se llama hidratación. El agua se une frecuentemente a iones positivos mediante enlaces coordinados (covalentes dativos). Se une a iones negativos usando enlaces de hidrógeno.
Si estás interesado en la unión en iones positivos hidratados, podrías seguir este enlace para coordinarse (dativo covalente) enlace.
El diagrama muestra los potenciales enlaces de hidrógeno formados con un ion cloruro, Cl-. Aunque los pares solitarios en el ion cloruro están en el nivel 3 y normalmente no serían lo suficientemente activos para formar enlaces de hidrógeno, se hacen más atractivos por la carga negativa total sobre el cloro en este caso.
Por complicado que sea el ion negativo, siempre habrá pares solitarios a los que los átomos de hidrógeno de las moléculas de agua puedan enlazarse con hidrógeno.
Enlace de hidrógeno en alcoholes
Un alcohol es una molécula orgánica que contiene un grupo -OH. Cualquier molécula que tenga un átomo de hidrógeno unido directamente a un oxígeno o un nitrógeno es capaz de formar enlaces de hidrógeno. Los enlaces de hidrógeno también ocurren cuando el hidrógeno está unido al flúor, pero el grupo HF no aparece en otras moléculas. Las moléculas con enlaces de hidrógeno siempre tendrán puntos de ebullición más altos que las moléculas de tamaño similar que no tienen un grupo -O-H o un grupo -N-H. El enlace de hidrógeno hace que las moléculas sean “más adherentes”, de tal manera que se requiere más calor (energía) para separarlas. Este fenómeno puede ser utilizado para analizar el punto de ebullición de diferentes moléculas, definidas como la temperatura a la que se produce un cambio de fase de líquido a gas.
El etanol,\(\ce{CH3CH2-O-H}\), y el metoximetano\(\ce{CH3-O-CH3}\),, ambos tienen la misma fórmula molecular,\(\ce{C2H6O}\).
Tienen el mismo número de electrones, y una longitud similar. Las atracciones de van der Waals (tanto las fuerzas de dispersión como las atracciones dipolo-dipolo) en cada una serán similares. Sin embargo, el etanol tiene un átomo de hidrógeno unido directamente a un oxígeno; aquí el oxígeno todavía tiene dos pares solitarios como una molécula de agua. Los enlaces de hidrógeno pueden ocurrir entre las moléculas de etanol, aunque no tan eficazmente como en el agua. El enlace de hidrógeno está limitado por el hecho de que solo hay un hidrógeno en cada molécula de etanol con suficiente carga +.
En el metoximetano, los pares solitarios en el oxígeno siguen ahí, pero los hidrógenos no son suficientemente + para que se formen enlaces de hidrógeno. Excepto en algunos casos bastante inusuales, el átomo de hidrógeno tiene que estar unido directamente al elemento muy electronegativo para que se produzca el enlace de hidrógeno. Los puntos de ebullición del etanol y el metoximetano muestran el dramático efecto que el enlace de hidrógeno tiene sobre la adherencia de las moléculas de etanol:
| etanol (con enlaces de hidrógeno) | 78.5°C |
| metoximetano (sin enlaces de hidrógeno) | -24.8°C |
El enlace de hidrógeno en el etanol ha elevado su punto de ebullición alrededor de 100°C Es importante darse cuenta de que existe enlace de hidrógeno además de las atracciones de van der Waals. Por ejemplo, todas las siguientes moléculas contienen el mismo número de electrones, y las dos primeras tienen longitudes de cadena similares. El mayor punto de ebullición del butan-1-ol se debe al enlace de hidrógeno adicional.
Al comparar los dos alcoholes (que contienen grupos -OH), ambos puntos de ebullición son altos debido al enlace de hidrógeno adicional; sin embargo, los valores no son los mismos. El punto de ebullición del 2-metilpropan-1-ol no es tan alto como el butan-1-ol porque la ramificación en la molécula hace que las atracciones de van der Waals sean menos efectivas que en el butan-1-ol más largo.
Enlace de hidrógeno en moléculas orgánicas que contienen nitrógeno
Los enlaces de hidrógeno también ocurren en moléculas orgánicas que contienen grupos N-H; recuerde los enlaces de hidrógeno que ocurren con el amoníaco. Los ejemplos van desde moléculas simples como CH 3 NH 2 (metilamina) hasta moléculas grandes como proteínas y ADN. Las dos cadenas de la famosa doble hélice en el ADN se mantienen unidas por enlaces de hidrógeno entre átomos de hidrógeno unidos al nitrógeno en una hebra, y pares solitarios en otra nitrógeno o un oxígeno en la otra.
Donantes y aceptadores
Para que ocurra un enlace de hidrógeno debe haber tanto un donante de hidrógeno como un aceptor presentes. El donante en un enlace de hidrógeno suele ser un átomo fuertemente electronegativo como N, O o F que está unido covalentemente a un enlace de hidrógeno.
El aceptor de hidrógeno es un átomo electronegativo de una molécula o ion vecino que contiene un par solitario que participa en el enlace de hidrógeno.
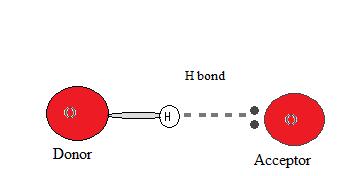
¿Por qué ocurre un enlace de hidrógeno?
Dado que el donante de hidrógeno (N, O o F) es fuertemente electronegativo, atrae al par de electrones unido covalentemente más cerca de su núcleo, y lejos del átomo de hidrógeno. El átomo de hidrógeno se deja entonces con una carga positiva parcial, creando una atracción dipolo-dipolo entre el átomo de hidrógeno unido al donante y el par de electrones solitario del aceptor. Esto da como resultado un enlace de hidrógeno. (ver Interacciones entre moléculas con dipolos permanentes)
Tipos de enlaces de hidrógeno
Aunque los enlaces de hidrógeno son bien conocidos como un tipo de IMF, estos enlaces también pueden ocurrir dentro de una sola molécula, entre dos moléculas idénticas, o entre dos moléculas diferentes.
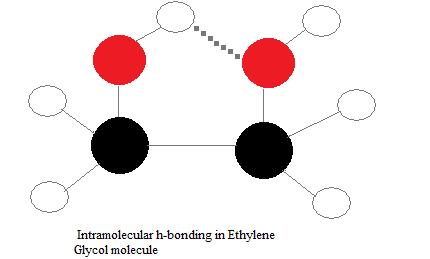
Enlaces de hidrógeno intramoleculares
Los enlaces de hidrógeno intramoleculares son aquellos que ocurren dentro de una sola molécula. Esto ocurre cuando dos grupos funcionales de una molécula pueden formar enlaces de hidrógeno entre sí. Para que esto suceda, tanto un donante de hidrógeno como un aceptor de hidrógeno deben estar presentes dentro de una molécula, y deben estar muy cerca uno del otro en la molécula. Por ejemplo, los enlaces de hidrógeno intramoleculares se producen en etilenglicol (C 2 H 4 (OH) 2) entre sus dos grupos hidroxilo debido a la geometría molecular.
Enlaces de hidrógeno intermoleculares
Los enlaces de hidrógeno intermoleculares ocurren entre moléculas separadas en una sustancia. Pueden ocurrir entre cualquier número de moléculas similares o diferentes siempre y cuando los donantes y aceptores de hidrógeno estén presentes en posiciones donde puedan interactuar entre sí. Por ejemplo, los enlaces de hidrógeno intermoleculares pueden ocurrir entre las moléculas NH 3 solas, entre las moléculas H 2 O solas, o entre las moléculas NH 3 y H 2 O.
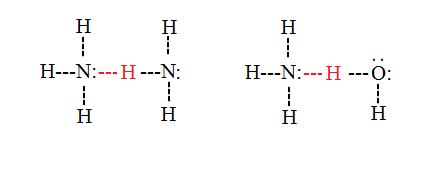
Propiedades y efectos de los enlaces de hidrógeno
En punto de ebullición
Cuando consideramos los puntos de ebullición de las moléculas, generalmente esperamos que las moléculas con masas molares más grandes tengan puntos de ebullición normales más altos que las moléculas con masas molares más pequeñas. Esto, sin tener en cuenta los enlaces de hidrógeno, se debe a mayores fuerzas de dispersión (ver Interacciones entre moléculas no polares). Las moléculas más grandes tienen más espacio para la distribución de electrones y, por lo tanto, más posibilidades para un momento dipolo instantáneo. No obstante, cuando consideramos la siguiente tabla, vemos que no siempre es así.
| Compuesto | Masa molar | Punto de ebullición normal |
|---|---|---|
| \(H_2O\) | 18 g/mol | 373 K |
| \(HF\) | 20 g/mol | 292.5 K |
| \(NH_3\) | 17 g/mol | 239.8 K |
| \(H_2S\) | 34 g/mol | 212.9 K |
| \(HCl\) | 36.4 g/mol | 197.9 K |
| \(PH_3\) | 34 g/mol | 185.2 K |
Vemos que H 2 O, HF y NH 3 tienen cada uno puntos de ebullición más altos que el mismo compuesto formado entre el hidrógeno y el siguiente elemento bajando por su grupo respectivo, lo que indica que los primeros tienen mayores fuerzas intermoleculares. Esto se debe a que H 2 O, HF y NH 3 presentan enlaces de hidrógeno, mientras que los demás no. Además,\(H_2O\) tiene una masa molar menor que el HF pero participa en más enlaces de hidrógeno por molécula, por lo que su punto de ebullición es mayor.
Sobre Viscosidad
El mismo efecto que se observa en el punto de ebullición como resultado de los enlaces de hidrógeno también se puede observar en la viscosidad de ciertas sustancias. Las sustancias capaces de formar enlaces de hidrógeno tienden a tener una viscosidad mayor que las que no forman enlaces de hidrógeno. Generalmente, las sustancias que tienen la posibilidad de múltiples enlaces de hidrógeno exhiben viscosidades aún mayores.
Factores que impiden la unión de hidrógeno
Electronegatividad
Los enlaces de hidrógeno no pueden ocurrir sin diferencias significativas de electronegatividad entre el hidrógeno y el átomo al que está unido. Así, vemos moléculas como PH 3, que no participan en enlaces de hidrógeno. PH 3 presenta una geometría molecular piramidal trigonal como la del amoníaco, pero a diferencia del NH 3 no puede formar enlaces de hidrógeno. Esto se debe a la similitud en las electronegatividades del fósforo y el hidrógeno. Ambos átomos tienen una electronegatividad de 2.1, y así, no hay momento dipolar. Esto evita que el átomo de hidrógeno adquiera la carga positiva parcial necesaria para el enlace de hidrógeno con el par de electrones solitario en otra molécula. (ver Polarizabilidad)
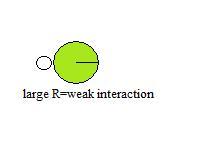
Tamaño del átomo
El tamaño de los donantes y aceptores también puede afectar la capacidad de enlace de hidrógeno. Esto puede explicar la capacidad relativamente baja del Cl para formar enlaces de hidrógeno. Cuando los radios de dos átomos difieren mucho o son grandes, sus núcleos no pueden lograr una estrecha proximidad cuando interactúan, lo que resulta en una interacción débil.
Enlace de hidrógeno en la naturaleza
Los enlaces de hidrógeno juegan un papel crucial en muchos procesos biológicos y pueden explicar muchos fenómenos naturales como las propiedades inusuales del agua. Además de estar presentes en el agua, los enlaces de hidrógeno también son importantes en el sistema de transporte de agua de las plantas, la estructura proteica secundaria y terciaria, y el emparejamiento de bases de ADN.
Plantas
La teoría de cohesión-adhesión del transporte en plantas vasculares utiliza enlaces de hidrógeno para explicar muchos componentes clave del movimiento del agua a través del xilema de la planta y otros vasos. Dentro de un recipiente, las moléculas de agua se unen de hidrógeno no solo entre sí, sino también con la cadena de celulosa que comprende la pared de las células vegetales. Dado que el recipiente es relativamente pequeño, la atracción del agua hacia la pared de celulosa crea una especie de tubo capilar que permite la acción capilar. Este mecanismo permite a las plantas sacar agua hacia sus raíces. Además, los enlaces de hidrógeno pueden crear una larga cadena de moléculas de agua, que pueden superar la fuerza de la gravedad y viajar hasta las altas altitudes de las hojas.
Proteínas
Los enlaces de hidrógeno están presentes abundantemente en la estructura secundaria de las proteínas, y también escasamente en la conformación terciaria. La estructura secundaria de una proteína implica interacciones (principalmente enlaces de hidrógeno) entre cadenas principales polipeptídicas vecinas que contienen pares unidos nitrógeno-hidrógeno y átomos de oxígeno. Dado que tanto el N como el O son fuertemente electronegativos, los átomos de hidrógeno unidos al nitrógeno en una cadena principal polipeptídica pueden unirse por hidrógeno a los átomos de oxígeno en otra cadena y viceversa. Aunque son relativamente débiles, estos enlaces ofrecen una estabilidad sustancial a la estructura de la proteína secundaria porque se repiten muchas veces y funcionan colectivamente.
En la estructura de proteína terciaria, las interacciones son principalmente entre grupos R funcionales de una cadena polipeptídica; una de esas interacciones se llama interacción hidrófoba. Estas interacciones ocurren debido a los enlaces de hidrógeno entre las moléculas de agua alrededor del hidrófobo que refuerza aún más la conformación de la proteína.
Referencias
- Brown, et al. Química:La ciencia central. 11a ed. Upper Saddle River, Nueva Jersey: Pearson/Prentice Hall, 2008.
- Chang, Raymond. Química General:Los Conceptos Esenciales. 3ª ed. Nueva York: Mcgraw Hill, 2003
- Petrucci, et al. Química General: Principios y Aplicaciones Modernas. 9a ed. Upper Saddle River, Nueva Jersey: Pearson/Prentice Hall, 2007.

