3.3: Polaridad Molecular
- Page ID
- 81313
Los momentos dipolares ocurren cuando hay una separación de carga. Pueden ocurrir entre dos iones en un enlace iónico o entre átomos en un enlace covalente; los momentos dipolares surgen de diferencias en la electronegatividad. Cuanto mayor sea la diferencia en la electronegatividad, mayor será el momento dipolar. La distancia entre la separación de carga es también un factor decisivo en el tamaño del momento dipolar. El momento dipolar es una medida de la polaridad de la molécula.
Introducción
Cuando los átomos en una molécula comparten electrones de manera desigual, crean lo que se llama un momento dipolar. Esto ocurre cuando un átomo es más electronegativo que otro, lo que resulta en que ese átomo tira más fuertemente del par compartido de electrones, o cuando un átomo tiene un par solitario de electrones y la diferencia de los puntos del vector de electronegatividad de la misma manera. Uno de los ejemplos más comunes es la molécula de agua, compuesta por un átomo de oxígeno y dos átomos de hidrógeno. Las diferencias en electronegatividad y electrones solitarios dan al oxígeno una carga negativa parcial y a cada hidrógeno una carga positiva parcial.
Momento dipolo
Cuando dos cargas eléctricas, de signo opuesto e igual magnitud, están separadas por una distancia, se establece un dipolo eléctrico. El tamaño de un dipolo se mide por su momento dipolar (\(\mu\)). El momento de inmersión se mide en unidades de Debye, que es igual a la distancia entre las cargas multiplicadas por la carga (1 Debye eq uals\(3.34 \times 10^{-30}\; C\, m\)). El momento dipolar de una molécula se puede calcular mediante la ecuación\(\ref{1}\):
\[ \vec{\mu} = \sum_i q_i \, \vec{r}_i \label{1}\]
donde
- \(\vec{\mu}\)es el vector de momento dipolo
- \(q_i\)es la magnitud de la\(i^{th}\) carga, y
- \(\vec{r}_i\)es el vector que representa la posición de\(i^{th}\) carga.
El momento dipolo actúa en la dirección de la cantidad vectorial. Un ejemplo de una molécula polar i\(\ce{H_2O}\) s. Debido al par solitario en oxígeno, la estructura de\(\ce{H_2O}\) está doblada (vía la teoría VSEPR), lo que significa que los vectores que representan el momento dipolar de cada enlace no se cancelan entre sí. De ahí que el agua sea polar.
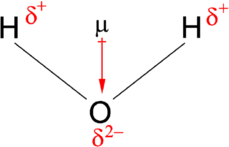
El vector apunta de positivo a negativo, tanto en el momento dipolar molecular (neto) como en los dipolos de enlace individuales. En el cuadro A2 se muestra la electronegatividad de algunos de los elementos comunes. Cuanto mayor sea la diferencia en electronegatividad entre los dos átomos, más electronegativo es ese enlace. Para ser considerado un vínculo polar, la diferencia en la electronegatividad debe ser grande. El momento dipolo apunta en la dirección de la cantidad vectorial de cada una de las electronegatividades del enlace sumadas.
Es relativamente fácil medir momentos dipolares: basta con colocar una sustancia entre placas cargadas (Figura\(\PageIndex{2}\)); las moléculas polares aumentan la carga almacenada en las placas, y se puede obtener el momento dipolar (es decir, a través de la capacitancia del sistema). No polar no\(\ce{CCl_4}\) se desvía; la acetona moderadamente polar se desvía ligeramente; el agua altamente polar se desvía fuertemente. En general, las moléculas polares se alinearán: (1) en un campo eléctrico, (2) una con respecto a la otra, o (3) con respecto a los iones (Figura\(\PageIndex{2}\)).
La ecuación se\(\ref{1}\) puede simplificar para un sistema simple de dos cargas separadas como moléculas diatómicas o cuando se considera un dipolo de enlace dentro de una molécula
\[ \mu_{diatomic} = Q \times r \label{1a}\]
Este dipolo de enlace se interpreta como el dipolo de una separación de carga sobre una distancia\(r\) entre las cargas parciales\(Q^+\) y\(Q^-\) (o los términos más comúnmente utilizados\(δ^+\) -\(δ^-\)); la orientación del dipolo es a lo largo del eje del enlace. Considera un sistema simple de un solo electrón y protón separados por una distancia fija. Cuando el protón y el electrón están muy juntos, el momento dipolar (grado de polaridad) disminuye. Sin embargo, a medida que el protón y el electrón se separan más, el momento dipolar aumenta. En este caso, el momento dipolo se calcula como (vía Ecuación\(\ref{1a}\)):
\[\begin{align*} \mu &= Qr \nonumber \\[4pt] &= (1.60 \times 10^{-19}\, C)(1.00 \times 10^{-10} \,m) \nonumber \\[4pt] &= 1.60 \times 10^{-29} \,C \cdot m \label{2} \end{align*}\]
El Debye caracteriza el tamaño del momento dipolo. Cuando un protón y un electrón están separados por 100pm, el momento dipolar es\(4.80\; D\):
\[\begin{align*} \mu &= (1.60 \times 10^{-29}\, C \cdot m) \left(\dfrac{1 \;D}{3.336 \times 10^{-30} \, C \cdot m} \right) \nonumber \\[4pt] &= 4.80\; D \label{3} \end{align*}\]
\(4.80\; D\)es un valor de referencia clave y representa una carga pura de +1 y -1 separados por 100pm. Si la separación de carga aumenta entonces el momento dipolar aumenta (linealmente):
- Si el protón y el electrón están separados por 120pm:\[\mu = \dfrac{120}{100}(4.80\;D) = 5.76\, D \label{4a}\]
- Si el protón y el electrón están separados por 150pm:\[\mu = \dfrac{150}{100}(4.80 \; D) = 7.20\, D \label{4b}\]
- Si el protón y el electrón están separados por 200pm:\[\mu = \dfrac{200}{100}(4.80 \; D) = 9.60 \,D \label{4c}\]
La molécula de agua en la Figura\(\PageIndex{1}\) puede ser utilizada para determinar la dirección y magnitud del momento dipolar. A partir de las electronegatividades del oxígeno y el hidrógeno, la diferencia en la electronegatividad es 1.2e para cada uno de los enlaces hidrógeno-oxígeno. A continuación, debido a que el oxígeno es el átomo más electronegativo, ejerce una mayor atracción sobre los electrones compartidos; también tiene dos pares solitarios de electrones. A partir de esto, se puede concluir que el momento dipolar apunta desde entre los dos átomos de hidrógeno hacia el átomo de oxígeno. Usando la ecuación anterior, se calcula que el momento dipolar es de 1.85 D multiplicando la distancia entre los átomos de oxígeno e hidrógeno por la diferencia de carga entre ellos y luego encontrando los componentes de cada uno que apuntan en la dirección del momento dipolar neto (el ángulo de la molécula es de 104.5˚).
El momento de unión del enlace O-H = 1.5 D, por lo que el momento dipolo neto es
\[\mu=2(1.5) \cos \left(\dfrac{104.5˚}{2}\right)=1.84\; D \nonumber\]
Polaridad y Estructura de Moléculas
La forma de una molécula y la polaridad de sus enlaces determinan la POLARIDAD GENERAL de esa molécula. Una molécula que contiene enlaces polares podría no tener ninguna polaridad global, dependiendo de su forma. La definición simple de si una molécula compleja es polar o no depende de si sus centros globales de cargas positivas y negativas se superponen. Si estos centros se encuentran en el mismo punto en el espacio, entonces la molécula no tiene polaridad global (y es no polar). Si una molécula es completamente simétrica, entonces los vectores de momento dipolo en cada molécula se cancelarán entre sí, haciendo que la molécula sea no polar. Una molécula sólo puede ser polar si la estructura de esa molécula no es simétrica.
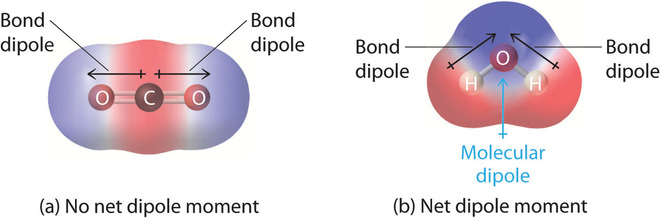
Un buen ejemplo de una molécula no polar que contiene enlaces polares es el dióxido de carbono (Figura\(\PageIndex{3a}\)). This is a linear molecule and each C=O bond is, in fact, polar. The central carbon will have a net positive charge, and the two outer oxygen atoms a net negative charge. However, since the molecule is linear, these two bond dipoles cancel each other out (i.e. the vector addition of the dipoles equals zero) and the overall molecule has a zero dipole moment (\(\mu=0\)).
Aunque un enlace polar es un requisito previo para que una molécula tenga un dipolo, no todas las moléculas con enlaces polares presentan dipolos
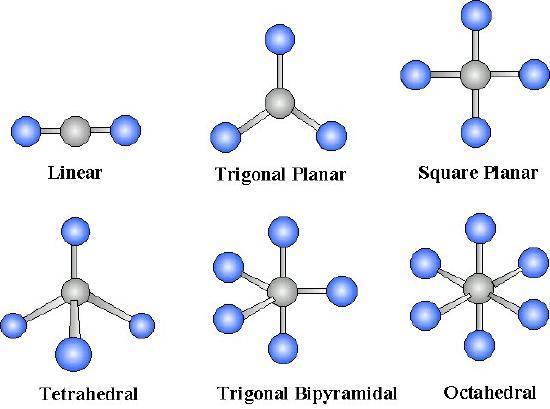
\(AB_n\)Para moléculas, donde\(A\) is the central atom and \(B\) are all the same types of atoms, there are certain molecular geometries which are symmetric. Therefore, they will have no dipole even if the bonds are polar. These geometries include linear, trigonal planar, tetrahedral, octahedral and trigonal bipyramid.
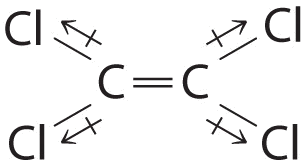
Aunque los enlaces C—Cl son bastante polares, los dipolos de enlace individuales se cancelan entre sí en esta estructura simétrica, y\(\ce{Cl_2C=CCl_2}\) no tienen un momento dipolar neto.
C-Cl, el enlace polar clave, es 178pm. La medición revela 1.87 D. A partir de estos datos, se puede calcular el% de carácter iónico. Si este enlace fuera 100% iónico (basado en protones y electrones),
\[\begin{align*} \mu &= \dfrac{178}{100}(4.80\; D) \nonumber \\[4pt] &= 8.54\; D \nonumber \end{align*} \]
Aunque la longitud del enlace va en aumento, el dipolo disminuye a medida que se mueve hacia abajo en el grupo halógeno. La electronegatividad disminuye a medida que bajamos del grupo. Así, la mayor influencia es la electronegatividad de los dos átomos (que influye en la carga en los extremos del dipolo).
| Compuesto | Longitud de enlace (Å) | Diferencia de Electronegatividad | Momento dipolo (D) |
|---|---|---|---|
| HF | 0.92 | 1.9 | 1.82 |
| HCl | 1.27 | 0.9 | 1.08 |
| HBr | 1.41 | 0.7 | 0.82 |
| HOLA | 1.61 | 0.4 | 0.44 |
Referencias
- Housecroft, Catherine E. y Alan G. Sharpe. Química Inorgánica. 3ª ed. Harlow: Pearson Educación, 2008. Imprimir. (Páginas 44-46)
- Tro, Nivaldo J. Química: un enfoque molecular. Upper Saddle River: Pearson Education, 2008. Imprimir. (Páginas 379-386)


