5.2.4: Espectroscopia fotoelectrónica
- Page ID
- 81026
Un espectro fotoelectrónico puede mostrar las energías relativas de orbitales moleculares ocupados por ionización. La energía de ionización es una medida directa de la energía requerida para simplemente eliminar el electrón en cuestión desde su nivel inicial hasta el nivel de vacío (electrón libre). La espectroscopia fotoelectrónica mide las energías relativas del suelo y los estados de iones positivos excitados que se obtienen mediante la eliminación de electrones individuales de la molécula neutra.
\[A + \text{photon} \rightarrow A^+ + e^- \nonumber \]
La información obtenida de la espectroscopia fotoelectrónica se discute típicamente en términos de la estructura electrónica y la unión en los estados fundamentales de las moléculas neutras, con la ionización de electrones que se produce a partir de orbitales moleculares enlazantes, pares solitarios, orbitales moleculares antiunión o núcleos atómicos. Estas descripciones reflejan la relación de las energías de ionización con el modelo orbital molecular de la estructura electrónica.
Las energías de ionización están directamente relacionadas con las energías de los orbitales moleculares (según el teorema de Koopman).
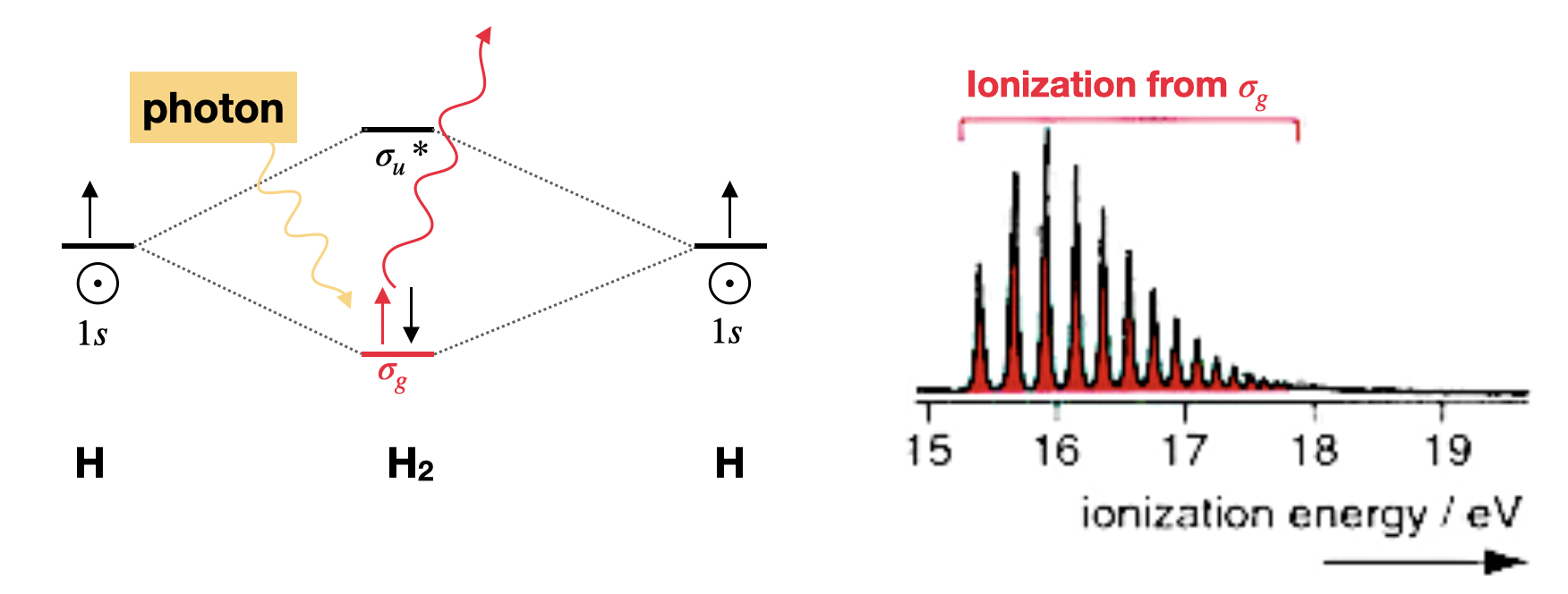
Ejemplo: Espectro fotoelectrónico de dihidrógeno
La descripción orbital molecular del dihidrógeno involucra dos orbitales\(1s\) atómicos que generan dos orbitales moleculares: un enlace\(\sigma_g\) y un antienlace\(\sigma_u^*\). Los dos electrones ocupan el orbital de\(\sigma_g\) unión, dejando la molécula con un orden de enlace de uno (Figura\(\PageIndex{1}\)). El espectro PES de dihidrógeno (Figura\(\PageIndex{1}\)) tiene una sola banda que corresponde a la ionización de un electrón de la\(\sigma_g\). Los múltiples picos se deben a la expulsión de electrones de una gama de niveles de energía vibratoria estimulada. Cuando la estructura vibracional extensa se resuelve en un orbital molecular de PES, entonces la eliminación de un electrón de ese orbital molecular induce un cambio significativo en el enlace (en este caso un aumento en la longitud del enlace debido a la disminución en el orden de enlace).
Ejemplo: Espectro fotoelectrónico de dinitrógeno
El nitrógeno diatómico es más complejo que el hidrógeno ya que se ocupan múltiples orbitales moleculares. Cinco orbitales moleculares están ocupados; dos de ellos son degenerados. Tres bandas en el espectro fotoelectrónico corresponden a la ionización de un electrón en\(\sigma_g(2p)\),\(\pi_u(2p)\) y orbitales\(\sigma_u^*(2s)\) moleculares. La ionización del cuarto tipo de orbital,\(\sigma_g(2s)\), no aparece en la Figura\(\PageIndex{2}\) porque está fuera de escala o porque la luz incidente\(h\nu\) utilizada no tenía suficiente energía para ionizar electrones en ese orbital molecular profundamente estabilizado. Tenga en cuenta que la extensa estructura vibracional para la\(\pi_u(2p)\) banda indica que la eliminación de un electrón de este orbital molecular provoca un cambio significativo en la unión.
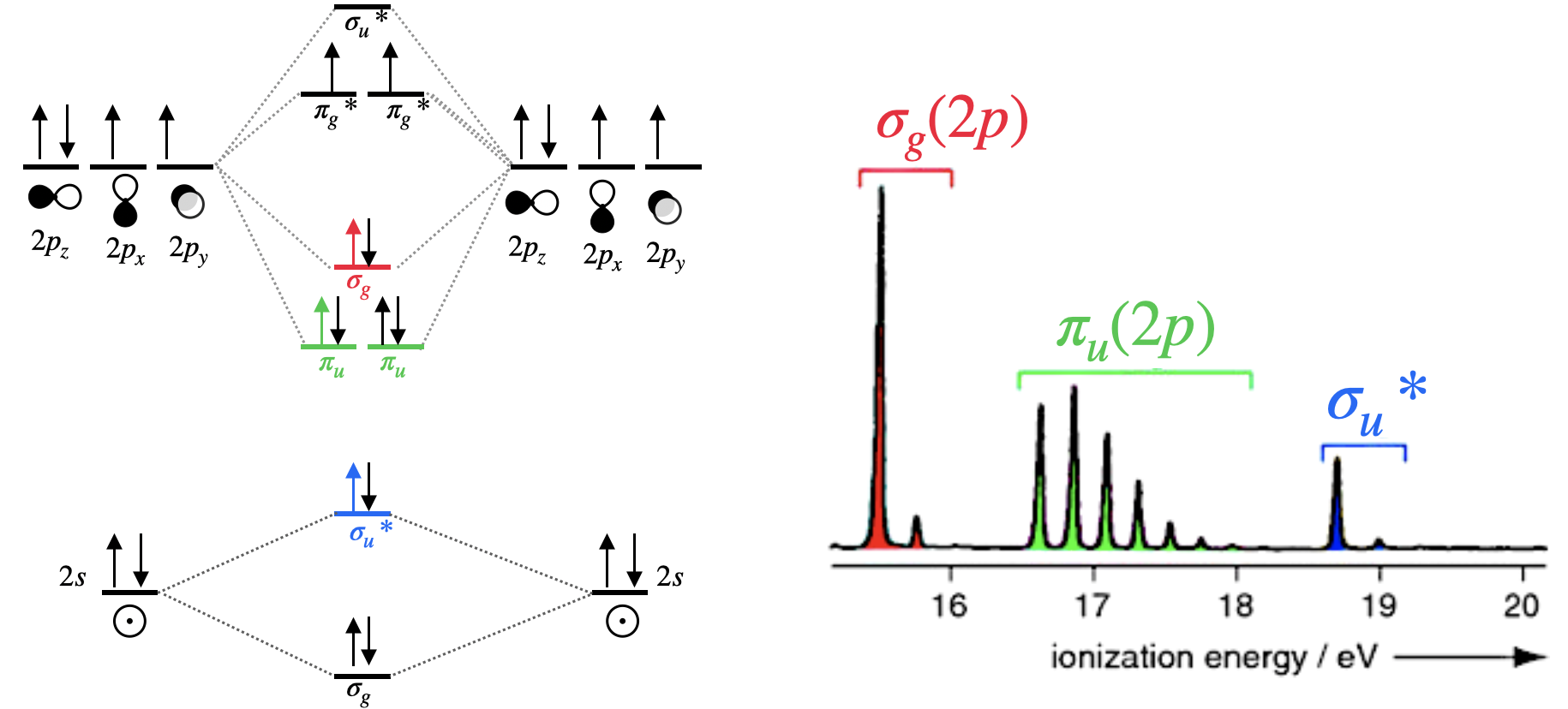
A partir del espectro fotoelectrónico del dinitrógeno, podemos ver que los electrones en el\(\sigma_g(2p)\) orbital pueden ionizarse usando menos energía de la requerida para ionizar electrones en el\(\pi_u(2p)\) orbital. Esto es evidencia de\(\sigma_g(2p)\) existir a una energía más alta que los\(\pi_u(2p)\) orbitales.


