5.4.1: anión bifluoruro
- Page ID
- 80999
Encontrar las SALC y dibujar el diagrama MO para [F-H-F]\(^-\)
El anión lineal [F-H-F]\(^-\) es un buen lugar para comenzar como ejemplo para ilustrar el proceso de generación de SALC de átomos colgantes y luego construir un diagrama orbital molecular para una molécula poliatómica. Procederemos utilizando los pasos descritos en la página anterior para generar las SALC y un diagrama orbital molecular.
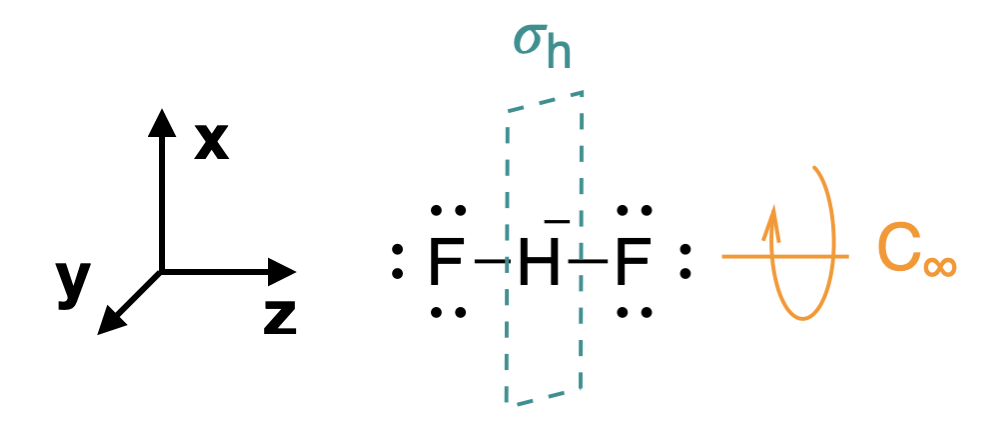
Paso 1. Encuentra el grupo de puntos de la molécula y asigna coordenadas cartesianas para que z sea el eje principal.
Comenzamos asignando el grupo puntual apropiado para esta molécula:\(D_{\infty h}\) (Figura\(\PageIndex{1}\)). Como se mencionó en la página anterior, es útil sustituir a la\(D_{\infty h}\) hora\(D_{2h}\) de generar SALC y diagramas orbitales moleculares. El\(z\) eje se asigna para ser colineal con el eje principal, y en este caso es el mismo que el\(C_\infty\) eje (Figura\(\PageIndex{1}\)).
Paso 2. Identificar y contar los orbitales de valencia de los átomos colgantes.
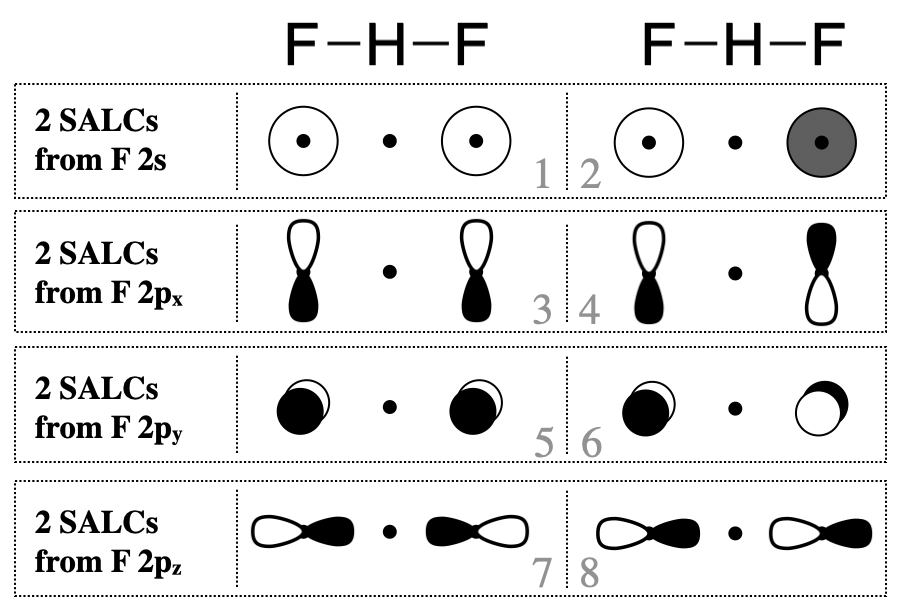
El siguiente paso es identificar los orbitales de valencia en los átomos F colgantes que formarán las SALC. En la mayoría de los casos, se deben considerar todos los orbitales de valencia. En este caso, cada uno de los átomos de flúor tiene cuatro orbitales de valencia (\(2s\)\(2p_x\),\(2p_y\), y\(2p_z\)). De estos ocho orbitales de valencia de flúor, debemos esperar ocho orbitales grupales (SALC).
3.- 5. Generar SALCS (acceso directo)
Dibujar estas SALC para esta molécula es bastante simple, y no necesitamos seguir todos los pasos para encontrar los\(\Gamma\)'s y reducirlos. Más bien, puedes proceder como si estuvieras creando orbitales moleculares enlazantes y antiligantes entre los dos átomos F, excepto que los orbitales F están separados por el átomo H. En la Figura se muestran bocetos aproximados de las ocho SALC de orbitales de valencia F\(\PageIndex{2}\).
6. Dibuja el diagrama MO combinando SALC con AO de simetría similar.
Las SALC pueden interactuar productivamente con el átomo central solo cuando la simetría es compatible. Apenas algunos de los grupos de orbitales en la Figura\(\PageIndex{2}\) poseen simetría apropiada para combinarse con la valencia orbital del átomo de hidrógeno (la H\(1s\)). En este sencillo caso, se puede decidir si los orbitales tienen simetría compatible inspeccionando visualmente las formas de los orbitales grupales. El F\(2p_y\) y\(2p_x\) los orbitales no tienen la simetría apropiada para vincularse al\(1s\) orbital H debido a que los nodos de estos orbitales discurren por el centro del\(1s\) orbital H, así podemos eliminar todas las SALC compuestas de F\(2p_x\) y\(2p_y\) (estas son las SALC numeradas 3-6 en la Figura\(\PageIndex{2}\)). Por otro lado, la F\(2s\) y\(2p_z\) los orbitales individualmente sí tienen forma y dirección apropiadas en el espacio para la interacción productiva con una\(1s\) órbita H. Sin embargo, solo las SALC donde todo el grupo tenga una simetría apropiada se combinarán con H\(1s\) para producir orbitales moleculares de unión o antiunión. Solo las SALC etiquetadas con los números 1 y 7 pueden combinarse con un\(s\) orbital en el centro del grupo. Las formas en que estas SALC son capaces de combinarse con H\(1s\) se ilustran en la Figura\(\PageIndex{3}\).
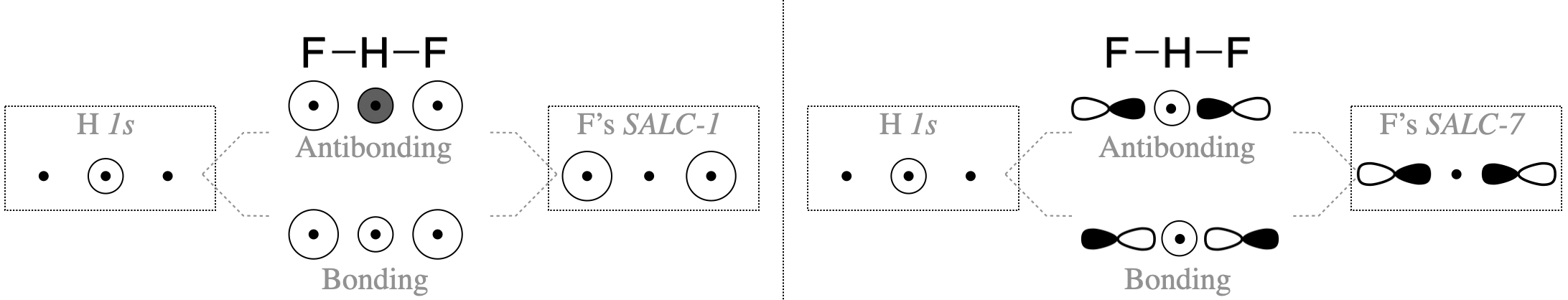
Antes de suponer que tanto SALC-1 como SALC-7 se combinarán con el\(1s\) orbital H, debemos considerar las energías de todos los orbitales atómicos. El\(2p_z\) orbital F tiene una energía potencial de\(-18.7\) eV (ver Cuadro 5.3.1). Esta es una buena coincidencia para el\(1s\) orbital H (-13.6 eV). Sin embargo, el\(2s\) orbital F tiene una energía mucho menor de\(-46.37\) eV y tendría una interacción débil con la H\(1s\).
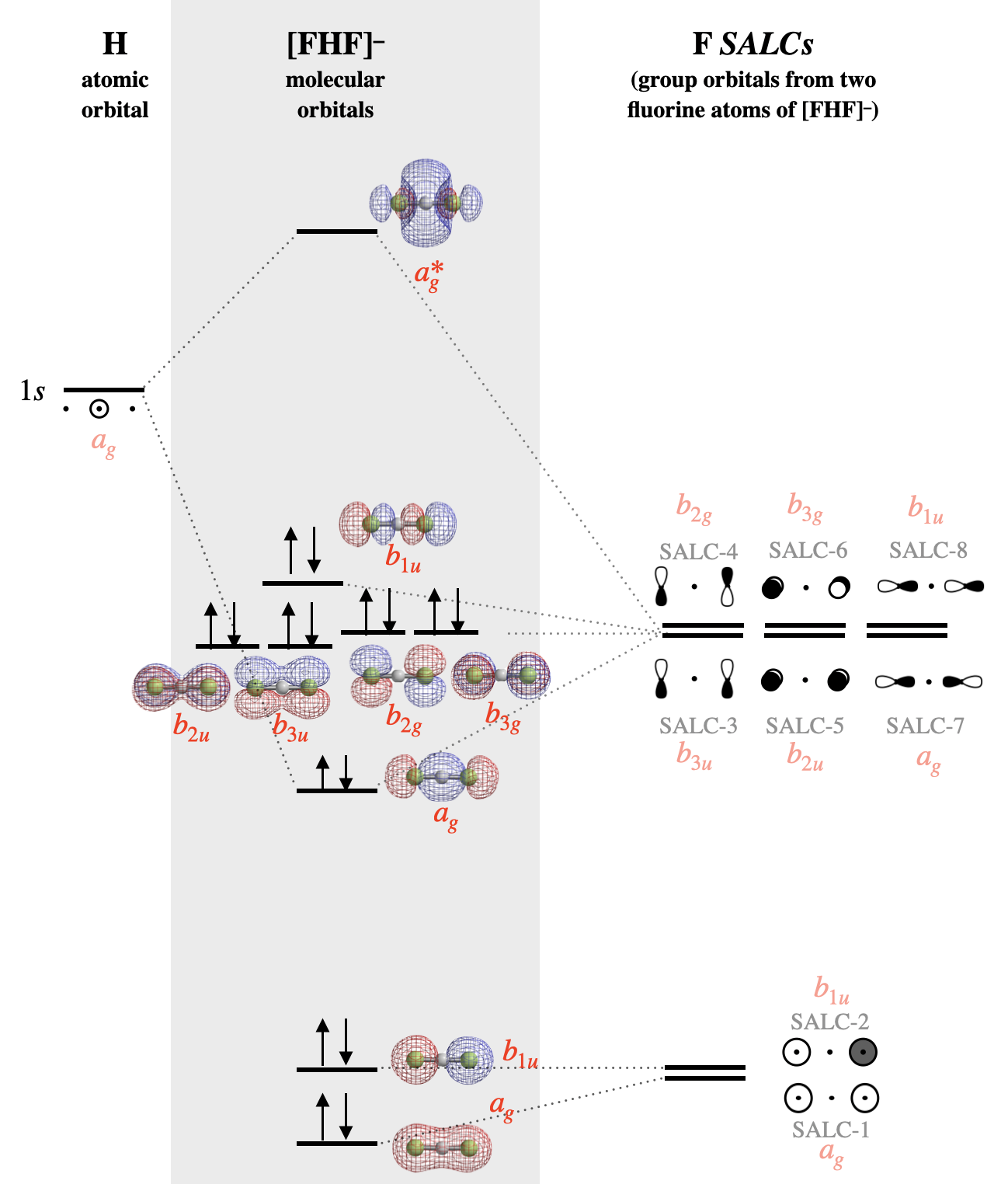
El diagrama orbital molecular para [F-H-F]\(^-\) se muestra en la Figura\(\PageIndex{4}\). Observe que a todos los orbitales atómicos, orbitales grupales (SALC) y orbitales moleculares en la Figura\(\PageIndex{4}\) se les asigna una etiqueta de simetría que corresponde a la simetría de cada elemento bajo el grupo de\(D_{2h}\) puntos. Las etiquetas orbitales moleculares corresponden a etiquetas Mulliken en minúsculas de representaciones reducibles individuales de la tabla de\(D_{2h}\) caracteres. Los símbolos en mayúsculas se utilizan para indicar simetría y representaciones irreducibles, mientras que los símbolos en minúscula se utilizan para indicar la identidad de un orbital con esa simetría. Los métodos de marcaje descritos para moléculas lineales diatómicas simples (\(\sigma, \pi\)) no son suficientes para indicar las simetrías más complejas de los orbitales moleculares en moléculas poliatómicas. El uso de símbolos de Mulliken en minúscula es la forma más rigurosa de etiquetar los orbitales. Consulte a su instructor para saber cómo debe etiquetar los orbitales para cualquier trabajo calificado.
- Haga clic aquí para obtener una versión de Figura\(\PageIndex{4}\) usando\(D_{\infty h}\) etiquetado:
-
Para grupos de alta simetría, un atajo consiste en utilizar un grupo de simetría inferior que mantenga los elementos críticos de simetría. En el caso del grupo de\(D_{\infty h}\) puntos, a menudo es suficiente utilizar la aproximación del grupo de\(D_{2h}\) puntos y la tabla de caracteres. Este es el mismo diagrama MO que se muestra arriba, pero usando las etiquetas de simetría apropiadas para la\(D_{2h}\) aproximación.
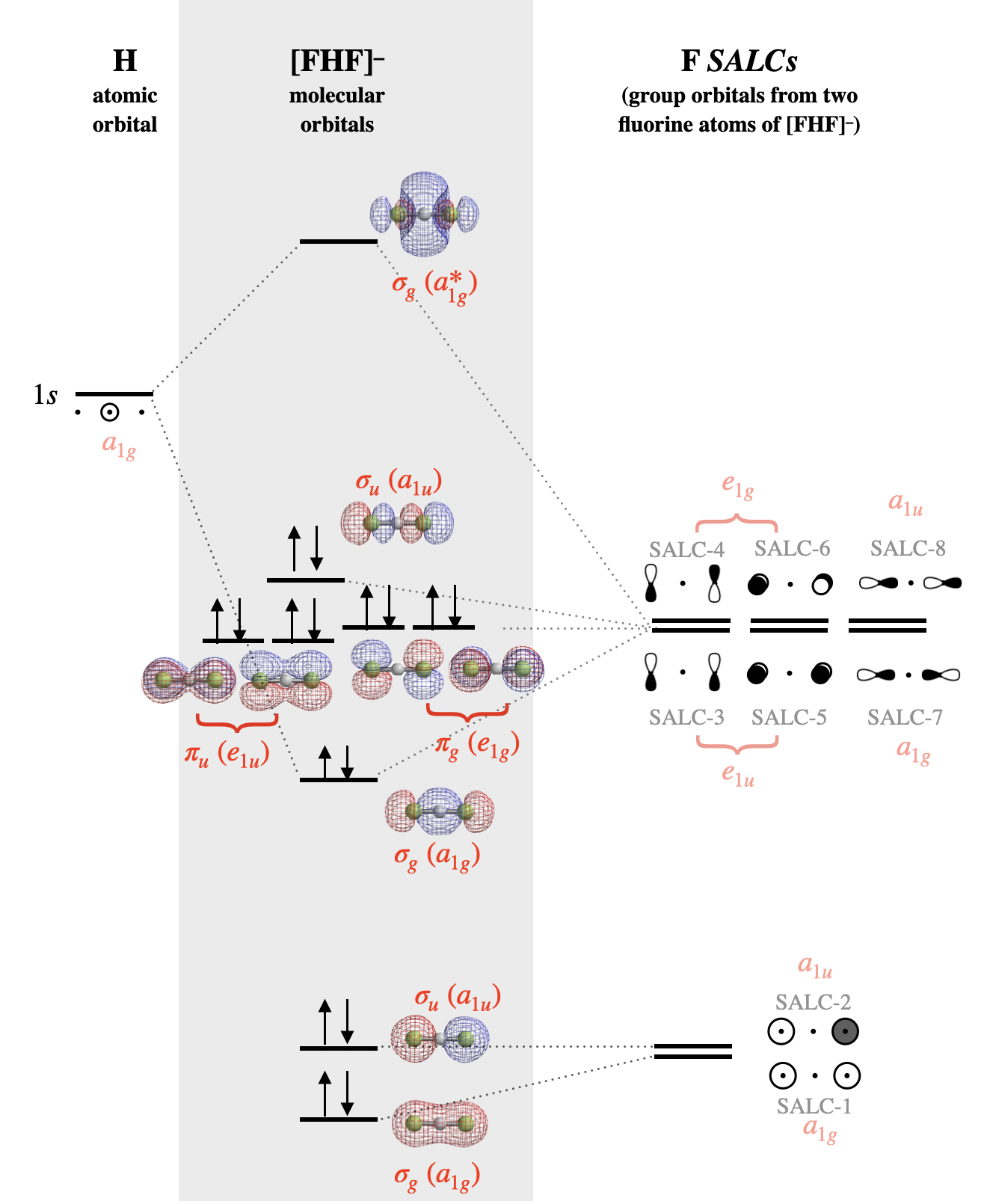
Figura alternativa\(\PageIndex{4}\): El diagrama orbital molecular para [F-H-F]\(^-\). Las superficies orbitales moleculares y los niveles de energía relativa se calcularon utilizando el software Spartan. Las SALC se etiquetan de acuerdo con los números asignados en la Figura\(\PageIndex{2}\). La simetría de cada SALC y orbital bajo el grupo de\(D_{2h}\) puntos se muestra en fuente roja. (CC-BY-NC-SA; Kathryn Haas)
Construyendo el diagrama MO
Después de identificar los orbitales atómicos y construir las SALC, colocar los orbitales atómicos de H en un lado del diagrama y todas las SALC de F en el otro lado. Los orbitales moleculares están en el centro.
Las SALC de flúor de menor energía serán las compuestas por los orbitales atómicos de flúor de menor energía; estos serían SALC-1 (\(a_{1g}\)) y SALC-2 (\(a_{1u}\)) que se construyen a partir de orbitales\(s\) atómicos de flúor. De estos dos orbitales, el que tiene cero nodos sería ligeramente menor en energía que el que tiene un nodo. Cuando estos dos orbitales forman orbitales moleculares, el SALC-1 completamente simétrico será en su mayoría sin enlace con un ligero carácter de enlace de combinación menor con el\(1s\) orbital de hidrógeno. SALC-2, sin embargo, es simétricamente incompatible con el hidrógeno\(1s\) y será un orbital verdaderamente sin enlace distribuido sobre ambos átomos de F.
Las seis SALC construidas con\(p\) orbitales de flúor tendrán mayor energía ya que los orbitales\(p\) atómicos de flúor son más altos en energía que los\(s\) orbitales (SALC-3 a SALC-8). Nuevamente, esperamos que las SALC con más nodos (SALC-4, -6, -8) tengan una energía ligeramente mayor que aquellas con menos nodos (SALC-3, -5, -7). SALC-7 formará una interacción de enlace y antienlace con el\(1s\) orbital de hidrógeno. Todos los demás SALCS son verdaderamente no adheridos, pero son orbitales no degenerados y no adheridos.
En el bifluoruro, existe una distinción importante entre la estructura de Lewis y la descripción orbital molecular de los pares solitarios. En la teoría de Lewis, los pares solitarios se localizan en átomos de flúor individuales, mientras que en la descripción orbital molecular cada par solitario se distribuye sobre ambos átomos de flúor a la vez (ver representación superficial de cada orbital molecular en la Figura\(\PageIndex{4}\)).

