5.4: Moléculas más grandes (poliatómicas)
- Page ID
- 80983
Podemos extender el método que empleamos para las moléculas diatómicas para dibujar los orbitales moleculares de moléculas poliatómicas más complicadas (moléculas con más de dos átomos). Para combinar varios átomos diferentes en un diagrama orbital molecular, agruparemos orbitales de diferentes átomos en conjuntos que coincidan con la simetría de un átomo central. Estos orbitales grupales también se denominan combinaciones lineales adaptadas a simetría (SALC). Usaremos un enfoque paso a paso para hacer esto como se resume a continuación.
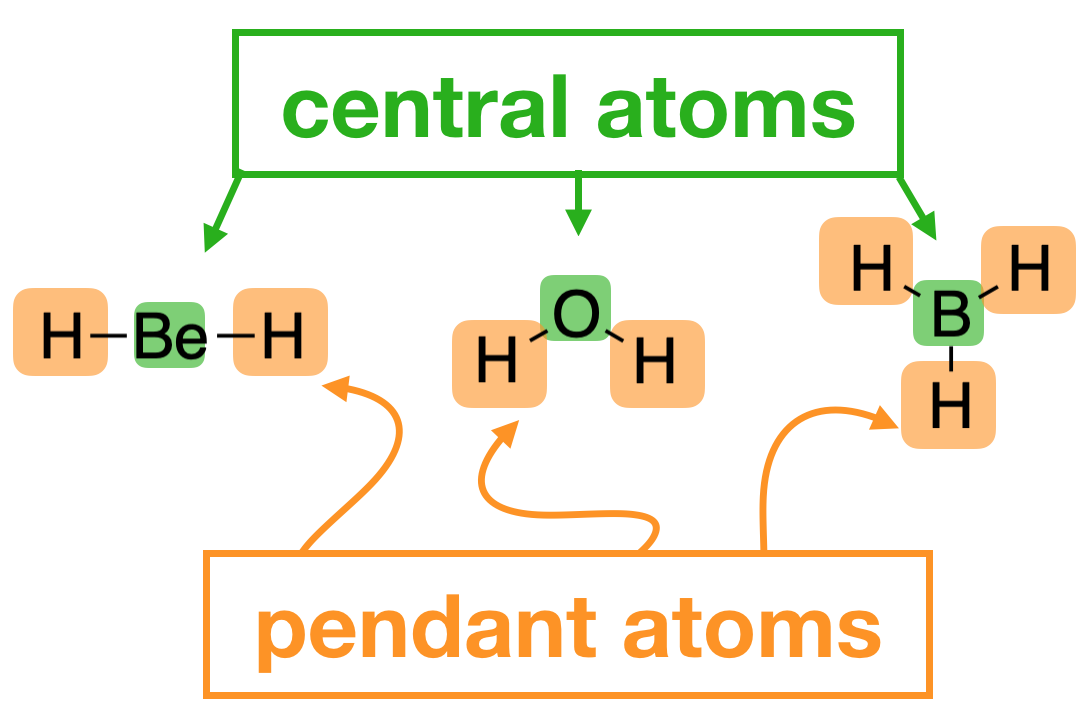 Necesitamos SALC (también conocidos como orbitales grupales) para dibujar diagramas orbitales moleculares (MO) de moléculas poliatómicas. Las SALC son grupos de orbitales en átomos colgantes. Estos grupos de orbitales coinciden mucho con la simetría de los orbitales de valencia sobre el átomo central para crear una interacción productiva. Cuando combinamos las SALC con los orbitales atómicos en el átomo central, podemos generar un diagrama MO que nos da información sobre la unión de la molécula y los estados electrónicos.
Necesitamos SALC (también conocidos como orbitales grupales) para dibujar diagramas orbitales moleculares (MO) de moléculas poliatómicas. Las SALC son grupos de orbitales en átomos colgantes. Estos grupos de orbitales coinciden mucho con la simetría de los orbitales de valencia sobre el átomo central para crear una interacción productiva. Cuando combinamos las SALC con los orbitales atómicos en el átomo central, podemos generar un diagrama MO que nos da información sobre la unión de la molécula y los estados electrónicos.
A continuación se muestra un conjunto de pasos que puede seguir para encontrar los SALC y dibujar un Diagrama MO. Cada paso se ilustrará en detalle a través de los ejemplos en las subsecciones que siguen a esta página.
- Encuentra el grupo de puntos de la molécula y asigna coordenadas cartesianas para que ese\(z\) sea el eje principal.
A veces podemos simplificar las cosas mirando sólo al grupo puntual de las orbitales pertinentes.* Solo simplificamos cuando se le indique hacerlo. - Identificar y contar los orbitales de valencia de los átomos colgantes.
¿Hay más de 1 tipo por cada átomo (ex. solo s, o s y p?) Se espera 1 SALC por cada ligando orbital. - Generar una representación reducible (\(\Gamma\)) para el grupo de orbitales atómicos colgantes usando la tabla de caracteres apropiada.
Tienes que hacer esto por cada conjunto de tipos orbitales. Si solo tienes s orbitales para cada ligando, solo necesitas generar 1 representación reducible. Si tienes\(p\) orbitales, generarías adicionales\(\Gamma\) para\(p_x\),\(p_y\), y\(p_z\). - Romper \(\Gamma\)las representaciones irreducibles en su componente de la tabla de caracteres. Obsérvese la simetría de cada representación irreducible, sus orbitales asociados y su degeneración.
- Si se le pide que esboce las formas de las SALC, determine cómo “se ven” utilizando una de las siguientes estrategias.
(a) Atajo: si las representaciones reducibles se enumeran con orbitales s, p o d en la tabla de caracteres, simplemente dibuje (... y omita los pasos b-c)
(b) Método sistemático (Operador de Proyección): Dibuja una tabla de caracteres expandida y dibuja tu molécula con cada ligando identificado por letras o números (a, b, c... o i, j, k.. . o 1,2,3... ) Determine dónde termina cada átomo/orbital colgante debajo de cada una de las operaciones de su mesa expandida. Proyecte los valores de cada representación irreducible en el gráfico que creó y luego sume los valores. Los valores positivos y negativos son orbitales de signo opuesto. - Dibuja el diagrama MO combinando SALC con AO de simetría similar. Al dibujar los niveles de energía de SALC, recuerde que cuantos más planos nodales haya en su dibujo orbital de SALC, mayor será la energía para ese orbital de SALC.
* Cuando estamos enfocados en orbitales, como en el caso de encontrar orbitales grupales y dibujar diagramas orbitales moleculares, la simetría de los orbitales es lo que nos interesa. En el caso de grupos puntuales de alta simetría\(C_{\infty v}\), como\(D_{\infty h}\) y, aunque la molécula pueda tener un\(C_\infty\) eje, los orbitales no necesariamente retienen este elemento de simetría. Por ejemplo, el\(p_x\) orbital no tendría un\(C_\infty\) eje, sino un\(C_2\) eje. Es suficiente y útil\(D_{2h}\) sustituir\(D_{\infty h}\) y\(C_{2v}\)\(C_{\infty v}\) simplificar el problema.
- 5.4.2: Dióxido de Carbono
- El dióxido de carbono es otra molécula lineal. Este ejemplo es ligeramente más complejo que el ejemplo anterior del anión bifluoruro. Mientras que el bifluoruro solo tenía un orbital de valencia a considerar en su átomo central de H (el orbital 1s), el dióxido de carbono tiene un átomo central más grande y, por lo tanto, más orbitales de valencia que interactuarán con las SALC.
- 5.4.3: H2O
- El agua es una molécula doblada, por lo que es importante recordar que las interacciones de los ligandos colgantes dependen de sus posiciones en el espacio. Se debe considerar que las posiciones de los tres átomos en el agua están esencialmente fijas en relación entre sí. El proceso para construir el diagrama orbital molecular para una molécula no lineal, como el agua, es similar al proceso para moléculas lineales. Caminaremos por los pasos a continuación para construir el diagrama orbital molecular del agua.
- 5.4.6: BF₃
- El BF3 es más complejo que los ejemplos anteriores porque es el primer caso en el que hay múltiples tipos de orbitales de valencia en los átomos colgantes. BF₃ posee orbitales s y p tanto en el átomo central como en todos los átomos colgantes. Podemos seguir los mismos pasos que tenemos anteriormente para derivar otros diagramas orbitales moleculares; sin embargo, hay una diferencia importante: trataremos cada tipo de orbital colgante como un conjunto individual de SALC.

