5.4.2: Dióxido de Carbono
- Page ID
- 81013
Construir las SALC y el diagrama orbital molecular para CO\(_2\).
El dióxido de carbono es otra molécula lineal. Este ejemplo es ligeramente más complejo que el ejemplo anterior del anión bifluoruro. Si bien el bifluoruro solo tenía un orbital de valencia a considerar en su átomo central de H (el\(1s\) orbital), el dióxido de carbono tiene un átomo central más grande y, por lo tanto, más orbitales de valencia que interactuarán con las SALC.
Pasos Preliminares
Paso 1. Encuentra el grupo de puntos de la molécula y asigna coordenadas cartesianas para que z sea el eje principal.
La\(_2\) molécula de CO es lineal y su grupo puntual es\(D_{\infty h}\). El\(z\) eje es colineal con el\(C_\infty\) eje. Utilizaremos el grupo de\(D_{2h}\) puntos como sustituto ya que las simetrías orbitales se conservan en el grupo de\(D_{2h}\) puntos.
Paso 2. Identificar y contar los orbitales de valencia de los átomos colgantes.
Cada uno de los dos átomos de oxígeno colgantes tiene cuatro orbitales de valencia;\(2s\),\(2p_x\),\(2p_y\), y\(2p_z\). Así, podemos esperar un total de ocho SALC.
Generar SALC
Las SALC para CO\(_2\) son idénticas en forma y simetría a las descritas en el ejemplo anterior para el anión bifluoruro. Pero en lugar de cortar al atajo, aquí derivaremos sistemáticamente las SALC para demostrar el proceso.
Paso 3. Generar los\(\Gamma\)'s
Utilice la tabla de\(D_{2h}\) caracteres para generar cuatro representaciones reducibles (\(\Gamma's\)); una para cada uno de los cuatro tipos de orbitales atómicos colgantes (\(s, \;p_x, \;p_y, \;p_z\)). Para cada\(s\) orbital, asigne un valor de 1 si permanece en su lugar durante la operación o cero si se mueve fuera de su lugar original. Para cada\(p\) orbital, asigne 1 si no hay cambio, -1 si permanece en su lugar pero se invierte, y 0 si se mueve fuera de su posición original. Los cuatro\(\Gamma\) se dan a continuación:
\[\begin{array}{|c|cccccccc|} \hline \bf{D_{2h}} & E & C_2(z) & C_2(y) &C_2(x) & i &\sigma(xy) & \sigma(xz) & \sigma(yz)\\ \hline \bf{\Gamma_{2s}} & 2 & 2 & 0 & 0 & 0 & 0 & 2 & 2 \\ \bf{\Gamma_{2p_x}} & 2 & -2 & 0 & 0 & 0 & 0 & 2 & -2 \\ \bf{\Gamma_{2p_y}} & 2 & -2 & 0 & 0 & 0 & 0 & -2 & 2 \\ \bf{\Gamma_{2p_z}} & 2 & 2 & 0 & 0 & 0 & 0 & 2 & 2 \\ \hline \end{array} \nonumber \]
Paso 4. Romper\(\Gamma\) en representaciones irreducibles para SALC individuales
Reducir cada uno\(\Gamma\) en sus representaciones componentes irreducibles. Hay dos estrategias que se pueden utilizar para hacer esto. La manera rápida y fácil es hacerlo “por inspección”, pero esto solo funciona bien para casos simples. La otra es mediante el uso del enfoque sistemático para\(\Gamma\) dividir a en representaciones reducibles descritas anteriormente en la sección 4.4.2 usando la siguiente fórmula:
\[\text{# of } i = \frac{1}{h}\sum(\text{# of operations in class)}\times(\chi_{\Gamma}) \times (\chi_i) \label{irs} \]
En otras palabras, el número de representaciones irreducibles de tipo \(i\)es igual a la suma del número de operaciones en\(\times\) la clase del carácter\(\Gamma_{modes}\)\(\times\) del carácter de\(i\), y esa suma se divide por el orden del grupo (\(h\)).
El uso de cualquiera de los dos enfoques da como resultado las siguientes ocho representaciones irreducibles (\(2A_{g} + 2B_{1u} + B_{2g} + B_{3u} + B_{3g} + B_{2u}\)):
\ [\ begin {array} {|c|c|cccccc|}\ hline\ bf {D_ {2h}} & E & C_2 (z) & C_2 (y) &C_2 (x) & i &\ sigma (xy) &\ sigma (xz) &\ sigma (yz)\\ hline
\ bf {\ gamma_ {2s} = A_g + B_ {1u}} &\ bf {\ gamma_ {2s}} &\ bf {2} &\ bf {2} &\ bf {0} &\ bf {0} &\ bf {0} &\ bf {0} & amp;\ bf {2} &\ bf {2}\\
& A_ {g} & 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1
& 1\\ & B_ {1u} & 1 & 1 & 1 & 1 & 1 & 1 & 1\
\ hline\\ hline
\ bf {\ gamma_ {2p_x} = B_ {2g} + B_ {3u}} &\ bf {\ gamma_ {2p_x}} &\ bf {2} &\ bf {-2} &\ bf {0} &\ bf {0} &\ bf {0} &\ bf {0} &\ bf {2}
&\ bf {-2}\\ & B_ {2g} & 1 & -1 & 1 y -1\
& B_ {3u} & 1 & -1 & -1 & 1 & -1 & 1 & 1 & -1\
\ hline\\\ hline
\ bf {\ Gamma_ {2p_y} =B_ {3g} +B_ {2u}} &\ bf {\ Gamma_ {2p_y}} &\ bf2 &\ bf-2 &\ bf0 &\ bf0 &\ bf0 &\ bf0 &\ bf0 &\ bf-2 &\ bf2\
& B_ {3g} y 1 y -1 y -1 y 1 y 1 y -1 & -1 & 1\\
& B_ {2u} & 1 & -1 & -1 & -1 & 1 & 1 & -1 & 1 & -1 & 1
\\ hline
\\ hline\ bf {\ Gamma_ {2p_z} = A_ {g} +B_ {1u}} &\ bf {\ Gamma_ {2p_z}} &\ bf {2} &\ bf {0} &\ bf {0} &\ bf {0} & amp;\ bf {0} &\ bf {2} &\ bf {2}\\
& A_ {g} & 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1\\
& B_ {1u} & 1 & 1 & 1 & -1 & -1 & 1 & 1 & 1 & 1\\ hline\ end {array}\ nonumber\]
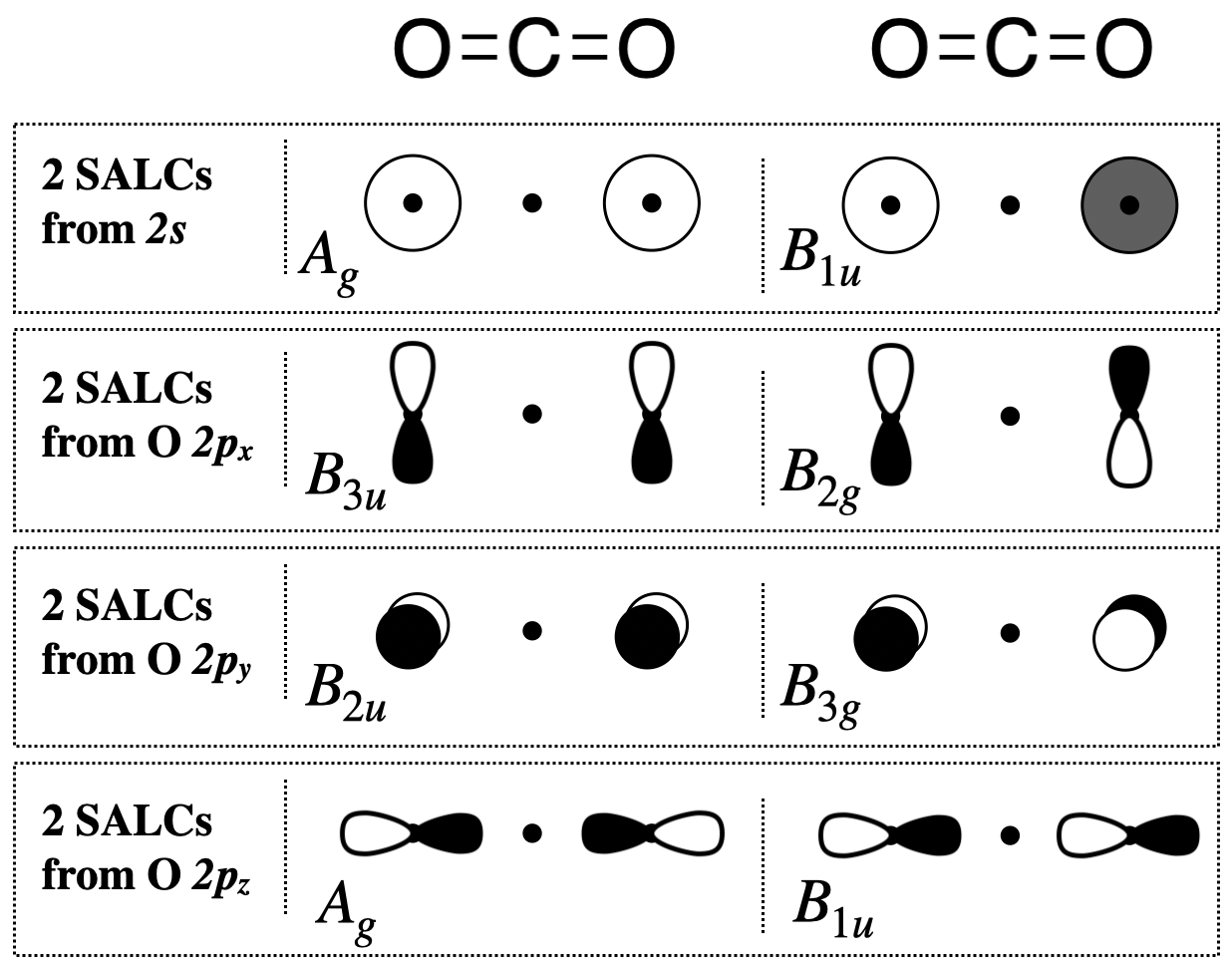
Paso 5. Esbozar las SALC
Del proceso sistemático anterior, se han encontrado las simetrías (las representaciones irreducibles) de las ocho SALC bajo el grupo de\(D_{2h}\) puntos. Para bosquejar el SALC que corresponde a cada representación irreducible, nuevamente usamos la tabla de\(D_{2h}\) caracteres, y específicamente las funciones listadas en las columnas del lado derecho de la tabla.
Dos\(A_g\) SALC (una de\(s\) y otra de\(p_z\)): Las\(A_g\) SALC son cada una individualmente degeneradas y simétricas con respecto tanto al eje principal (\(z\)) como al centro de inversión (\(i\)) (basado en su Etiqueta Mulliken). Podemos observar las funciones en la tabla de\(D_{2h}\) caracteres que corresponden\(A_g\) y ver que es completamente simétrica bajo el grupo (porque la combinación de\(x^2,y^2,z^2\) muestra que es totalmente simétrica). Esta sería la misma simetría que un\(s\) orbital sobre el átomo central. A partir de esta información, sabemos que estas SALC deben tener simetría compatible con un\(s\) orbital en el átomo central, y podemos dibujar las dos\(A_g\) SALC mostradas en la Figura\(\PageIndex{2}\).
Dos\(B_{1u}\) SALC (una de\(s\) y otra de\(p_z\)): La Etiqueta Mulliken nos dice que las\(B_{1u}\) SALC son cada una antisimétricas con respecto tanto al eje principal como al centro de inversión. La función,\(z\), apareciendo con\(B_{1u}\) en la tabla de caracteres nos dice que estas SALC tienen la misma simetría que el\(z\) eje, o un\(p_z\) orbital en el átomo central. A partir de esta información, sabemos que estas dos SALC deben ser compatibles con un\(p_z\) orbital en el átomo central, y podemos dibujar las dos\(B_{1u}\) SALC mostradas en la Figura\(\PageIndex{2}\).
Todas las demás SALC que se muestran a continuación se derivan utilizando una estrategia similar a la de los dos casos descritos anteriormente.
Dibuja el diagrama MO para\(CO_2\)
Paso 6. Combina SALC con AO de simetría similar.
Primero identificamos los orbitales de valencia sobre el carbono: hay cuatro incluyendo\(2s\),\(2p_x\),\(2p_y\), y\(2p_z\). Ahora identificamos la simetría de cada uno usando la tabla de\(D_{2h}\) caracteres. La simetría de un\(s\) orbital central corresponde a la combinación de funciones\(x^2\),\(y^2\), y\(z^2\) en la tabla de caracteres; esto es\(A_g\). El\(p_z\) orbital corresponde a la simetría de la función lineal\(z\) en la tabla de caracteres; esto es\(B_{1u}\). Y así sucesivamente... A continuación se listan las simetrías de los orbitales de valencia C. \[2s =A_g \\ 2p_x = B_{3u} \\ 2p_y = B_{2u} \\ 2p_z = B_{1u} \nonumber \]
Ahora que hemos identificado las simetrías de las ocho SALC de oxígeno y los cuatro orbitales de valencia sobre el carbono, sabemos qué orbitales atómicos y SALC pueden combinar en base a simetrías compatibles. También necesitamos conocer los niveles relativos de energía orbital para poder predecir la fuerza relativa de las interacciones orbitales. Las energías de ionización orbital se enumeran en la Sección 5.3.
Con conocimiento tanto de simetrías orbitales como de energías, podemos construir el diagrama orbital molecular. El átomo de carbono va en un lado del diagrama mientras que las SALC de oxígeno se dibujan en el lado opuesto. Los orbitales moleculares se dibujan en la columna central del diagrama:
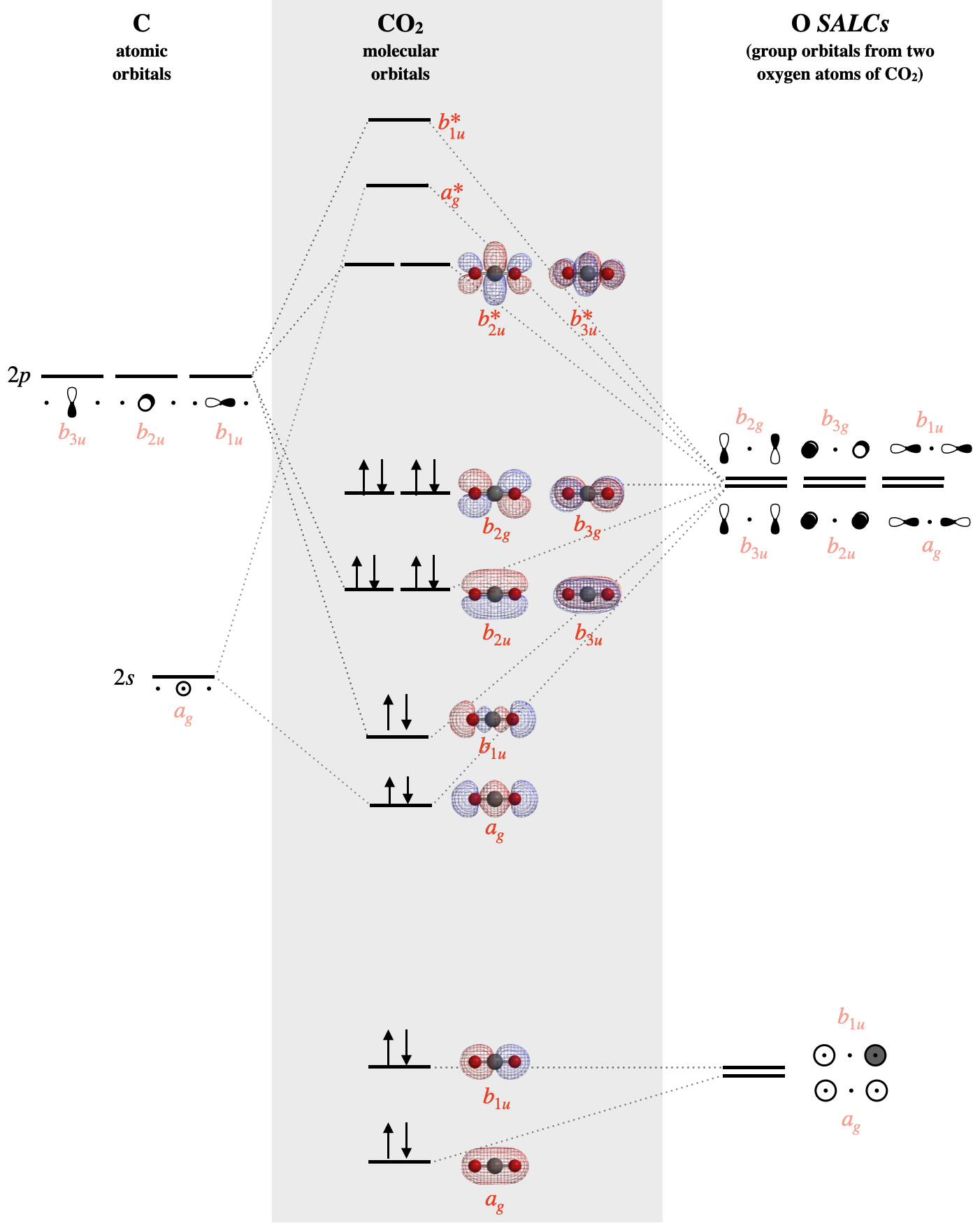
Las SALC en el lado derecho del diagrama anterior se construyen a partir de grupos de los orbitales\(2s\) atómicos de oxígeno, o los orbitales\(2p\) atómicos de oxígeno. Cada SALC se combinará con los orbitales atómicos de carbono que tienen simetría compatible; pero la fuerza de la interacción depende de sus energías relativas. Los orbitales atómicos de valencia individuales de oxígeno tienen energías de\(-32.36 eV\) (\(2s\)) y\(-15.87 eV\) (\(2p\)), mientras que los orbitales de valencia del carbono tienen energías de\(-19.47 eV\) (\(2s\)) y\(-10.66 eV\) (\(2p\)). Los\(2s\) orbitales del oxígeno son mucho más bajos en energía (\(-32.36 eV\)) que todos los demás orbitales de valencia, por lo que debemos esperar que los orbitales moleculares que se construyen a partir de estos oxígeno\(2s\) sean en su mayoría sin unión. Estos orbitales en su mayoría no ligantes son los\(b_{1g}\) orbitales\(a_{1g}\) y que se muestran en la parte inferior de la Figura\(\PageIndex{3}\). El\(a_g\) orbital es menor en energía que el\(b_{1u}\) debido a la ligera mezcla con otros orbitales de\(a_g\) simetría.
Los orbitales de unión de\(CO_2\) incluyen dos orbitales\(sigma\) moleculares de\(a_g\) y\(b_{1u}\) simetría y dos orbitales\(\pi\) moleculares de\(b_{2u}\) y\(b_{3u}\) simetría. Cada uno de estos orbitales moleculares de unión posee un compañero antienlace de mayor energía. Las\(b_{2g}\) y las\(b_{3g}\) SALC que se forman a partir de oxígeno\(2p_x\) y\(2p_y\) orbitales no tienen coincidencia compatible con orbitales de valencia de carbono; así forman orbitales dos\(b_{2g}\) y\(b_{3g}\) moleculares, que son verdaderamente no vinculantes y en su mayoría oxígeno en carácter. Aún así, observe que cada orbital se extiende a través de ambos átomos de oxígeno a la vez, y nuevamente vemos que cada par de electrones no ligantes en el HOMO es muy diferente en la teoría orbital molecular en comparación con la teoría de Lewis. Cada par sin enlace se distribuye sobre ambos átomos de oxígeno a la vez en la teoría orbital molecular, mientras que en la teoría de Lewis cada par solitario se aísla a un átomo o a enlaces localizados unidos a ese átomo.


