5.4.6: BF₃
- Page ID
- 81022
El caso del trifluoruro de boro (\(\ce{BF_3}\)) es un ejemplo de una molécula con una capa más de complejidad que los otros ejemplos que hemos visto en secciones anteriores de este capítulo. (\(\ce{BF_3}\)) es más complejo que los ejemplos anteriores porque es el primer caso en el que hay múltiples tipos de orbitales de valencia en los átomos colgantes. (\(\ce{BF_3}\)) posee\(s\) y\(p\) orbitan tanto en el átomo central como en todos los átomos colgantes. Podemos seguir los mismos pasos que tenemos anteriormente para derivar otros diagramas orbitales moleculares; sin embargo, hay una diferencia importante: trataremos cada tipo de orbital colgante como un conjunto individual de SALC.
Paso 1. Encuentra el grupo de puntos de la molécula y asigna coordenadas cartesianas para que z sea el eje principal.
La\(_3\) molécula BH es plana trigonal, y su grupo puntual es\(D_{3h}\). El\(z\) eje es colineal con el eje principal, el\(C_3\) eje.
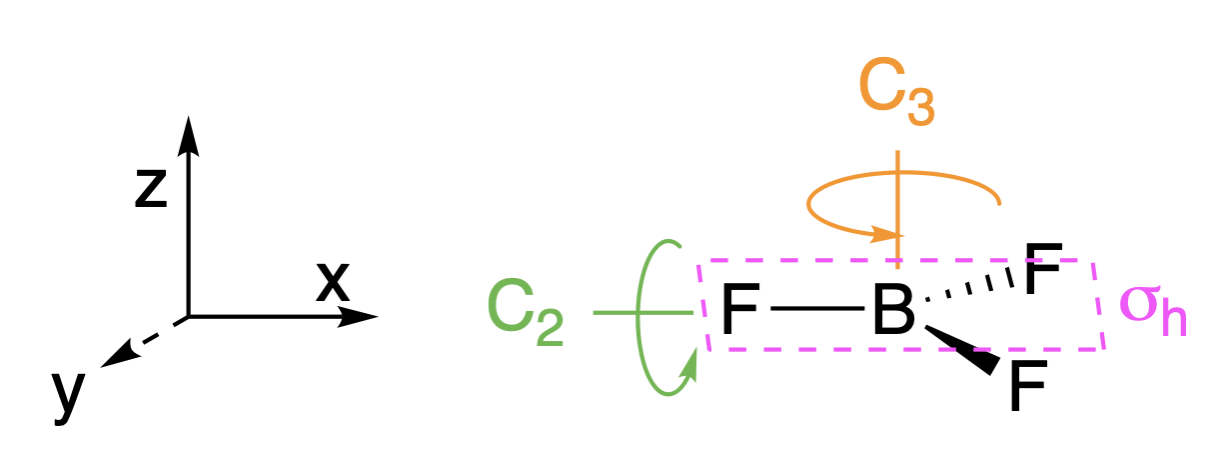
Paso 2. Identificar y contar los orbitales de valencia de los átomos colgantes.
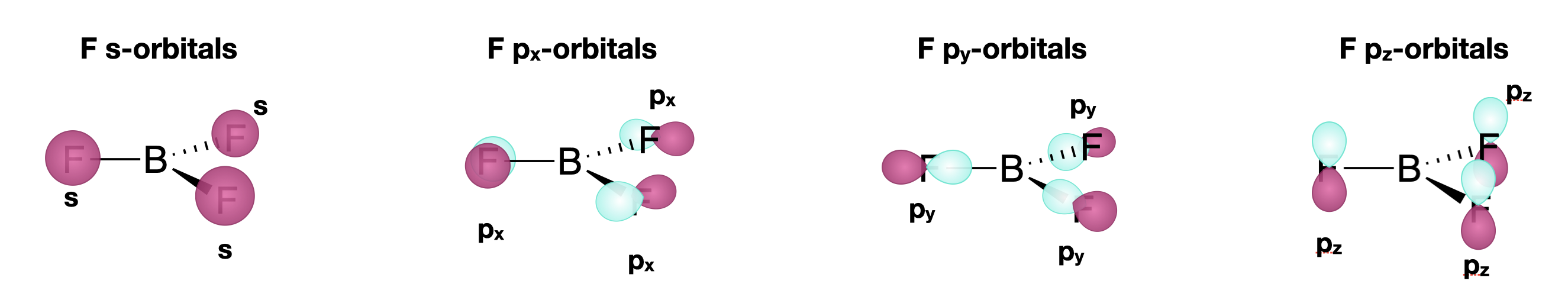
Cada uno de los tres átomos de flúor colgantes tiene cuatro orbitales de valencia: uno\(2s\) y tres\(2p\) orbitales. Así, podemos esperar un total de doce SALC de los tres átomos. Sin embargo, trataremos cada tipo de orbital de los átomos F como su propio conjunto; cada uno tendrá su propio conjunto de coordenadas, con el\(y\) eje a lo largo del enlace M-L. Así esperamos lo siguiente:
- Un conjunto de\(2s\) SALC: hay un orbital de 2s en cada uno de los tres átomos. Este conjunto contará con tres SALC.
- Un conjunto de\(2p_x\) SALC: hay un\(2p_x\) orbital en cada uno de los tres átomos. Cada uno de estos orbitales individuales es perpendicular al enlace M-L y coplanar con la molécula. Este conjunto contará con tres SALC.
- Un conjunto de\(2p_y\) SALC: hay un\(2p_y\) orbital en cada uno de los tres átomos. Cada uno de estos orbitales individuales es colineal con el enlace M-L. Este conjunto contará con tres SALC.
- Un conjunto de\(2p_z\) SALC: hay un\(2p_z\) orbital en cada uno de los tres átomos. Cada uno de estos orbitales individuales es perpendicular al enlace M-L y paralelo al eje principal de la molécula. Este conjunto contará con tres SALC.
Paso 3. Generar los\(\Gamma\)'s para cada conjunto de SALC
Usa la tabla de\(D_{3h}\) caracteres para generar una representación reducible (\(\Gamma\)) para cada uno de los cuatro conjuntos de orbitales atómicos colgantes que se muestran en la Figura\(\PageIndex{2}\); en este caso necesitamos cuatro\(\Gamma\) porque hay cuatro tipos de valencia orbital (la\(s, p_x, p_y, p_z\)).
- Para el conjunto de\(s\) orbitales: realizar la operación para cada clase en la tabla de caracteres. A cada\(s\) orbital se le asigna un valor dependiendo de si se mueve o no: asigne un valor de 1 si permanece en su lugar durante la operación, o 0 (cero) si se mueve fuera de su lugar original.
- para cada conjunto de\(p\) orbitales: Ahora hay fases (signos de la función de onda), por lo que es posible un valor negativo. Asignar un valor de 1 a cada\(p\) orbital si permanece en su lugar y en fase durante la operación; asignar un -1 si la posición del átomo permanece, mientras que la fase del orbital se invierte (el lóbulo positivo se mueve a la posición del lóbulo negativo y viceversa); asigna un 0 si se mueve fuera de su original posición.
El\(\Gamma\) para cada tipo se da a continuación:
\ [\ begin {array} {|c|cccccc|}\ hline\ bf {D_ {3h}} & E & 2C_3 & 3C_2 &\ sigma_h & 2S_3 & 3\ sigma_v
\\ hline\ bf {\ Gamma_ {2s}} & 3 & 0 & 1 & 0 & 1\
\ bf {\ Gamma_ {2p_x}} & 3 & 0 & -1 & 3 & 0 & -1\\
\ bf {\ Gamma_ {2p_y}} & 3 & 0 & 3 & 0 & 1\\
\ bf {\ gamma_ {2p_z}} & 3 & 0 & -1 & -3 & 0 & 1\
\ hline\ end {array}\ nonumber\]
Paso 4. Romper\(\Gamma\) en representaciones irreducibles para SALC individuales
Reducir cada uno\(\Gamma\) en sus representaciones componentes irreducibles. Utilizando cualquiera de los procesos descritos anteriormente, encontramos que cada una de las\(\Gamma\) reduce a dos representaciones irreducibles bajo el grupo de\(D_{3h}\) puntos; en cada caso una es degenerada individualmente (\(A\)) y la otra doblemente degenerada (\(E\)). Esto equivale a tres SALC para cada uno\(\Gamma\) (tipo orbital) y un total de doce SALC. ¡Esto debería darnos confianza! De hecho estábamos esperando 12 SALC porque encontramos que había doce orbitales atómicos colgantes para empezar.
\ [\ begin {array} {|c|cccccc|}\ hline {D_ {3h}} & E & 2C_3 & 3C_2 &\ sigma_h & 2S_3 & 3\ sigma_v\\ hline\ bf {
\ gamma_ {2s}} &\ bf 3 &\ bf 0 &\ bf 1 &\ bf 3 &\ bf 0 &\ bf 1\\
A_ {1} '& 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1\\
E' & 2 & -1 & 0 & 2 & -1 & 0\
\ hline\ end {array}\ nonumber\]
\ [\ begin {array} {|c|cccccc|}\ hline {D_ {3h}} & E & 2C_3 & 3C_2 &\ sigma_h & 2S_3 & 3\ sigma_v\\ hline\ bf {
\ gamma_ {2p_x}} &\ bf 3 &\ bf 0 &\ bf -1 &\ bf 3 &\ bf 0 &\ bf 0 &\ bf bf -1\\
A_ {2} '& 1 & 1 & -1 & 1 & 1 & -1 & -1\
E' & 2 & -1 & 0 & 2 & -1 & 0\
\ hline\ end {array}\ nonumber\]
\ [\ begin {array} {|c|cccccc|}\ hline {D_ {3h}} & E & 2C_3 & 3C_2 &\ sigma_h & 2S_3 & 3\ sigma_v\\ hline\ bf {
\ gamma_ {2p_y}} &\ bf 3 &\ bf 0 &\ bf 1 &\ bf 3 &\ bf 0 &\ bf 0 &\ bf bf 1\\
A_ {1} '& 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1\\
E' & 2 & -1 & 0 & 2 & -1 & 0\
\ hline\ end {array}\ nonumber\]
\ [\ begin {array} {|c|cccccc|}\ hline {D_ {3h}} & E & 2C_3 & 3C_2 &\ sigma_h & 2S_3 & 3\ sigma_v\\ hline
\ bf {\ gamma_ {2p_z}} &\ bf 3 &\ bf 0 &\ bf -1 &\ bf -3 &\ bf 0 &\ bf 0 &\ bf 0 &\ bf bf 1\\
A_ {2}” & 1 & 1 & -1 & -1 & -1 & 1 & 1\\
E” & 2 & -1 & 0 & -2 & 1 & 0\
\ hline\ end {array}\ nonumber\]
Paso 5: Esbozar las SALC
Nos saltaremos este paso por ahora para hacer este problema más sencillo.
Paso 6: Dibuja el diagrama MO combinando SALC con AO de simetría similar.
Ahora conocemos las simetrías de diferentes SALC orbitales colgantes -y es útil que también conozcamos sus energías relativas, y las energías de los orbitales de valencia en el átomo central de boro. Podemos hacer predicciones basadas en tendencias periódicas, o podemos usar una tabla de energías de ionización como guía. Las simetrías del boro\(2s\) y\(2p\) los orbitales se pueden encontrar en la tabla de\(D_{3h}\) caracteres.

