6.3.1: Concepto Brønsted-Lowry
- Page ID
- 81267
El concepto ácido-base de Brønsted-Lowry
El concepto ácido-base de Brønsted-Lowry supera la incapacidad del sistema Arrhenius para describir las reacciones que tienen lugar fuera de la solución acuosa moviendo el foco lejos de la solución y sobre el ácido y la base mismos. Lo hace redefiniendo la reactividad ácido-base como implicando la transferencia de un ión hidrógeno\(H^+\),, entre un ácido y una base. Específicamente, un ácido de Brønsted es una sustancia que pierde un\(H^+\) ion donándolo a una base. Esto significa que una base de Brønsted se define como una sustancia que acepta\(H^+\) de un ácido cuando reacciona.
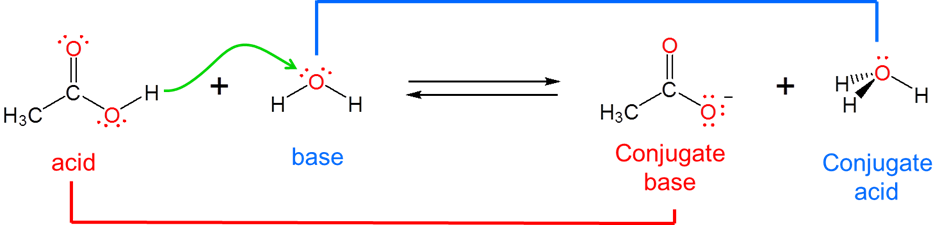
Debido a que el concepto de Brønsted-Lowry se refiere a la transferencia de\(H^+\) iones más que a la creación de una especie química en particular, es capaz de manejar una amplia gama de conceptos ácido-base. De hecho, desde el punto de vista del concepto Brønsted-Lowry, los ácidos y bases de Arrhenius son solo un caso especial que involucra la donación y aceptación de iones de hidrógeno que involucran agua. Los ácidos de Arrhenius donan\(H^+\) iones al agua, que actúa como base de Brønsted al aceptarla para dar\(H_3O^+\):
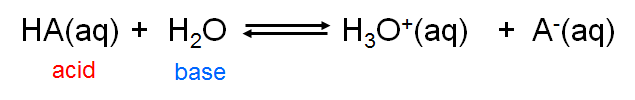 \[\label{ 6.3.1} \]
\[\label{ 6.3.1} \]
De igual manera, las bases de Arrhenius actúan como bases de Brønsted al aceptar un ion hidrógeno del agua ácida de Brønsted:
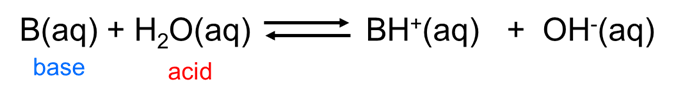 \[ \nonumber \]
\[ \nonumber \]
De esta manera se puede ver que los ácidos y bases de Arrhenius se definen en términos de su causa de que los iones de hidrógeno sean donados y abstraídos del agua, respectivamente, mientras que los ácidos y bases de Brønsted se definen en términos de su capacidad para donar y aceptar iones de hidrógeno hacia y desde cualquier cosa.
Debido a que el concepto de Brønsted-Lowry puede manejar cualquier tipo de transferencia de iones de hidrógeno, se adapta fácilmente a muchas reacciones que la teoría de Arrhenius no puede, incluidas las que tienen lugar fuera del agua, como la reacción entre el ácido clorhídrico gaseoso y el amoníaco:
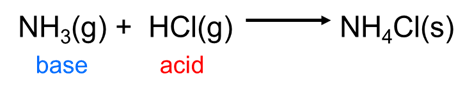 \[ \nonumber \]
\[ \nonumber \]
La clasificación de los ácidos como fuertes o débiles generalmente se refiere a su capacidad para donar o abstraer iones de hidrógeno hacia o desde el agua para dar\(H_3O^+\) y\(OH^-\), respectivamente, es decir, su acidez y basicidad de Arrhenius. Sin embargo, los ácidos y bases pueden clasificarse como fuertes y débiles bajo la definición de Brønsted-Lowry en función de si transfieren completamente o aceptan iones de hidrógeno; es solo que en este caso es importante especificar las condiciones bajo las cuales un ácido o base dado actúa fuerte o débil. Por ejemplo, el ácido acético actúa como un ácido débil en el agua pero es un ácido fuerte en la trietilamina, ya que en este último caso transfiere completamente un ión hidrógeno a trietilamina para dar acetato de trietilamonio. Alternativamente, la acidez o basicidad de un compuesto puede especificarse usando una escala termodinámica como la acidez de Hammett.
Ácidos y Bases Conjugados
Al redefinir ácidos y bases en términos de donación y aceptación de iones de hidrógeno, el sistema Brønsted-Lowry facilita reconocer que cuando un ácido pierde su ión hidrógeno se convierte en una sustancia capaz de volver a recibirlo, es decir, una base. Consideremos, por ejemplo, la disociación base del amoníaco en agua. Cuando el amoníaco actúa como una base de Brønsted y recibe un ion hidrógeno del agua, se forman iones amonio e hidróxido:
 \[ \nonumber \]
\[ \nonumber \]
El ion amonio es en sí mismo un ácido débil que puede sufrir disociación:
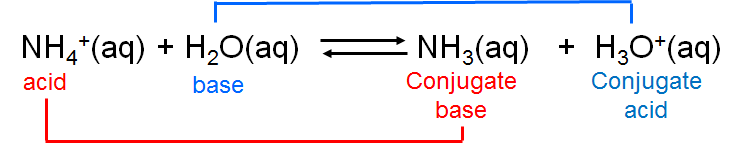 \[ \nonumber \]
\[ \nonumber \]
En este caso el amoníaco y el ion amonio son conjugados ácido-base. En general, se dice que los ácidos y bases que difieren en un solo ión de hidrógeno ionizable son conjugados entre sí.
Las fuerzas de los conjugados varían recíprocamente entre sí, por lo que cuanto más fuerte es el ácido, más débil es la base y viceversa. Por ejemplo, en el agua, el ácido acético actúa como un ácido débil de Brønsted:
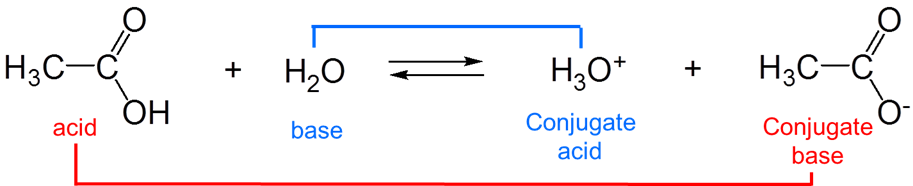 \[ \nonumber \]
\[ \nonumber \]
y la base conjugada del ácido acético, el acetato, actúa como una base débil de Brønsted.
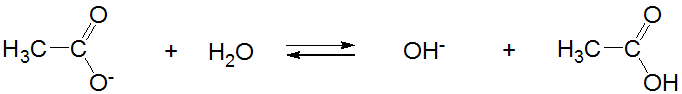 \[ \nonumber \]
\[ \nonumber \]
Sin embargo, en amoníaco líquido el ácido acético actúa como un ácido fuerte de Brønsted:
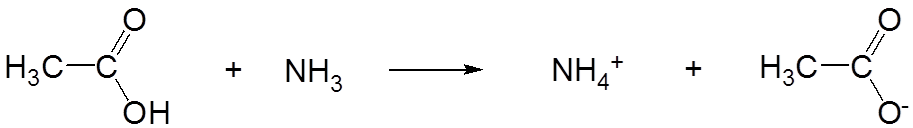 \[ \nonumber \]
\[ \nonumber \]
mientras que su base conjugada, el acetato, es neutra.
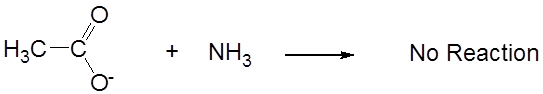 \[ \nonumber \]
\[ \nonumber \]
La relación recíproca entre las fortalezas de los ácidos y sus bases conjugadas tiene varias consecuencias:
- En condiciones en las que un ácido o base actúa como un ácido o base débil, su conjugado también actúa como débil. Por el contrario, cuando un ácido o base actúa como un ácido o base fuerte su conjugado actúa como una especie neutra.
- Cuando un ácido y una base de Brønsted reaccionan entre sí, el equilibrio favorece la formación del par ácido-base más débil. Es por ello que la reacción ácido-base entre ácido acético y amoníaco en amoníaco líquido procedió a dar el ion amonio ácido débil y acetato neutro. Esta consecuencia es particularmente importante para comprender el comportamiento de ácidos y bases en disolventes no acuosos, como se ilustra en el siguiente ejemplo.
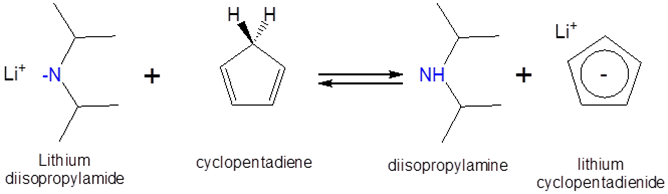
¿Se puede usar una solución de diisopropilamida de litio en heptano para formar ciclopentadienuro de litio? Los\(pK_a\) de ciclopentadieno y diisopropilamina son ~15 y 40, respectivamente, y la reacción propuesta es la siguiente:
- Solución:
-
Dado que el ciclopentadieno es un ácido más fuerte que la diisopropilamina (cuanto más fuerte sea el ácido, menor sea\(pK_a\)) el equilibrio favorecerá la protonación de la diisopropilamina por el ciclopentadieno. En consecuencia, la adición de una solución de diisopropilamida de litio en heptano a ciclopentadieno monomérico debería dar ciclopentadienuro de litio.

