6.5.1: Química Host-Invitado e Interacciones de apilamiento π-π
- Page ID
- 81242
Esta sección evita la discusión de temas relacionados con la química ácido-base y se entrega a un breve aparte sobre un tipo de interacción intermolecular que se utiliza en la química huésped-huésped. En esta sección se describirá primero el concepto de química hospedador-huésped, luego se describirán los tipos de interacciones y principios de diseño que se pueden utilizar para promover las interacciones hospedador-huésped, y finalmente concluirá con una discusión sobre las\(\pi-\pi\) interacciones.
En Host-Guest Chemistry una molécula grande o material de red se une no covalentemente a una molécula más pequeña en un bolsillo de unión.
En la química huésped-huésped, una molécula grande o un huésped de red utiliza interacciones no covalentes para unirse a una molécula huésped más pequeña en un bolsillo de unión. Esquemáticamente esta interacción a menudo se representa como:
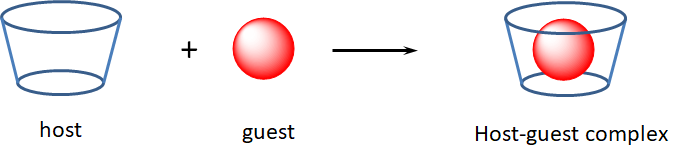
La unión huésped-huésped es análoga a la forma en que ocurren muchas interacciones biomolécula-sustrato, por ejemplo, a cómo los anticuerpos se unen a antígenos y muchas enzimas se unen a sus sustratos. De esta manera se puede decir que muchos sistemas biomoleculares forman complejos huésped-huésped, aunque esa terminología no se usa a menudo en el campo de la bioquímica. Por lo general, cuando alguien se refiere a un complejo huésped-huésped en química inorgánica u orgánica se refiere a jaulas orgánicas o metal-orgánicas que unen pequeños orgánicos. Un ejemplo sencillo implica la unión de buckminsterfullereno, C 60 ,, por calix- [5] -arenos.
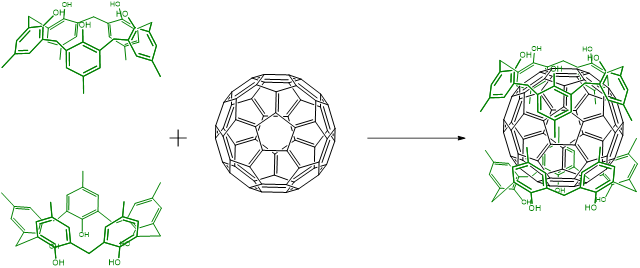
En principio, cualquier tipo de interacción intermolecular puede mantener unido un complejo anfitrión-huésped, pero cualquiera que elija, ayuda a prestar atención a algunos principios de diseño.
Los tipos de interacciones que se utilizan para efectuar la unión huésped-huésped son diversos. En el ejemplo de fullereno-calixareno anterior, las interacciones implicarán principalmente el\(\pi\) apilamiento de interacciones entre los anillos aromáticos de los calixarenos y los del fullereno. Otros sistemas host-guest utilizan alguna combinación de:
- enlaces de hidrógeno
- enlaces halógenos
- interacciones iónicas mediante las cuales los grupos cargados del anfitrión atraen a grupos de carga opuesta del huésped
- interacciones ión-dipolo mediante las cuales los grupos cargados en un componente interactúan con el extremo apropiado de un grupo polar en el otro.
- interacciones dipolo-dipolo
- catión-\(\pi\), X-H-\(\pi\), e interacciones similares en las que cargas positivas totales o parciales inducen un dipolo complementario en un\(\pi\) sistema.
- \(\pi - \pi\)interacciones
- fuerzas de dispersión
Muchos sistemas efectivos de host-invitado emplean algunos principios de diseño para favorecer la vinculación host-invitado. Estos principios incluyen:
- preorganización del host: cuando los anfitriones conformacionalmente flexibles (es decir, disquetes) unen a un invitado, el anfitrión se ajustará a la forma del huésped y así se volverá más rígido. En otras palabras, cuando un disquete se une a un invitado, se pierde mucha entropía conformacional. Esto hará que el\(\Delta S\) término para la energía libre vinculante sea más negativo y tiende a desfavorecer la vinculación host-invitado. Para evitar esto, los hospedadores efectivos minimizan la pérdida de entropía conformacional en la unión. Esto generalmente se hace limitando la entropía conformacional del huésped para comenzar fusionando múltiples sitios de unión en un anillo macrocíclico, jaula o agrupación. Cuanto más rígidos sean estos, mejor.
- complementariedad del tamaño y la forma del hospedador-huésped - esto simplemente significa que los complejos se forman cuando el bolsillo o cavidad de unión del anfitrión es complementario a la del huésped. Específicamente, su tamaño y forma se ajustan al huésped y permiten interacciones estrechas (es decir, el huésped no traquetea por dentro). Además, cualquier sitio de unión cargado, polar o cualquier dirección en el huésped está dispuesto de tal manera que interactúa favorablemente con sitios complementarios en el huésped.
- preferencia de desolvación de huéspedes a través de interacciones preferenciales solvente-solvent* -\(\pi - \pi\) interacciones como las que mantienen unido el complejo calixareno-fullereno son débiles en comparación con interacciones más fuertes como enlaces de hidrógeno o incluso enlaces de agua (un tipo de X-H\(\pi\)\(\pi\) unión. Sin embargo, los enlaces de hidrógeno agua-agua y otras interacciones entre los sistemas capaces de H-Bond-y los sistemas polares son aún más fuertes. Esto significa que las interacciones agua-agua favorables deben romperse cuando un huésped o huésped no polar se disuelve en una solución muy polar o iónica. Cada dipolo inducido por dipolo o\(\pi\) interacción X-H que tiene lugar es una oportunidad perdida para que las moléculas de soluto se involucren en interacciones de enlaces de hidrógeno. Así, cuando se mezcla una solución acuosa de un huésped no polar y un huésped, las partes no polares de estas moléculas tenderán a pegarse entre sí, liberando agua u otras moléculas polares para interactuar entre sí a medida que lo hacen. **
\(\pi - \pi\)las interacciones ocurren cuando\(\pi\) los sistemas aromáticos se unen cara a cara entre sí e implican una combinación de dispersión e interacciones dipolares inducidas por dipolo.
Dado que la distribución de electrones en los sistemas aromáticos se distorsiona con relativa facilidad, pueden participar en una dispersión atípicamente fuerte y en interacciones dipolares inducidas por dipolos llamadas interacciones de \(\pi - \pi\)apilamiento. Estas interacciones se llaman así porque ocurren cuando los planos de los anillos aromáticos se apilan paralelos entre sí. Este apilamiento paralelo puede ocurrir en una disposición de apilamiento sándwich o desplazada.
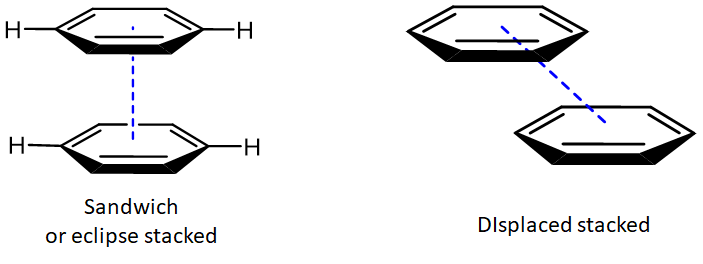
En cualquier caso, los anillos pueden ser atraídos entre sí por una combinación de dispersión e interacciones electrostáticas. Estos últimos dependen de los parámetros de unión específicos del sistema y pueden ser atractivos o repulsivos. La disposición eclipsada del dímero de benceno se ve desfavorecida electrostáticamente, mientras que las atracciones entre los sustituyentes de hidrógeno positivos y el\(\pi\) sistema de un anillo adyacente son atractivas en la disposición eclipsada.
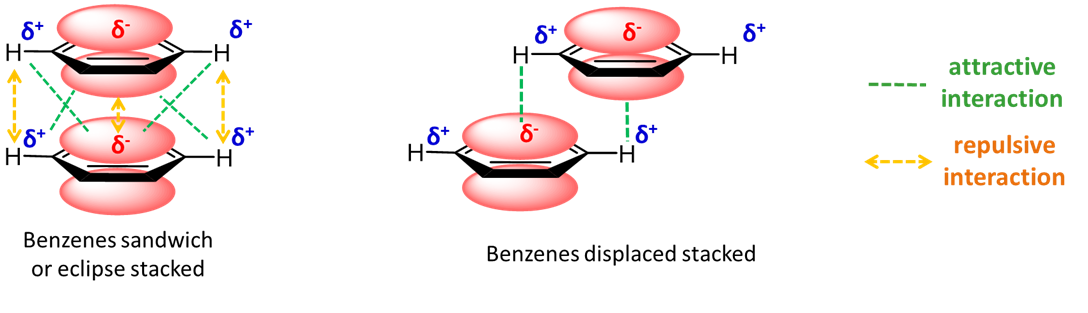
Con sustituyentes electronegativos, la polaridad del sistema de anillos se invierte de manera que existen interacciones electrostáticas favorables en un heterodímero eclipsado de benceno y hexafluorobenceno.
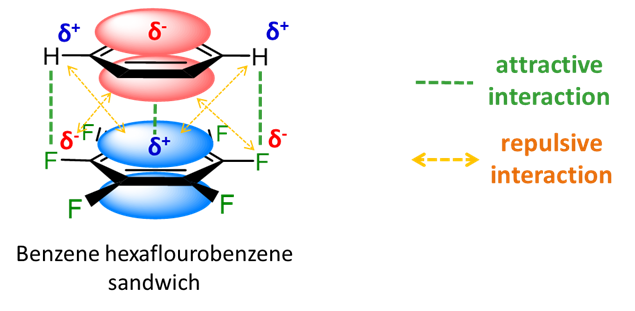
En el heterodímero de benceno y hexafluorobenceno, por fin tenemos un ejemplo de un sistema de\(\pi\) apilamiento que puede describirse más fácilmente como que implica una interacción ácido-base de Lewis. Específicamente, el\(\pi\) sistema de benceno relativamente rico en electrones actúa como una base de Lewis en la donación de “pares de electrones” al\(\pi\) sistema de hexafluorobenceno pobre en electrones.
Notas
* El ejemplo más destacado de desolvación como fuerza impulsora es el efecto hidrofóbico. El efecto hidrofóbico gobierna la estructura de jabones, micelas, biomoléculas y otros sistemas anfifílicos o no polares en el agua. En el efecto hidrófobo, la preferencia de una solución acuosa de un soluto hidrófobo para maximizar las interacciones agua-agua significa que los grupos hidrófobos tienden a pegarse en solución.
** Una buena analogía para este efecto es la analogía del mármol magnético. Cuando se mezclan canicas magnéticas y ordinarias, las canicas magnéticas tenderán a pegarse juntas porque se atraerán fuertemente entre sí, no porque las interacciones entre las canicas no magnéticas sean de alguna manera desfavorecidas.
† Esto no quiere decir que los arreglos de apilamiento conduzcan a la atracción en cada instancia. Hay arreglos en los que se espera que los anillos paralelos se repelan.

