6.5.2: Los enlaces de hidrógeno pueden considerarse como un tipo especial de interacción ácido-base de Lewis en la que un ion hidrógeno ácido de Lewis se comparte entre las bases de Lewis
- Page ID
- 81243
Un enlace de hidrógeno es una interacción de enlace en la que una unidad donadora de enlaces de hidrógeno E-H actúa como un ácido de Lewis en la donación de un ion hidrógeno a un aceptor de enlace de hidrógeno, A.
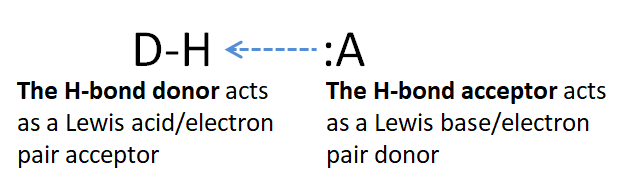
Clásicamente, los enlaces de hidrógeno (enlaces H) se han definido como un tipo especial de fuerza intermolecular entre D-H y:A, donde D & A = N, O, F y ocasionalmente S. Se dice que el D-H es el donador de enlaces de hidrógeno mientras que: A es el aceptor de enlaces de hidrógeno.

Considere, por ejemplo, un enlace de hidrógeno entre dos moléculas de agua:
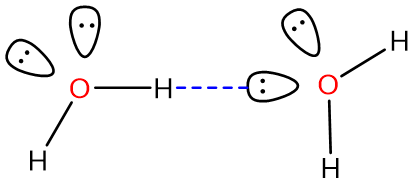
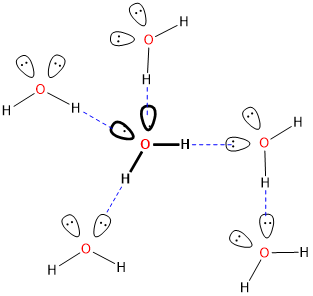
Un enlace O-H en el agua de la izquierda sirve como donador de enlaces de hidrógeno mientras que uno de los pares solitarios en el oxígeno del agua a la derecha actúa como aceptor de enlaces de hidrógeno.* La fuerza de esta interacción clásica de puentes de hidrógeno es ~12-20 kJ/mol, mucho mayor que las energías típicas de interacción dipolo-dipolo (<4 kJ/mol), y aunque los enlaces de hidrógeno en el agua son algo flexibles, el eje del enlace de hidrógeno O-H—O prefiere ser lineal en muchos casos [1]. Estos factores sugieren que los enlaces de hidrógeno son más que un tipo especial de interacción dipolo-dipolo que involucra hidrógeno. En cambio, los enlaces de hidrógeno implican una combinación de factores, que incluyen:
- interacciones dipolo-dipolo
- enlace covalente
- fuerzas de dispersión
- X-H\(\pi\) -interacciones**
La importancia relativa de estas interacciones puede diferir significativamente de un sistema a otro.
Al considerar cómo entender mejor los enlaces de hidrógeno, se han empleado los conceptos ácido-base de Brønsted y Lewis. En términos de Brønsted, se ha descrito que los enlaces de hidrógeno implican una transferencia parcial de un ion hidrógeno de D a A. La definición de Lewis es a menudo más útil para comprender el papel de la covalencia, sin embargo, debido a la facilidad con la que la teoría de Lewis acomoda las interacciones orbitales a través del Aproximación orbital fronteriza a la unión química y reactividad. Además, de la definición clásica de enlaces de hidrógeno como que implica la donación de H por una unidad D-H y su aceptación por un par solitario en A, es evidente que en algún sentido D-H está actuando como un ácido de Lewis al donar un H deficiente en electrones a A mientras que A está actuando como una base de Lewis al usar su par solitario para aceptar ello. A este respecto, quizás se considere mejor que el enlace de hidrógeno implica la formación de aductos ácido-base de Lewis entre un enlace D-H y A.
Esta definición más expansiva de un enlace de hidrógeno como que involucra una interacción ácido-base de Lewis acomoda la variedad mucho más amplia de interacciones de enlaces de hidrógeno que se han reconocido desde la década de 1990. Si bien la definición clásica de enlaces de hidrógeno explica gran parte de los enlaces de hidrógeno que se producen en los sistemas de agua, orgánicos y biomoleculares, el gran número de enlaces H multicéntricos † y la capacidad de C-H, P-H y Au-H para funcionar como donantes de enlaces de hidrógeno y para que los\(\pi\) sistemas función como aceptores de enlaces de hidrógeno está excluida por la definición clásica de un enlace de hidrógeno. Por el contrario, la definición basada en Lewis permite comprender las contribuciones covalentes a los enlaces de hidrógeno en dichos sistemas en términos de la superposición de orbitales fronterizos en D, H y A. Consideremos, por ejemplo, las interacciones orbitales fronterizas involucradas en un enlace de hidrógeno típico entre D-H y A: † †
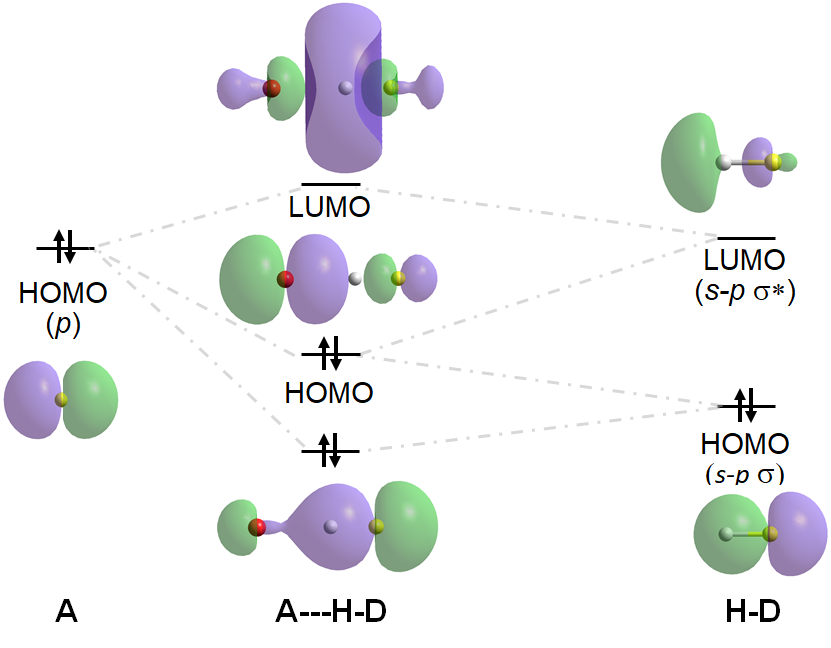
Los enlaces de hidrógeno como el anterior se denominan enlaces de hidrógeno asimétricos ya que el enlace D-H es más corto y más estabilizado que el enlace A-H. Cuando D y A son de energía igual o similar, sin embargo, las interacciones D-H y A-H son de energía similar, y la H estará centrada entre D y A, dificultando la identificación de qué átomo es el donante y cuál es el aceptor. Dichos enlaces H se denominan enlaces H simétricos. Un ejemplo es el enlace H en [F—H—F] -, para el cual las interacciones orbitales fronterizas estabilizadoras y desestabilizadoras son
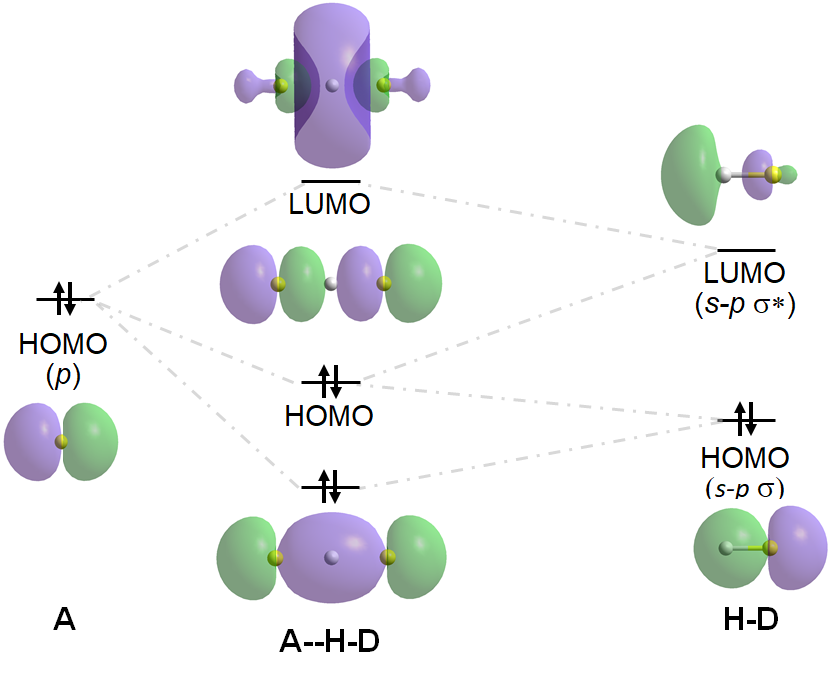
En general, los enlaces de hidrógeno simétricos son más fuertes y más estables que los asimétricos. De hecho, un enfoque para predecir la fuerza de los enlaces clásicos de hidrógeno llamado Regla de Deslizamiento pKa de Gili ‡ considera el pKa de la forma protonada tanto del donante neutro (D-H) como del aceptor neutro (A, que luego se protonó a H-A +). En este enfoque se considera que el enlace H implica la transferencia de un ion hidronio entre el donante y el aceptor, y los valores pK a del donador y aceptor sirven como proxies para la capacidad de D - y A para atraer el ion hidrógeno en el enlace H a sí mismo. Cuando el
- el donante es más básico (es decir, su pK a es mayor) se produce relativamente poca transferencia, y el enlace de hidrógeno se representa mejor como D-H-A
- aceptor es más básico (es decir, su pK a es mayor) el ion hidrógeno se transfiere de D a A, dando un enlace de hidrógeno mejor representado como D-H-A
- el donante y el aceptor son aproximadamente igualmente básicos (tienen valores similares de pK a) el ión hidrógeno se comparte aproximadamente por igual entre D y A en un enlace H simétrico, D-H-A
Específicamente, Gili propuso los siguientes criterios para predecir la fuerza de estos enlaces de hidrógeno ordinarios:
| Tipo de enlace de hidrógeno | \( \Delta pK_a\) |
|---|---|
| Fuerte (11.5-15.8 kcal/mol) | \ (\ Delta PK_a\) ">0-3 |
| Medio Fuerte (6.8-11.5 kcal/mol) | \ (\ Delta PK_a\) ">3-11 |
| Medio (4.1-6.8) kcal/mol | \ (\ Delta PK_a\) ">11-21 |
| Medio Débil (2.5-4.1 kcal/mol) | \ (\ Delta PK_a\) ">21-31 |
| Débil (1.1-2.5 kcal/mol) | \ (\ Delta PK_a\) ">>31 |
Experimentalmente, la existencia de enlaces de hidrógeno y su fuerza aproximada se deduce de las distancias y ángulos de los enlaces cristalográficos, los cambios en la frecuencia vibracional D-H y los cambios en las posiciones de los picos de RMN 1H, aunque todas estas medidas deben interpretarse con precaución.
Si los enlaces de hidrógeno implican la formación total o parcial de enlaces covalentes coordinados entre un enlace D-H y un sitio aceptor, entonces el aducto resultante debería exhibir evidencia de formación de enlaces. En la práctica, dicha evidencia se busca de tres fuentes principales:
1. Distancias y ángulos de unión cristalográficos. En la estructura de los sólidos cristalinos, los enlaces de hidrógeno se pueden distinguir de los contactos de Van der Waals en que
- la distancia D-A es más cercana a la esperada de las superficies Van der Waals de D y A.
- cuando se puede ubicar el H, la distancia D-H es más larga que los enlaces D-H no unidos a hidrógeno en sistemas similares.
- para enlaces de hidrógeno de dos centros no restringidos por factores externos, el ángulo D-H-A se aproximará a la linealidad, como la teoría VSEPR predeciría para una unidad D:H:A.
2. Frecuencias vibracionales D-H. Dado que los enlaces de hidrógeno implican el debilitamiento del enlace D-H y la formación de un enlace H-A, en teoría, los modos vibracionales D-H y A-H se encontrarán en el espectro IR de un sistema de enlaces de hidrógeno, aunque desplazados al rojo a números de onda más bajos que los enlaces D-H y A-H no debilitados. En la práctica, el cambio en la banda vibracional D-H a números de onda más bajos (junto con un ensanchamiento e intensificación de la banda) se toma como evidencia de enlaces de hidrógeno (Figura 6.5.1.1).
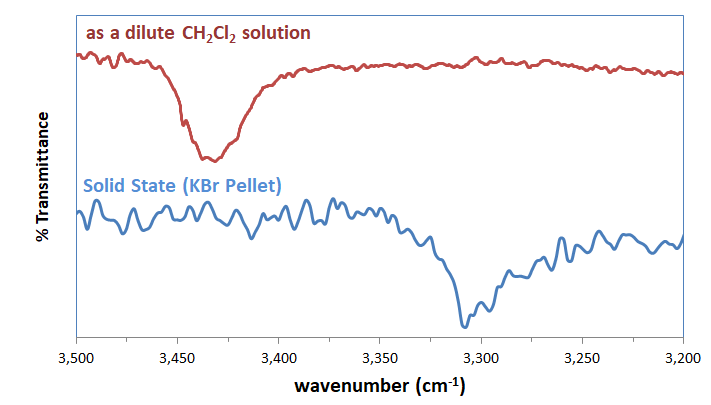
3. Cambios en la posición del pico de RMN 1H del hidrógeno donante. A medida que el hidrógeno se transfiere parcialmente de D a A, se deshicede y así se desplaza campo abajo, a veces en tanto como varios ppm.
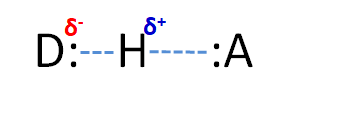
Se debe tener cuidado en la aplicación de estos criterios ya que:
- Los criterios funcionan mejor para los sistemas clásicos con enlaces de hidrógeno. Otros aspectos del enlace en un sistema dado pueden influir en las resistencias de enlace aparentes y los desplazamientos químicos de RMN, particularmente para enlaces H intramoleculares y en sistemas de enlaces de hidrógeno no clásicos.
- Los enlaces de hidrógeno más fuertes tienen más probabilidades de adherirse a estos criterios que los más débiles. Además, los enlaces de hidrógeno más fuertes generalmente exhiben mayor linealidad, distancias más cortas en relación con las esperadas de los radios de Van der Waals, mayor disminución de la frecuencia de estiramiento para D-H y mayores cambios de campo abajo en sus espectros de RMN.
Referencias y lecturas adicionales
- Steiner, T., El enlace de hidrógeno en el estado sólido. Angewandte Chemie Edición Internacional 2002, 41 (1), 48-76.
- Grabowski, S.J. Enlace de hidrógeno—New Insights; Springer: Dordrecht, Países Bajos, 2006.
- Gilli G., Gilli P. La naturaleza del enlace de hidrógeno, Oxford University Press; Oxford, Reino Unido: 2009.
- Scheiner, S., Número Especial: Enlace Intramolecular de Hidrógeno 2017. Moléculas 2017, 22 (9), 1521.
- Schmidbaur, H.; Raubenheimer, H. G.; Dobrzańska, L., El enlace oro-hidrógeno, Au—H, y el enlace de hidrógeno al oro, AuH—X. Chemical Society Reviews 2014, 43 (1), 345-380.
- Gilli, P.; Pretto, L.; Bertolasi, V.; Gilli, G., Predicando Fortalezas de Enlace Hidrógeno a partir de Propiedades Moleculares Ácido-Base. La regla de cálculo del pKa: hacia la solución de un problema duradero. Cuentas de Investigación Química 2009, 42 (1), 33-44.
- Laurence, C.; Gal, J.-F. o., Escalas de basicidad de Lewis y Afinidad: Datos y Medición. John Wiley: Chichester, West Sussex, Reino Unido, 2010.
- Scheiner, S., Evaluación de la Presencia y Fuerza de los Enlaces H por medio de RMN Corregida. Moléculas 2016, 21 (11), 1426.
- Nícha, J.; Foroutan-Nejad, C.; Straka, M., 1H NMR no es una prueba de enlaces de hidrógeno en complejos de metales de transición. Nature Comunicaciones 2019, 10 (1), 1643.
Notas
* Por supuesto, en soluciones donde hay muchas interacciones de enlaces de hidrógeno, muchas de las moléculas de agua podrían actuar simultáneamente como donadoras y aceptoras de enlaces de hidrógeno.
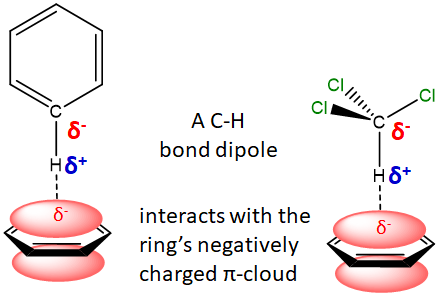
** Las\(\pi\) interacciones X-H son interacciones entre la carga positiva parcial en el extremo H de un enlace polar X-H y un\(\pi\) enlace con carga negativa. Estos son particularmente para comprender los sistemas unidos por hidrógeno en los que como\(\pi\) sistema sirve como aceptor de enlaces de hidrógeno,. A continuación se ilustran ejemplos de interacciones X-H en las que el benceno es el aceptor.
† En un enlace H multicéntrico, el D-H se dona a múltiples aceptores simultáneamente.
†† Los MO mostrados en los diagramas se calcularon realizando cálculos ab initio en el nivel 6-31G**. Aquellos para el enlace H simétrico corresponden a FHF - y el enlace asimétrico H a OHF -.
‡ Llamado así porque implica un gráfico de barras deslizantes con clases comunes de donantes y aceptores de bonos H que pueden deslizarse a lo largo de la regla de una manera similar a la operación de un dispositivo pre-finales del siglo XX para realizar cálculos matemáticos llamados regla de cálculo.
‡‡ por ejemplo, los enlaces de hidrógeno intramoleculares a veces están limitados por la geometría general de los grupos que interactúan.

