8.1.1: La Tabla Periódica es un Concepto Organizativo en la Química del Grupo Principal
- Page ID
- 81331
Las propiedades químicas y físicas de los compuestos del grupo principal son el resultado de las propiedades electrónicas de sus átomos e iones constituyentes. Estas propiedades electrónicas atómicas están determinadas por el número de electrones presentes y los orbitales del estado fundamental que ocupan. De estos electrones los químicamente más importantes son los electrones de valencia y los orbitales que ocupan, llamados orbitales de valencia. Estos recuentos de electrones de valencia y ocupaciones orbitales varían sistemáticamente de manera que se refleja en la organización de la tabla periódica. Específicamente, el número de electrones de valencia y los tipos de orbitales atómicos que ocupan están determinados por el grupo del elemento. Esto se refleja en la estructura de bloques familiar de la tabla periódica que se muestra en la Figura\(\PageIndex{1}\).
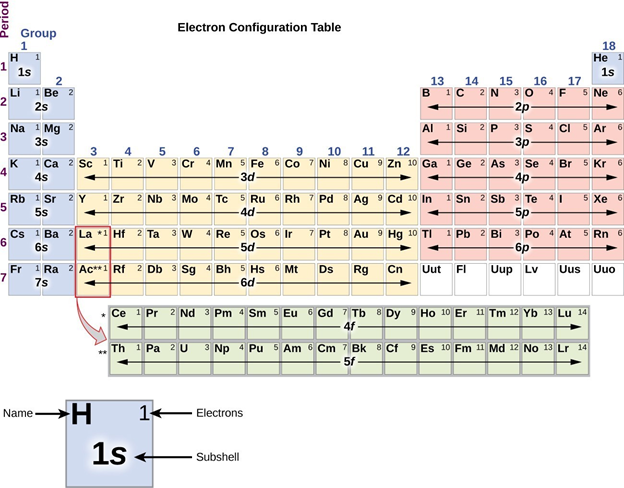
De la Figura\(\PageIndex{1}\) se puede observar que los elementos del grupo principal son aquellos con configuraciones de electrones de valencia tipo ns x y ns 2 n p y, llamados elementos de bloque s y p. La ocupación exacta de las subcapas s y p aumenta con el número total de electrones de valencia de izquierda a derecha a través de la tabla periódica como se muestra en la Figura\(\PageIndex{2}\).
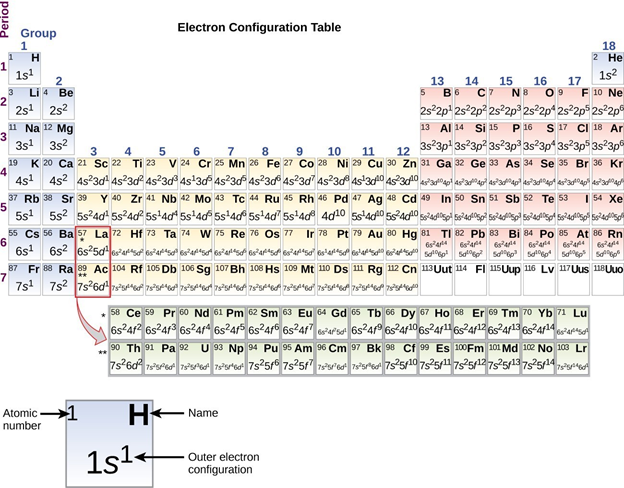
De la Figura\(\PageIndex{2}\) se puede observar que los elementos dentro de un grupo de la tabla periódica tienen la misma configuración de electrones de valencia s y p. Esta es una de las razones por las que los elementos dentro del mismo grupo tienden a tener propiedades químicas similares. [1] En consecuencia, suele ser conveniente pensar y hablar de los elementos y sus propiedades por grupo.
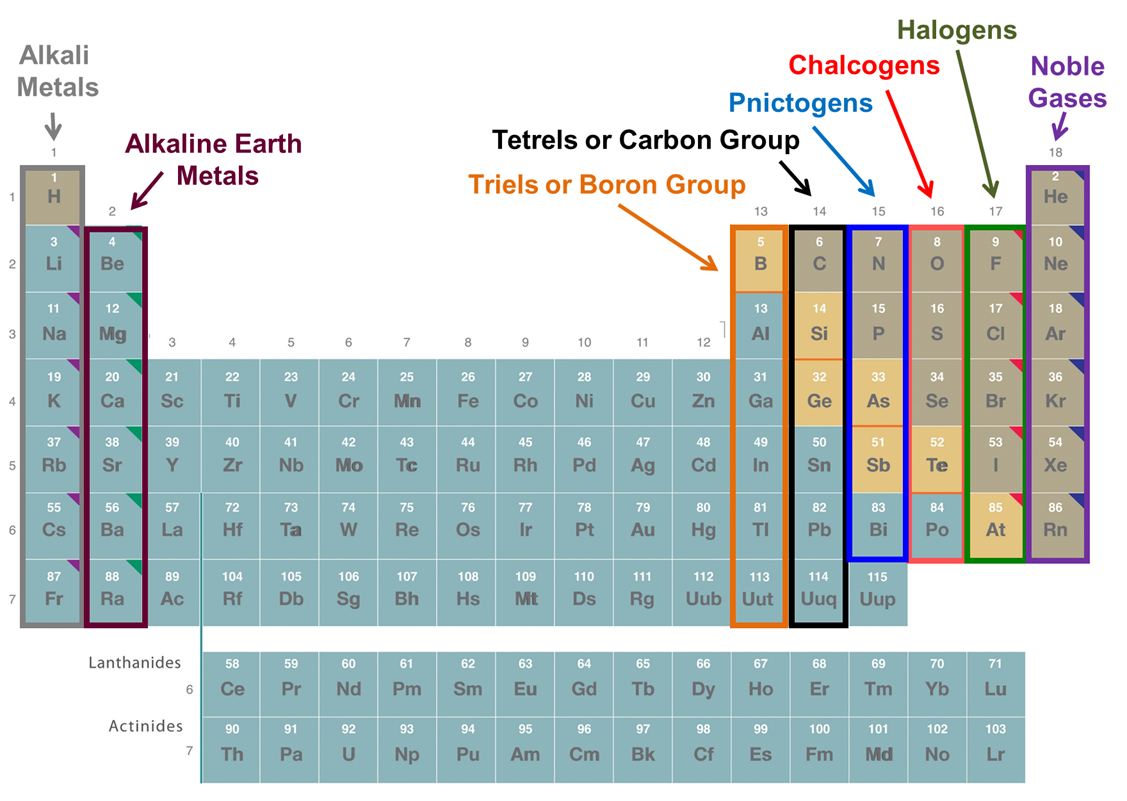
Los grupos siempre pueden ser referidos por su número de grupo o su primer elemento. Además, un número tiene nombres comunes que son ampliamente utilizados. Estos se dan en la Figura\(\PageIndex{3}\).
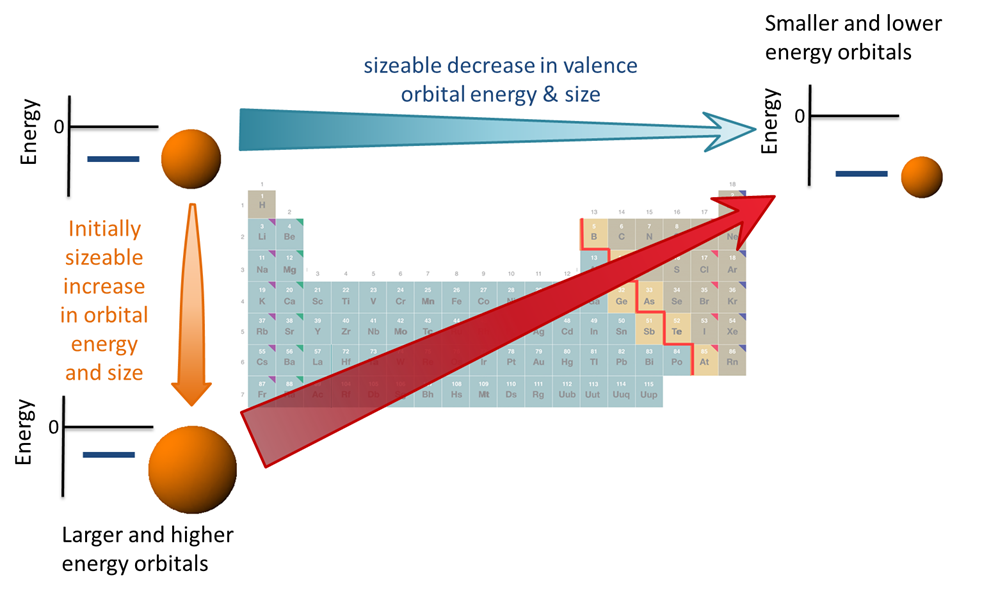
Se puede obtener más información sobre las propiedades de los elementos considerando cómo la variación sistemática en la configuración electrónica que ocurre a través de las filas de la tabla periódica interactúa con las variaciones sistemáticas en las propiedades atómicas que ocurren a través de filas y grupos descendentes. Una comprensión detallada de estas propiedades, cómo varían a lo largo de la tabla periódica y por qué varían en la forma en que lo hacen se desarrollará en secciones posteriores. Por ahora, sólo es necesario conocer las tendencias en las propiedades orbitales de valencia, que son
- El tamaño orbital de valencia tiende a aumentar un grupo a medida que aumenta el número atómico principal. Este aumento en el tamaño orbital corresponde al alargamiento de la distancia electrón-nuclear promedio y, en consecuencia, a un debilitamiento de la atracción electrón-núcleo de valencia.
- La energía orbital de valencia disminuye aproximadamente a través de una fila a medida que aumenta la carga nuclear efectiva, Z*. El factor principal que impulsa esta disminución de la energía es el aumento de la atracción electrón-núcleo a medida que aumenta Z*.
- El tamaño orbital de valencia disminuye aproximadamente a lo largo de una fila a medida que aumenta la carga nuclear efectiva, Z*. Esta disminución de tamaño corresponde a un acortamiento de la valencia electrón-distancia y fortalecimiento de la atracción electrón-núcleo de valencia. Este efecto de tamaño refuerza la mencionada disminución de las energías orbitales de valencia. Carga nuclear efectiva, aunque en general la disminución de la energía debido a la disminución del tamaño es menos importante que la disminución de la energía debido al aumento de la carga. Esto se debe a que el tamaño disminuye gradualmente de izquierda a derecha mientras que la carga nuclear efectiva aumenta en aproximadamente 2/3 de una unidad de carga cuando se mueve de grupo a grupo.
Estas tendencias se resumen en la Figura\(\PageIndex{4}\).
Estas tendencias de propiedades orbitales de valencia afectan a dos clases diferentes de propiedades atómicas. Las primeras son las propiedades orbitales relacionadas con el tamaño de valencia, como los radios atómicos y la fuerza\( \pi \) de interacción de unión. El segundo son las propiedades relacionadas con la atracción electrón-núcleo que comprenden energía de ionización, afinidad electrónica y electronegatividad.
Las consecuencias de las tendencias de las propiedades orbitales de valencia sobre las propiedades atómicas son las siguientes
- El tamaño atómico aumenta en un grupo a medida que la valencia orbital se hace más grande (n aumenta) y disminuye aproximadamente a través de una fila a medida que aumenta la carga nuclear efectiva.
- La energía de ionización disminuye en un grupo a medida que la valencia orbital se hace más grande y aumenta aproximadamente a través de una fila a medida que aumenta la carga nuclear efectiva.
- La afinidad electrónica disminuye en un grupo a medida que el orbital atómico de valencia se hace más grande y aumenta aproximadamente a través de una fila a medida que aumenta la carga nuclear efectiva.
- La electronegatividad disminuye en un grupo a medida que la órbita atómica más baja incompletamente ocupada se hace más grande y aumenta aproximadamente a través de una fila a medida que aumenta la carga nuclear efectiva.
Estas consecuencias se resumen en la Figura\(\PageIndex{5}\).
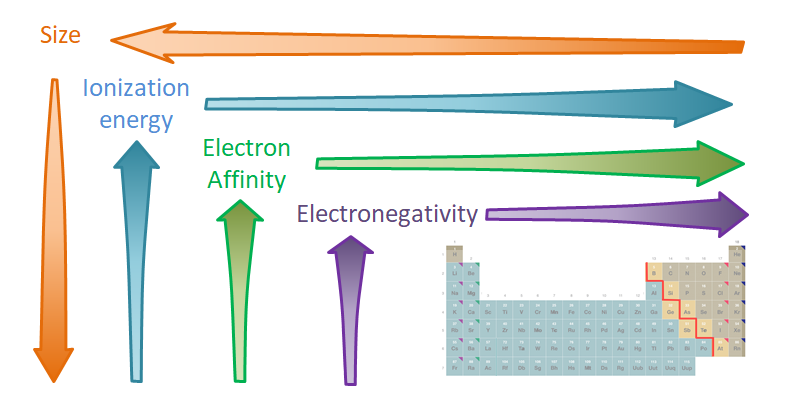
Estas variaciones a su vez explican las tendencias en las propiedades de los elementos del grupo principal que se exploran en el resto de este capítulo.
[1] Otra es que las energías orbitales de valencia tienden a variar relativamente poco hacia abajo de un grupo, especialmente a medida que uno se mueve de la fila tres hacia abajo.
Colaboradores y Atribuciones
Stephen M. Conakes (Westmont College)

