8.1.1.1: La distinción metal-nonmetal-metaloide y la “línea” metal-no metal son útiles para pensar en tendencias en las propiedades físicas de los elementos
- Page ID
- 81343
Dos factores contribuyen a variaciones aproximadas y a gran escala en el tipo de estructura y unión en la que participan los elementos principales del grupo.
- Disminución de la energía orbital de valencia y tamaño al moverse de la parte inferior izquierda a la parte superior derecha de la tabla periódica
- Aumento de la ocupación de proyectiles de valencia al moverse de izquierda a derecha en todo el grupo principal
Como se resume en la Figura\(\PageIndex{1}\), el efecto neto de estas tendencias es que
Los elementos en grupos anteriores con pocos electrones de valencia actúan como metales ya que tienden a
- perderlos para dar cationes con un caparazón de valencia vacío
- compartirlos formando enlaces deslocalizados en racimos y el estado sólido, aunque esta tendencia es menos pronunciada a medida que uno se mueve hacia la parte superior de la tabla periódica ya que elementos en grupos anteriores con orbitales de menor energía más compactos ya que estos elementos se ionizan menos fácilmente y forman más fácilmente fuertes enlaces covalentes (por ejemplo, considere la estabilidad relativa de los reactivos Gringard que contienen alquillitio y Mg en comparación con los reactivos de alquilsodio o calcio)
Los elementos en grupos posteriores con muchos electrones de valencia actúan como no metales ya que tienden a
- ganar electrones adicionales para formar aniones con una capa de valencia rellena estable
- forman enlaces sigma estables en pares en sólidos moleculares y covalentes de red, aunque esta tendencia es menos pronunciada a medida que uno se mueve hacia abajo de un grupo y los orbitales se vuelven más difusos. Como resultado, los no metales exhiben una mayor tendencia a participar en enlaces deslocalizados y agrupados al moverse hacia abajo de la tabla periódica.
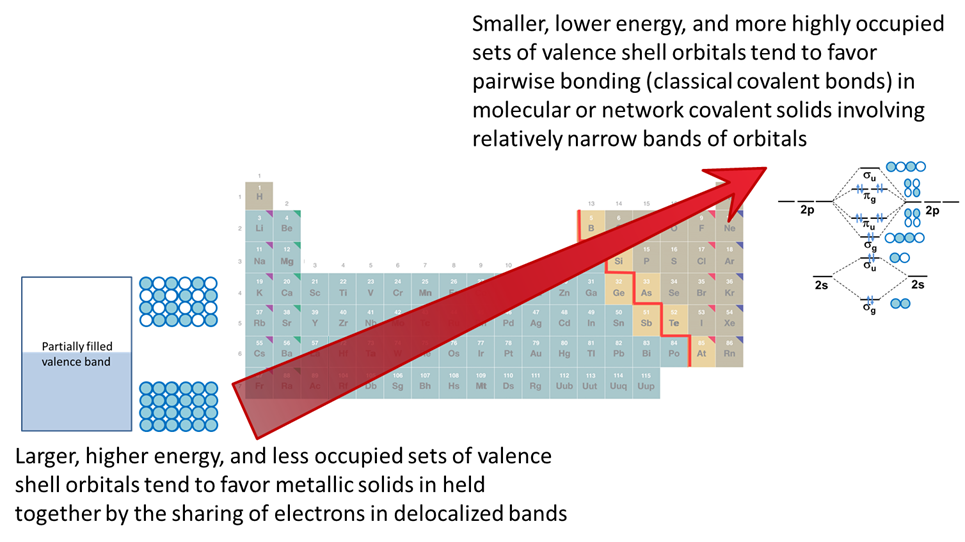
Estas tendencias periódicas en las tendencias de unión impactan el tipo de estructuras que forman los elementos y sus propiedades físicas. Esto se refleja en la división clásica de los elementos en metales, no mentales y metaloides representados en la Figura\(\PageIndex{2}\). Como puede verse en la Figura\(\PageIndex{2}\), los metales en la parte inferior izquierda de la tabla periódica están separados de los no metales en la parte superior derecha por la línea metal-no metal. La mayoría de los elementos adyacentes a la línea (que se eligen varían entre tablas periódicas) exhiben propiedades intermedias entre los metales y los no metales exhiben propiedades intermedias y se denominan metaloides.
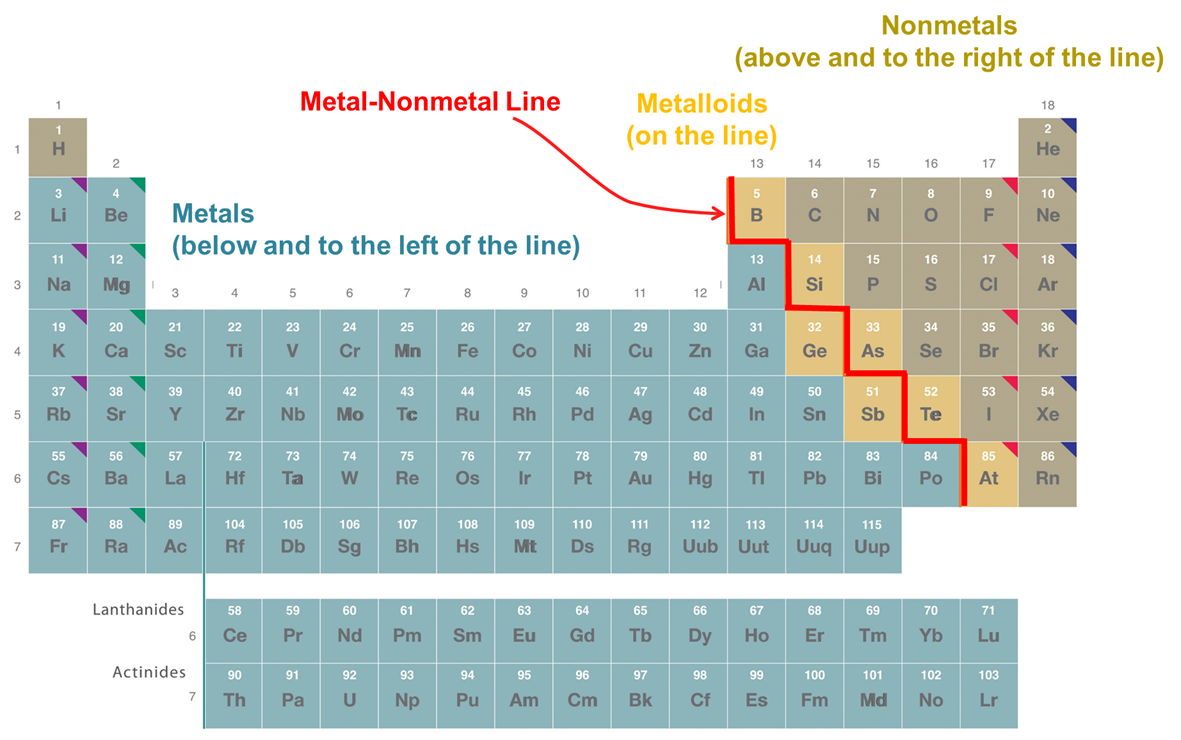
Los metales hacia la parte inferior izquierda de la tabla periódica forman sólidos metálicos que se mantienen unidos por unión deslocalizada. Como resultado metales
- son maleables (capaces de ser martillados en láminas) y dúctiles (capaces de ser arrastrados en cables), ya que las celosías de estado sólido de los metales pueden deformarse por movimiento de dislocación (deslizamiento) sin alterar significativamente la unión.
- presentan una alta conductividad térmica y alta conductividad eléctrica. Dado que tienen una banda de valencia incompletamente llena deslocalizada en toda la estructura, es fácil transmitir calor y carga moviendo sus electrones alrededor.
En contraste, los no mentales hacia la parte superior derecha de la tabla periódica forman compuestos moleculares y sólidos covalentes de red. En general estos elementos tienden a existir como
- sean líquidos, gases o sólidos quebradizos. Cuando están presentes como sólidos, los no metales tienden a ser quebradizos ya que la deformación implica la ruptura de enlaces covalentes en el caso o sólidos covalentes o la ruptura de fuerzas intermoleculares en el caso de los sólidos moleculares.
- tienen baja conductividad térmica y eléctrica. Dado que para los sólidos moleculares la transferencia de energía o electrones a través de colisiones o a través del espacio es mucho más lenta y, para los sólidos covalentes de red mantenidos unidos por fuertes enlaces sigma implica la excitación de electrones a través de un intervalo de banda razonablemente grande. Tenga en cuenta que esto es sólo una tendencia. Los sólidos covalentes de red mantenidos juntos por enlaces covalentes más débiles o\( \pi\) enlaces a veces tienen huecos de banda pequeños o inexistentes. Por ejemplo, el alótropo de grafito de carbono es un conductor eléctrico sobresaliente porque su\(\pi\) banda de valencia y su banda de\(\pi\) conducción *se superponen, sin dejar espacio de banda.
Los metaloides a lo largo de la línea de metal no metálico forman sólidos que exhiben patrones de unión y propiedades intermedias entre los de metales y no metales. Esto se debe a que en realidad hay una graduación en las propiedades del elemento a medida que uno se mueve de la parte inferior izquierda a la parte superior derecha de la tabla periódica. En consecuencia, aunque la distinción entre metales, no metales y metaloides puede ser útil, estas categorías no deben entenderse de manera demasiado rígida.
Lo mismo ocurre con la tendencia de los metales y no metales a formar compuestos iónicos entre sí, debido a la tendencia de los metales a perder electrones y no memtales para ganarlos. En la práctica, hay una graduación en el carácter iónico basada en la diferencia en las electronegativitas de los elementos y el tamaño/polarizabilidad de los átomos involucrados. Como resultado, muchos compuestos entre metales y no metales pueden considerarse de manera rentable que involucran enlaces covalentes polares.
Colaboradores y Atribuciones
Stephen M. Conakes (Westmont College)

