8.1.1.2: Existen diferencias cualitativas en la química de los elementos en las dos primeras filas y las del resto de la tabla periódica
- Page ID
- 81342
Las características de unión de los elementos no varían gradualmente hacia abajo de los grupos en el grupo principal de la tabla periódica. En cambio, hay discontinuidades significativas al moverse entre los elementos de la primera y segunda fila y los elementos de la segunda fila y el resto de la tabla periódica. Estas diferencias se describen a continuación y se representan esquemáticamente en la Figura\(\PageIndex{1}\).
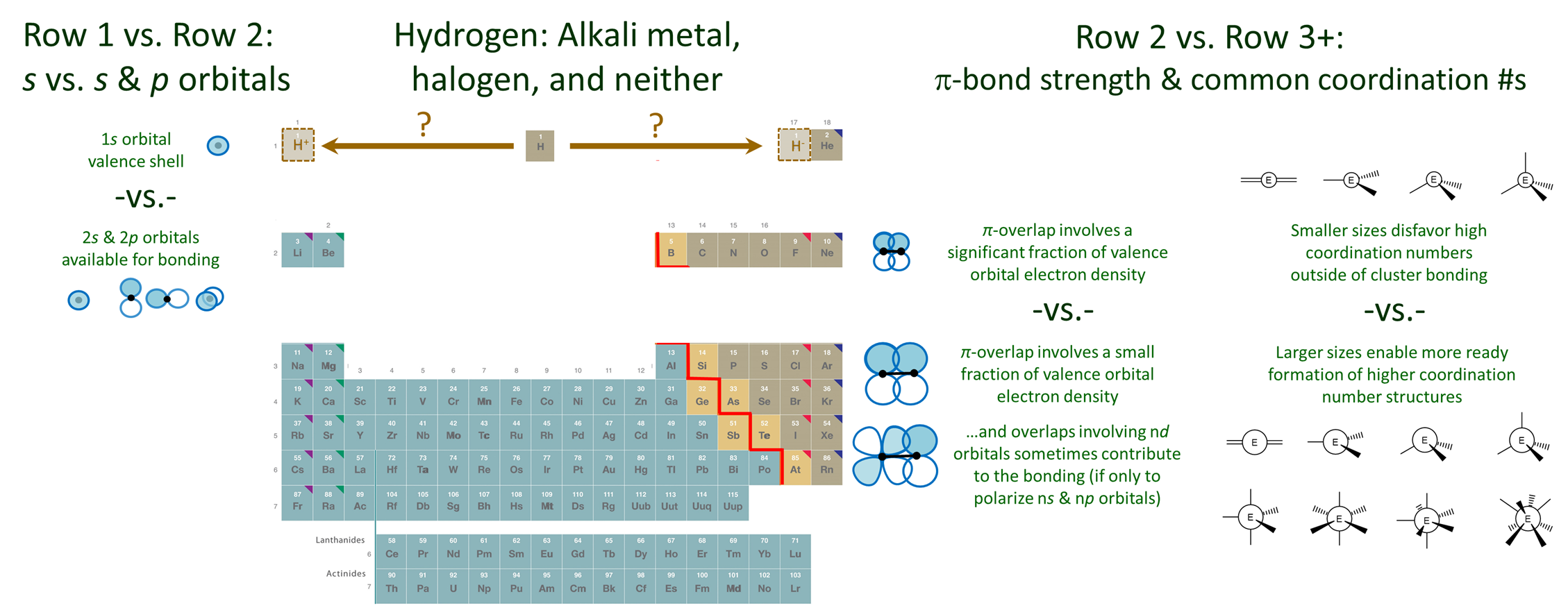
Los elementos de la primera fila tienen una química única porque su caparazón de valencia es solo un orbital de 1 s.
En el caso de He el orbital de 1 s es lleno, compacto y de baja energía. En consecuencia Él es extremadamente inerte, hasta el punto en que no se conocen compuestos de Él.
El orbital 1s del hidrógeno es comparativamente más alto en energía. Como resultado H es más reactivo. Tiende a perder o ganar su electrón único pero también puede contribuir a la unión multicéntrica.
Debido a su versatilidad química, la ubicación de H en la tabla periódica es ambigua. A pesar de que su electronegatividad es mucho mayor que la del litio, generalmente se coloca en la cabeza de los metales alcalinos. Esta colocación es consistente con su posesión de un electrón de valencia singe y la consecuente disposición con la que pierde un electrón, particularmente en medios acuosos. Sin embargo, el hidrógeno también es corto de un solo electrón y así en otros contextos forma fácilmente hidruros. Por lo tanto, podría colocarse en la cabeza de los halógenos. Si bien es raro colocar H por encima de los halógenos en algunas tablas, H se coloca encima de la tabla para enfatizar esta versatilidad química.
De acuerdo con el principio de singularidad, los elementos de la segunda fila son únicos en su capacidad para formar fuertes vínculos múltiples y resistencia a servir como centros numéricos de alta coordinación.
Hay tres razones por las que los elementos de la segunda fila difieren significativamente de sus cogéneros más pesados.
1. Solo los elementos de la segunda fila forman\(\pi\) enlaces fuertes. Como se representa esquemáticamente en la Figura\(\PageIndex{1}\), los elementos de la segunda fila son capaces de formar\(\pi\) enlaces fuertes ya que la fracción de densidad electrónica involucrada en el\(\pi\) solapamiento es significativa para los orbitales más compactos y enlaces más cortos de los elementos de la fila 2. Por el contrario, para la fila 3 y los elementos más pesados relativamente poco de los orbitales grandes y difusos contribuyen al solapamiento que estabiliza el\(\pi\) enlace. En consecuencia,\(\pi\) los enlaces que involucran estos elementos son muy débiles y dichos enlaces son relativamente raros. Esto se debe a que casi siempre es más favorable que tales elementos formen múltiples enlaces simples o se involucren en la unión en racimo.
La tendencia de los no metales de la fila 2 a formar\(\pi\) enlaces fuertes en los casos en que sus congéneres más pesados forman estructuras extendidas es evidente a partir de los alótropos comunes formados por los no metales del bloque p. Como se muestra en la Figura\(\PageIndex{2}\) Fila 3+, los elementos tienen una mayor tendencia a formar estructuras extendidas unidas por enlaces simples que sus contrapartes de la Fila 2.
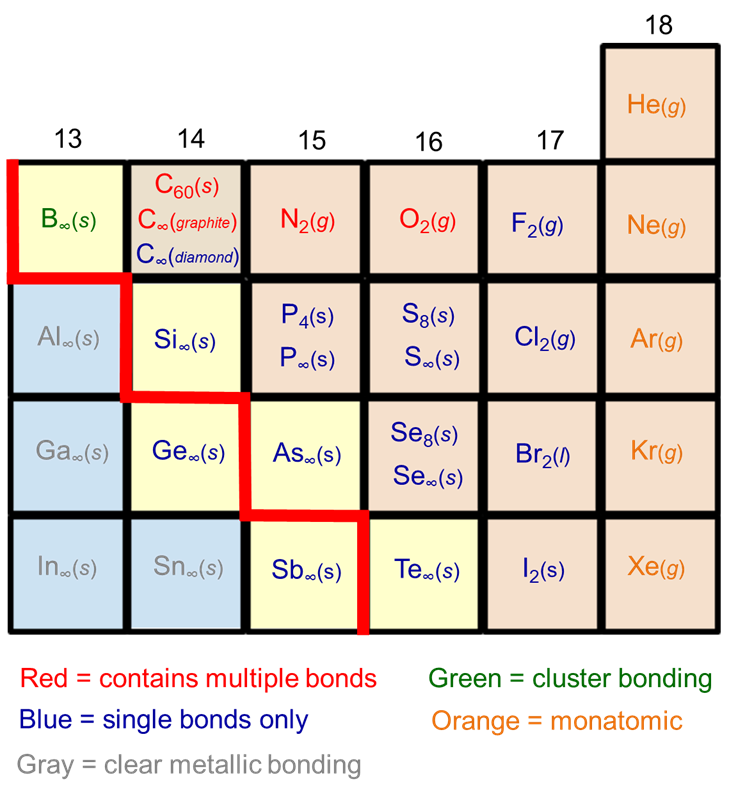
Como se muestra en la Figura\(\PageIndex{3}\), el carbono del elemento Fila 2 forma estructuras laminares que involucran múltiples uniones (grafito, fullerenos, nanotubos) así como redes 3D unidas por enlaces simples (la estructura de diamante) mientras que sus cogéneros más pesados Si y Ge solo forman redes 3D. De manera similar, el nitrógeno y el oxígeno forman gases diatómicos mantenidos unidos por múltiples enlaces, mientras que sus congéneres más pesados forman grupos (P), capas (As, Sb) o cadenas (S, Se, Te) mantenidos unidos por enlaces covalentes simples.

2. La capa de valencia de los elementos de la segunda fila carece de orbitales n d bajos. Como resultado, solo los orbitales tipo 2 s y 2 p de los elementos de la segunda fila contribuyen significativamente a la unión en sus compuestos. En contraste, los elementos del grupo principal de la fila 3 y superior poseen orbitales n d desocupados bajos que les permiten actuar como un\(\pi\) ácido hacia un átomo ligando mediante la formación\(d_{\pi}-p_{\pi}\) y\(d_{\pi}-d_{\pi}\) solapamiento.
3. Como se representa en la Figura\(\PageIndex{1}\), cuando los elementos de la segunda fila sirven como átomo central, no presentan fácilmente números de coordinación superiores a cuatro. En contraste, el mayor tamaño de la fila 3 y los elementos más pesados reducen la tensión estérica asociada con la adición de múltiples ligandos alrededor del centro de un elemento. Esto facilita que estos elementos formen estructuras trigonales bipiramidales, octaédricas y otras estructuras de alto número de coordinación.
Colaboradores y Atribuciones
Stephen M. Conakes, Westmont College

