8.5.1: Preparación y Propiedades Generales de los Elementos Alcalinotérreos
- Page ID
- 81544
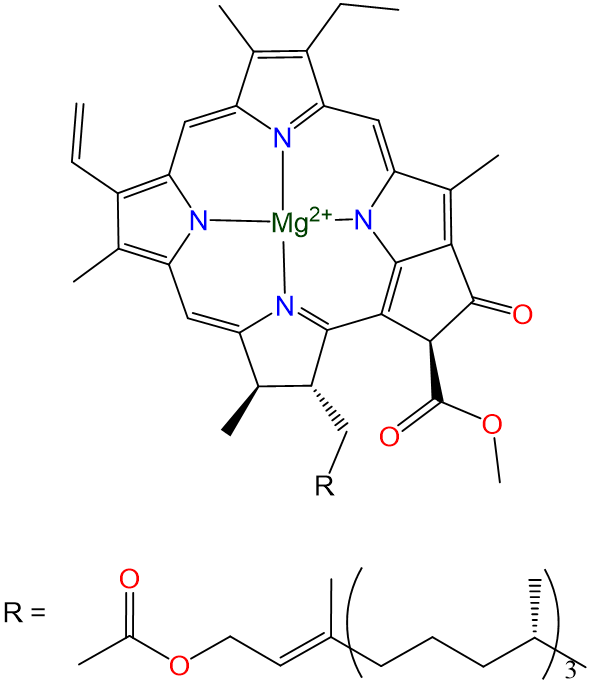
Al igual que los metales alcalinos, los metales alcalinotérreos son buenos reductores que solo se encuentran en la Tierra en sus estados de oxidación +2. El magnesio y el calcio son particularmente comunes. Las clorofilas que contienen magnesio son los pigmentos fotosintéticos de plantas verdes y algas fotosintéticas (Esquema\(\sf{\PageIndex{1}}\)).
Esquema\(\sf{\PageIndex{1}}\). Estructura de la clorofila a, uno de los principales pigmentos verdes de las plantas.
El agua de mar es de aproximadamente 0.05 M en Mg 2+ y 0.01 M en Ca 2+ y el berilio y el calcio son componentes de muchos minerales importantes. Ejemplos de minerales portadores de metales alcalinotérreos que fueron conocidos y utilizados desde la antigüedad incluyen el berilo, Be 3 Al 2 Si 6 O 18; yeso, CaSO 4 ·2H 2 O; piedra caliza, CaO 3; y cal, CaO, estos últimos fueron más recientemente reemplazado en construcción por ladrillos de cal arena a base de silicato de calcio y cemento Portland que contiene concreto.
A pesar de la distribución e importancia ambiental generalizada del calcio y el magnesio, los metales solo se aislaron a fines del siglo XVIII y principios del XIX después del desarrollo de la electrólisis. El aislamiento de Humphrey Davy de Mg y Ca es ilustrativo.
\[\sf{2~MO~~\overset{electrolysis}{\longrightarrow}~~2~M(s)~~+~~O_2~~~~~~Davy, (M~=~Mg,~Ca,~1808)} \nonumber \]
Hoy Ca, Mg y los demás metales alcalinotérreos se producen ya sea por electrólisis de sus cloruros o reducción química de carbono o aluminio.
\[\sf{2~MCl_2~~\overset{electrolysis}{\longrightarrow}~~2~M(s)~~+~~Cl_2~~~~~~(M~=~Be,~Mg,~Ca,~Sr)} \nonumber \]
\[\sf{MgO~~+~~C~~\overset{electrolysis}{\longrightarrow}~~Mg(s)~~+~~CO} \nonumber \]
\[\sf{3~MO~~+~~2~Al~~\overset{electrolysis}{\longrightarrow}~~M(s)~~+~~Al_2O_3~~~~~~(M~=~Ca,~Sr,~Ra)} \nonumber \]
\[\sf{4~BaO~~+~~2~Al~~\overset{electrolysis}{\longrightarrow}~~M(s)~~+~~BaAl_2O_4} \nonumber \]
Una vez formados, los metales son reactivos hacia el oxígeno atmosférico. Sin embargo, Be y Mg pueden almacenarse y usarse en el aire ya que la oxidación inicial da una fina capa pasivante del óxido que sella el metal a granel de la oxidación posterior. Los otros metales alcalinotérreos necesitan ser almacenados bajo una atomosfera inerte para evitar su degradación al óxido.
Propiedades Físicas
Al igual que los metales alcalinos, los metales alcalinotérreos son todos sólidos grises o plateados que cristalizan en una red cúbica, HCP para Be y Mg, FCC/CCP para Ca y Sr, y BCC para Ba y Ra. Todos poseen las propiedades metálicas típicas de alta conductividad térmica y térmica. Aparte del miembro más ligero del grupo, son comparativamente bajos de fusión y blandos debido a sus grandes radios atómicos, bajas cargas nucleares efectivas y solo dos electrones de valencia que contribuyen a la unión metálica. Así se funden y hierven a temperaturas más altas que los metales alcalinos pero a temperaturas más bajas que la mayoría de los metales de transición, como lo ilustran los puntos de fusión y ebullición enumerados en la Tabla\(\sf{\PageIndex{1}}\). Al igual que con los metales alcalinos, los puntos de fusión y ebullición disminuyen en el grupo a medida que aumenta el tamaño atómico.
Mesa\(\sf{\PageIndex{1}}\). Puntos de fusión y ebullición de los metales alcalinotérreos y sustancias de referencia seleccionadas. 3
| Sustancia | Punto de fusión (\(^{\circ}\)C) | Punto de ebullición (\(^{\circ}\)C) |
| Metal alcalinotérreo | ||
| Berilio, Be | 1278 | 2468 |
| Magnesio, Mg | 649 | 1090 |
| Calcio, Ca | 839 | 1484 |
| Estroncio, Sr | 769 | 1384 |
| Bario, Ba | 727 | 1845 |
| Radio, Ra | 700 | 1140 |
| Metal no alcalinotérreo | ||
| Litio, Li | 181 | 1347 |
| Sodio, Na | 98 | 883 |
| Cesio, Cs | 28 | 678 |
| Titanio, Ti | 1660 | 3287 |
| Hierro, Fe | 1538 | 2861 |
| Cobre, Cu | 1083 | 2567 |
| Agua | 0 | 100 |
| benceno | 6 | 80 |
Las propiedades atómicas de los metales alcalinotérreos reflejan
- energía relativamente alta y gran tamaño de sus orbitales n s
- mayor carga nuclear efectiva experimentada por los electrones en sus orbitales de valencia n s cuando se compara con los de los metales alcalinos correspondientes
Como puede verse a partir de los radios atómicos y las energías de ionización que se dan en la Tabla\(\sf{\PageIndex{2}}\), en general los radios y energías de ionización de los metales alcalinotérreos siguen las tendencias periódicas esperadas. Los radios aumentan a la baja de un grupo y a lo largo de una fila siguen la tendencia
\[\sf{alkali~metal~>~alkaine~earth~metal~>~transition~metals} \nonumber \]
Debido a su menor tamaño y mayor masa atómica, los metales alcalinotérreos son significativamente más densos que los metales alcalinos correspondientes (Cuadro\(\sf{\PageIndex{2}}\).
Correspondientemente, las energías de ionización de los metales alcalinotérreos disminuyen un grupo mientras que a través de una fila sus energías de ionización siguen la tendencia
\[\sf{alkali~metal~<~alkaine~earth~metal~<~transition~metals} \nonumber \]
En consecuencia los metales alcalinotérreos son buenos reductores y prefieren formar el ion +2, aunque no son tan reactivos como los metales alcalinos. Además, Be posee un radio anómalo pequeño, alta energía de ionización y gran electronegatividad en comparación con metales alcalinotérreos más pesados. En consecuencia, se comporta químicamente similar al boro y al aluminio, como se discutirá en el siguiente apartado.
Mesa\(\sf{\PageIndex{2}}\). Propiedades atómicas seleccionadas de los metales alcalinos y compuestos de referencia seleccionados. 3,4
| Sustancia |
Radio atómico (Angstroms) |
Primera energía de ionización (KJ/mol) |
Electronegatividad Pauling |
Densidad del sólido (g/mL) |
| Metal alcalinotérreo | ||||
| Berilio, Be | 1.05 | 899 | 1.57 | 1.85 |
| Magnesio, Mg | 1.50 | 738 | 1.31 | 1.74 |
| Calcio, Ca | 1.80 | 590 | 1.00 | 1.55 |
| Estroncio, Sr | 2.00 | 550 | 0.95 | 2.54 |
| Bario, Ba | 2.15 | 503 | 0.89 | 3.59 |
| Radio, Ra | 2.15 | 509 | 0.89 | 5.0 |
| Metal no alcalinotérreo | ||||
| Litio, Li (misma fila que Be) | 1.45 | 513 | 0.98 | 0.53 |
| Sodio, Na (misma fila que Mg) | 1.80 | 496 | 0.93 | 0.97 |
| Potasio, K (misma fila que Ca) | 2.20 | 419 | 0.82 | 0.86 |
| Rubidio, Rb (misma fila que Sr) | 2.35 | 403 | 0.82 | 1.53 |
| Cesio, Cs (misma fila que Ba) | 2.60 | 376 | 0.79 | 1.87 |
| Francium. Fr (misma fila que Ra) | no determinado | 400 | 0.7 | no determinado |
| Titanio, Ti | 1.40 | 658 | 1.54 | 4.54 |
| Hierro, Fe | 1.40 | 759 | 1.83 | 7.87 |
| Cobre, Cu | 1.35 | 745 | 1.90 | 8.96 |
| Boro, B | 0.85 | 801 | 2.04 | 2.34 |
| Aluminio, Al | 1.25 | 577 | 1.61 | 2.70 |
| Nitrógeno, N | 0.65 | 1402 | 3.04 | 1.03 (a 21 K) |
Como se explicará en la siguiente sección, las pequeñas energías de ionización de los metales alcalinos se encuentra entre los factores que contribuye a su reactividad.
Referencias y Notas
1. Todos los datos de propiedades físicas y atómicas para los elementos excepto los radios atómicos y los puntos de ebullición y fusión de Ba, Be y Fe se calculan a partir de datos en Emsley, J. Los elementos 2a ed. Oxford University Press, 1991. Dado que los puntos de transición de fase para Be, Ba y Fe fueron listados como correspoding a condiciones de alta presión o no estaban de acuerdo con los valores reportados en otra parte, fueron tomados de los datos listados en https://www.rsc.org/periodic-table.
2. Los radios atómicos son los radios empíricos determinados por John C. Slater según lo reportado en Slater, J. C. J. Chem. Phys. 1964, 41, 3199-3204. Los valores de estos radios se pueden acceder convenientemente en http://www.knowledgedoor.com/2/elements_handbook/slater_atomic-ionic_radius.html
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

