8.5.2: Propiedades químicas de los metales alcalinotérreos
- Page ID
- 81543
Los metales alcalinotérreos son buenos agentes reductores que tienden a formar el estado de oxidación +2.
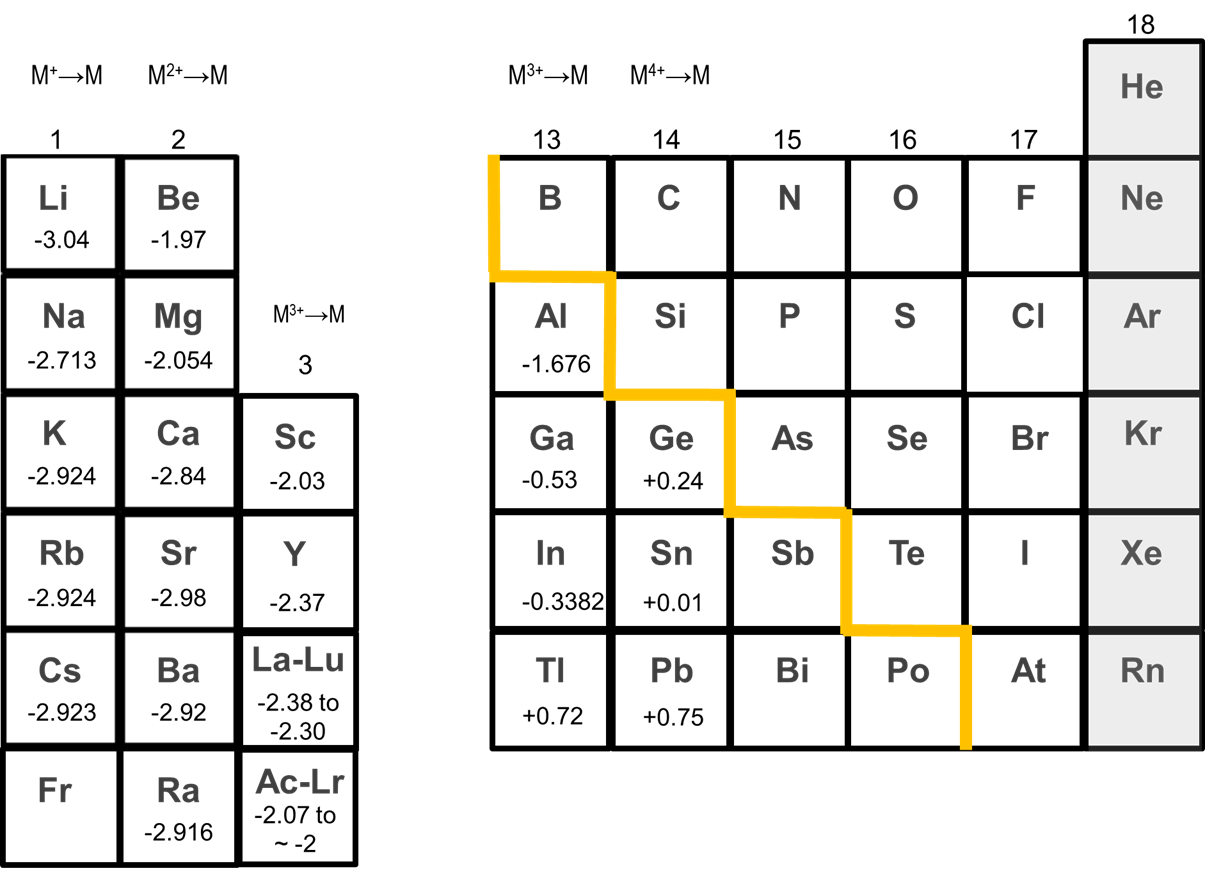
Los metales alcalinotérreos tienden a formar +2 cationes. Como se puede ver en la Figura\(\sf{\PageIndex{2}}\), los metales alcalinotérreos poseen grandes potenciales de reducción estándar M 2+/0 negativos que favorecen fuertemente el catión +2. Los potenciales de reducción de Ca 2+, Sr 2+ y Ba 2+ al metal de ~ -3 V son incluso similares a los de los metales alcalinos.
Al igual que los metales alcalinos, Ca, Sr y Ba se disuelven en amoníaco líquido para dar soluciones que contienen electrones solvatados, aunque estos no han sido tan estudiados como los de los metales alcalinos.
A diferencia del metal alcalino, todos los metales alcalinotérreos reaccionan con el oxígeno para dar óxidos de fórmula MO, aunque los peróxidos de las tierras alcalinas más pesadas pueden formarse por precipitación en fase de solución del catión metálico con una fuente de anión peróxido (O 2 2-).
\[\sf{2~M(s)~~+~~O_2~\longrightarrow~~2~MO(s)~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be,~Mg,~Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
\[\sf{M(OH)_2(aq)~~+~~H_2O_2(aq)~\longrightarrow~~MO_2(s)~~+~~2~H_2O~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Mg,~Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
Calcio, estroncio, bario, (y (presumiblemente radio), que reaccionan con el agua para liberar gas dihidrógeno y formar hidróxidos.
\[\sf{M(s)~~+~~2~H_2O(l)~\rightarrow~M^{2+}~~+~~2~OH^-~~+~~H_2(g)~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
aunque a diferencia de los metales alcalinos la reducción es lenta y generalmente libera hidrógeno sin incendio ni explosión.
El berilio y el magnesio no reaccionan con el agua a temperatura ambiente, aunque sí se disuelven en ácido y reaccionan con vapor a altas temperaturas y presiones para dar el óxido (que puede considerarse como un hidróxido deshidratado).
\[\sf{M(s)~~+~~2~H^+~~\rightarrow~M^{2+}~~+~~H_2(g)~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be~and~Mg)} \nonumber \]
\[\sf{M(s)~~+~~H_2O(g)~~\overset{high~T,~P}{\longrightarrow}~MO(s)~~+~~H_2(g)~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be~and~Mg)} \nonumber \]
Presumiblemente Ca, Sr, Ba y Ra reaccionarían de esta manera también, aunque debido a su mayor reactividad es probable que la reacción sea violenta.
Al igual que otros óxidos metálicos que contienen metales de bajo estado de oxidación, los óxidos alcalinotérreos son básicos. Los óxidos de los metales alcalinotérreos más pesados reaccionan con el agua para dar los hidróxidos.
\[\sf{MO~~+~~H_2O~\longrightarrow~~M(OH)_2~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be,~Mg,~Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
La hidrólisis de BeO y MgO suele requerir altas temperaturas y presiones. En consecuencia, sus hidróxidos se preparan más comúnmente mediante la adición de base a una sal soluble.
\[\sf{M^{2+}(aq)~~+~~2~OH^-~~\rightarrow~M(OH)_2~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be,~Mg, Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
Los metales alcalinotérreos reaccionan directamente con los halógenos para dar los dihaluros, aunque dada la exotermicidad de las reacciones que involucran los metales alcalinotérreos poderosamente reductores con halógenos oxidantes en el laboratorio suele ser más seguro reaccionar los hidróxidos u óxidos con el ácido hidrohalogenado apropiado.
\[\sf{M(s)~~+~~X_2^-~~\rightarrow~MX_2~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Be,~Mg, Ca,~Sr,~Ba,~and~presumably~Ra; X~=~F,~Cl,~Br,~I)} \nonumber \]
\[\sf{M(OH)_2~~+~~2~HX~~\rightarrow~MX_2~~+~~2~H_2O~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~and~presumably~Ra; X~=~F,~Cl,~Br,~I)} \nonumber \]
\[\sf{MO~~+~~2~HX~~\rightarrow~MX_2~~+~~H_2O~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~and~presumably~Ra; X~=~F,~Cl,~Br,~I)} \nonumber \]
Los metales alcalinotérreos más pesados (Mg a Ba) también reducen el hidrógeno para dar hidruros.
\[\sf{M(s)~~+~~H_2(g)~~\rightarrow~MH_2~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
Como se discute en la sección 8.2.1. Propiedades Químicas del Hidrógeno, estos hidruros alcalinotérreos son sales iónicas de iones hidruro. Así reaccionan con agua y otros electrófilos.
\[\sf{MH_2(s)~~+~~H_2O(l)~~\rightarrow~M(OH)_2~~+~~H_2(g)~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~(M~=~Mg, Ca,~Sr,~Ba,~and~presumably~Ra)} \nonumber \]
El consumo de agua en esta reacción forma la base para el uso del hidruro de calcio como agente secante para disolventes orgánicos.
A diferencia de los metales alcalinotérreos más pesados, el berilio no reacciona directamente con el hidrógeno y el hidruro resultante, aunque aún nucleofílico, actúa como un hidruro covalente polar e hidroliza relativamente lentamente.
Cationes alcalinotérreos divalentes polarizan aniones
El ejemplo clásico de la capacidad de los cationes alcalinotérreos para polarizar aniones implica la descomposición de los carbonatos metálicos. Los carbonatos y nitratos de metales alcalinos se descomponen térmicamente para liberar CO 2 y una mezcla de NO 2 y O 2, respectivamente.
\[\sf{MCO_3(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~CO_2(g)} \nonumber \]
\[\sf{M(NO_3)_2(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~2~NO_2(g)~~+~~O_2(g)} \nonumber \]
Factores complejos gobiernan la descomposición de los nitratos pero, como se muestra en la Tabla\(\sf{\PageIndex{1}}\), la descomposición de los carbonatos alcalinotérreos muestra que al bajar el grupo la descomposición de los carbonatos requiere temperaturas cada vez más altas.
Mesa\(\sf{\PageIndex{1}}\). Temperaturas de descomposición de carbonatos alcalinotérreos
| Carbonato |
Punto medio de descomposición rango 2 (K) |
| BeCo 3 | no reportado; inestable a temperatura ambiente (298 K) |
| MgCo 3 | 903 |
| CaCo 3 | 953 |
| SrCo 3 | 1178 |
| BaCo 3 | 1316 |
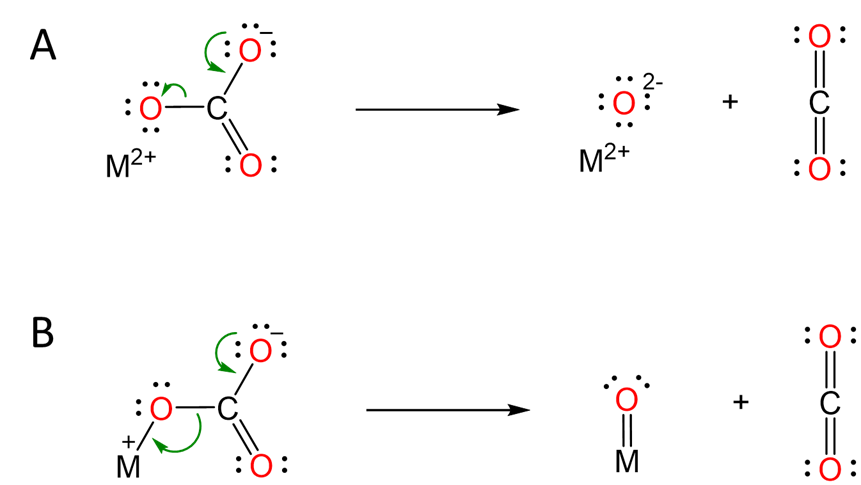
La explicación típica de esta tendencia involucra el mecanismo de descomposición de carbonatos representado en el Esquema\(\sf{\PageIndex{II}}\). A medida que el catión de metal alcalinotérreo se hace más grande al pasar de Be a Ba, su capacidad de polarizar el anión carbonato disminuye, lo que dificulta la formación del óxido.
Esquema\(\sf{\PageIndex{I}}\). Modelos que explican cómo los cationes de metales alcalinotérreos facilitan la descomposición del carbonato (A) Modelo iónico en el que la acumulación de carga negativa se estabiliza por interacción entre la dicación y uno de los oxígenos carbonatados. (B) Representación semicovalente de la misma interacción, ahora representada como un enlace M=O (que no debe considerarse que implica que tal enlace realmente existe).
Los sulfatos de metales alcalinotérreos experimentan reacciones de descomposición similares a las de los carbonatos y nitratos.
- Escribir una reacción de descomposición que implique la liberación de un solo gas molecular del sulfato para dar un óxido.
- Clasificar los sulfatos de metales alcalinotérreos en orden de aumento de temperatura de descomposición.
- Contestar
-
1. Los sulfatos se descomponen liberando SO 3 según la reacción
\[\sf{MSO_4(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~SO_3(g)} \nonumber \]
Tenga en cuenta que otro posible modo de descomposición es
\[\sf{MSO_4(s)~~\overset{\Delta}{\longrightarrow}~MO(s)~~+~~ {\textstyle \frac{1}{2}}~O_2(g)~~+~~SO_2(g)} \nonumber \]
Sin embargo, esa reacción no es la que pide el prompt ya que implica la liberación de dos gases moleculares diferentes (O 2 y SO 2).
2. El orden de descomposición esperado de los sulfatos de metales alcalinotérreos junto con las temperaturas de descomposición conocidas es
\[\sf{\underset{580~^{\circ}C}{BeSO_4}~<~\underset{895~^{\circ}C}{MgSO_4}~<~\underset{1149~^{\circ}C}{CaSO_4}~<~\underset{1374~^{\circ}C}{SrSO_4}~<~BaSO_4~<~RaSO_4} \nonumber \]
El berilio y en menor medida el Magnesio forman compuestos polares altamente covalentes.
La química del magnesio y el berilio demuestra el peligro de establecer una distinción excesivamente rigurosa entre elementos como metales, no metales y metaloides. Esto se debe a que tanto Be como Li pueden formar compuestos con considerable carácter covalente y, como cabría esperar de su relativa escasez de electrones, comparten mucho en común con los metaloides B y Al de la fila 13 deficientes en electrones.
En términos de Mg, la influencia de la covalencia es evidente a partir de las estructuras de los reactivos de Gringard que forma Mg en la reacción entre el metal y los haluros de alquilo.
\[\sf{Mg(s)~~+~~R-X~~\overset{THF, catalytic~I_2}{\longrightarrow}~R-Mg-X} \nonumber \]
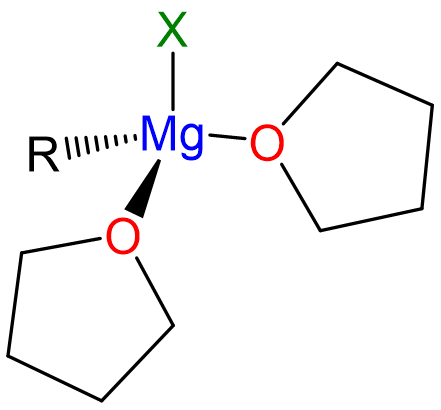
La reacción depende de la presencia de los éteres donantes de base Lewis como Et 2 O o THF, que coordina el Mg 2+, completando su esfera de coordinación, dando complejos tetraédricos como el representado en el Esquema\(\sf{\PageIndex{II}}\).
Esquema\(\sf{\PageIndex{II}}\). Estructura del reactivo monomérico de Grignard “rMgX” en solución de THF.
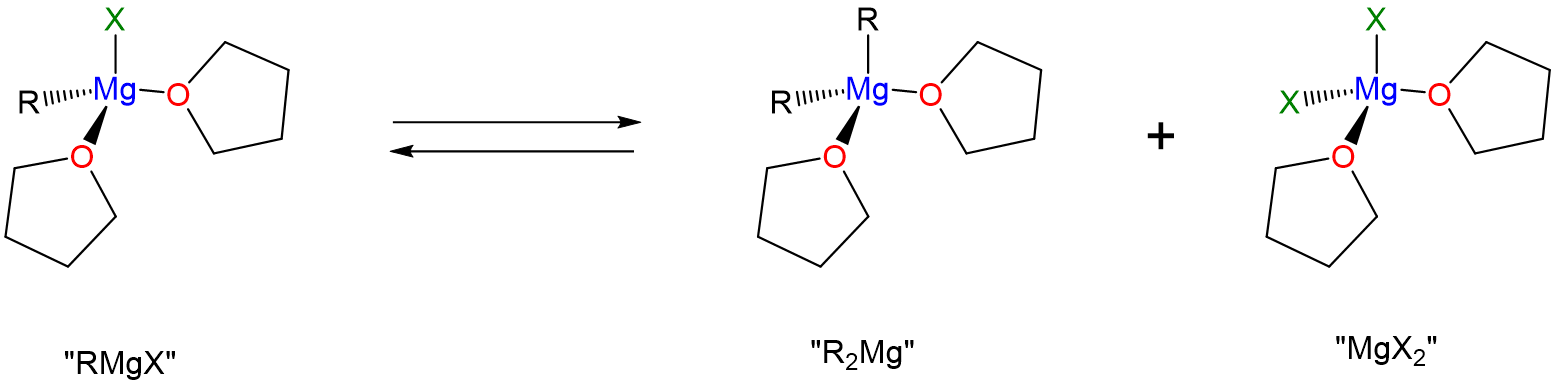
Al igual que los compuestos moleculares, los reactivos de Gringard experimentan reacciones de sustitución de ligandos en solución de acuerdo con el equilibrio de Schlenk.
 \[ \nonumber \]
\[ \nonumber \]
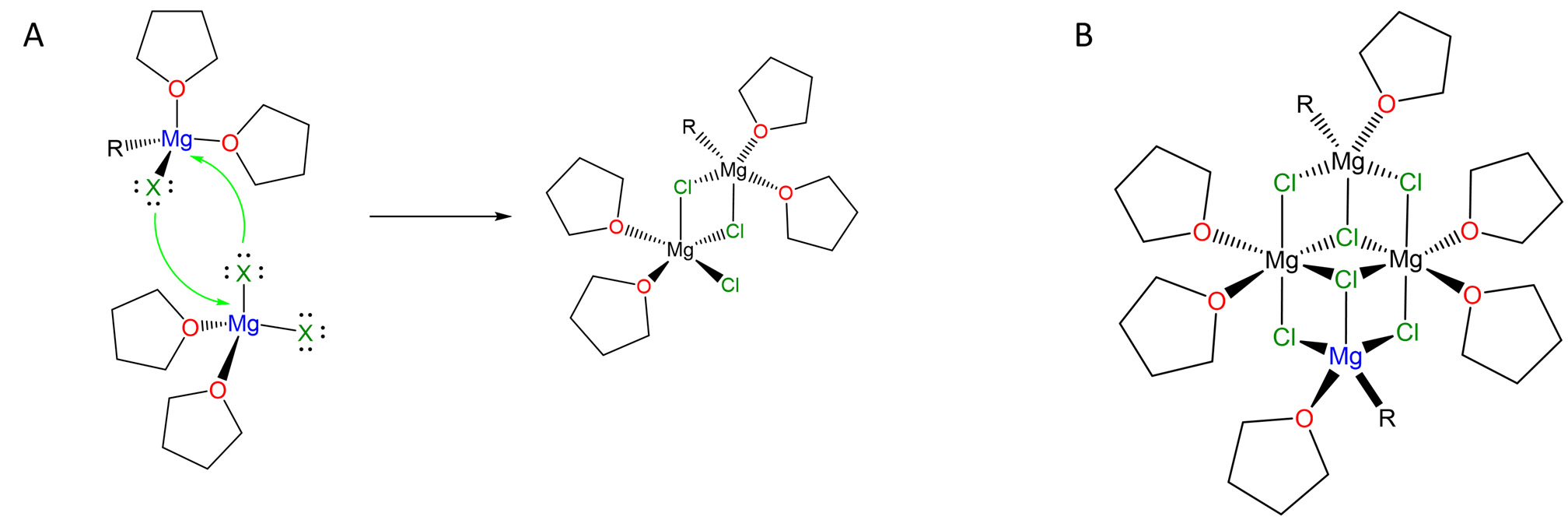
También forman grupos en los que los pares solitarios de halógenos solitarios se utilizan para puentear múltiples centros de Mg, como lo ilustra el complejo en Scheme\(\sf{\PageIndex{III}}\).
Esquema\(\sf{\PageIndex{II}}\). (A) Halógenos como Cl pueden puentear múltiples centros metálicos a través de sus pares solitarios, permitiendo la formación de especies como (B) “(rMgCl) 2 (MgCl 2) 2”. Redibujado a partir de las referencias 4 y 5.
El grado de covalencia es aún mayor en el caso del Berilio, que con un radio de sólo 113 Å y electrones de valencia que experimentan una carga nuclear efectiva de Slater de +1.95 unidades de carga atómica, tiene considerable capacidad para polarizar bases cercanas de Lewis. Como resultado, el berilio tiende a formar enlaces covalentes polares en lugar de iónicos.
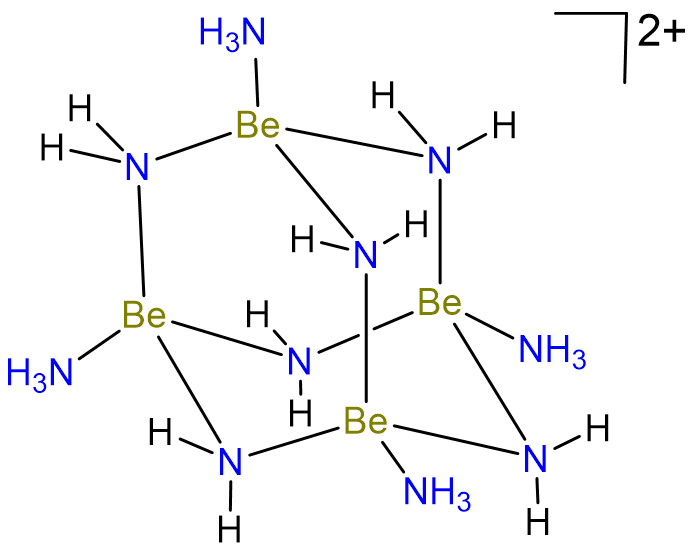
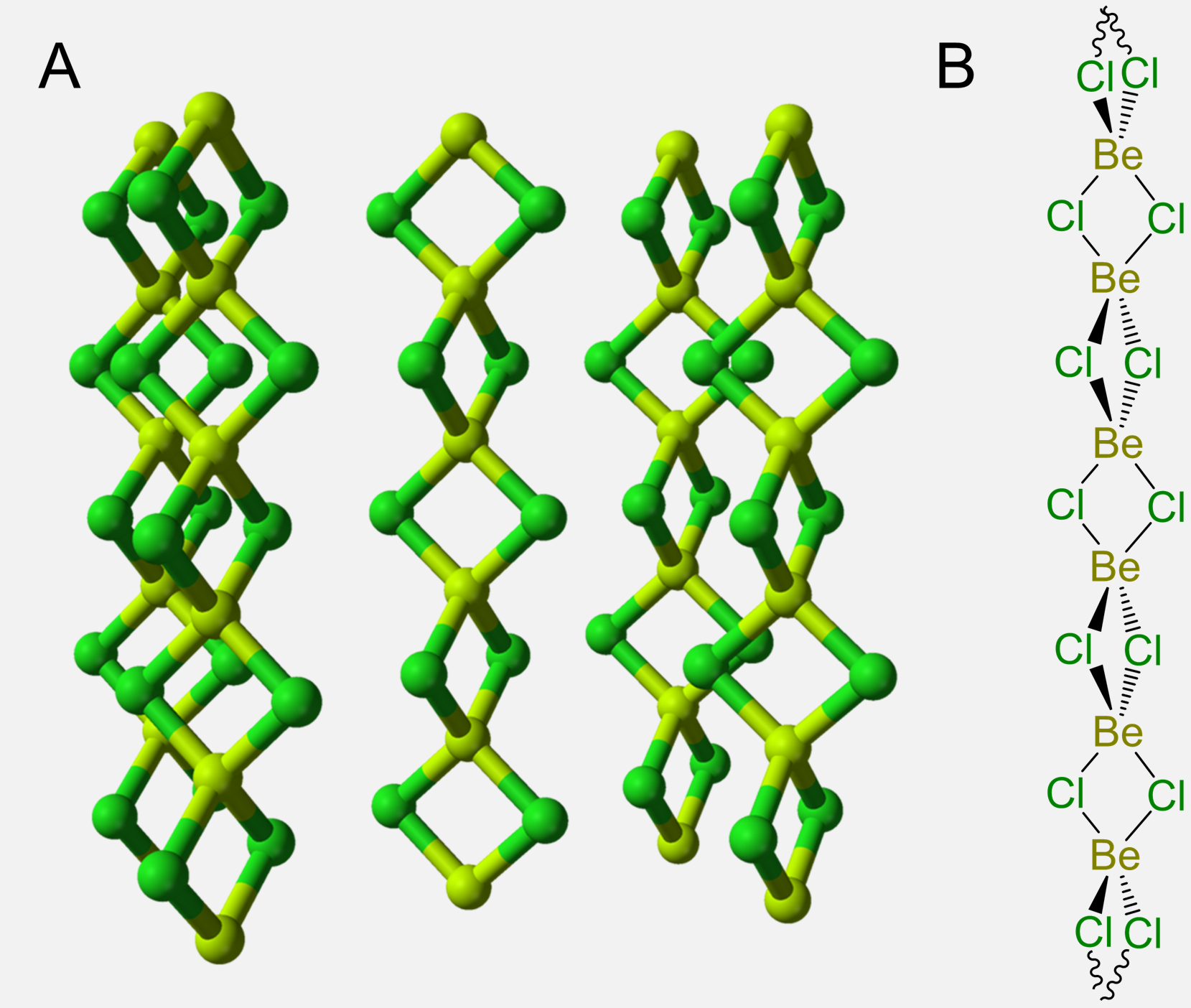
Debido a que el berilio solo posee dos electrones de valencia, sus compuestos también tienden a ser deficientes en electrones y los enlaces Bridging Be-X-Be son comunes. Así, en amoníaco líquido Be forma especies con enlaces Be-N-Be puente como el cúmulo tetramérico que se muestra en el Esquema\(\sf{\PageIndex{III}}\).
Esquema\(\sf{\PageIndex{III}}\). Tetramérico Be cluster formado en amoníaco líquido. Redibujado a partir de la referencia 6.
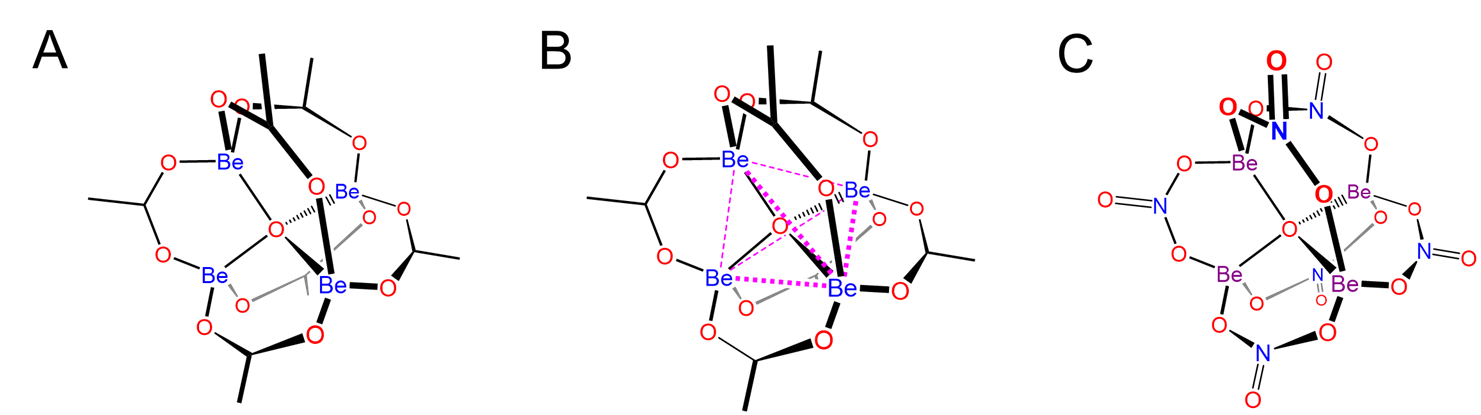
Una estructura particularmente notable es la del acetato de berilio básico en el que un oxígeno central une cuatro átomos de Be, como se muestra en el Esquema\(\sf{\PageIndex{IV}}\) junto con el de Be 4 (NO 3) 6 O, que se cree que posee una estructura anóloga.
Esquema\(\sf{\PageIndex{IV}}\). (A) Estructura del acetato básico de berilio, Be 4 (OAc) 6 O, (B) en el que se circunscribe el tetraedro ObE 4 central para facilitar la visualización de que la estructura consiste en un tetraedro OBe 4 6+ en el que los bordes Be—Be están unidos por puente ligandos de acetato. El zinc forma una estructura análoga y (C) se postula que la estructura de Be 4 (NO 3) 6 O es análoga a la del acetato de berilio básico, con ligandos de nitrato puente que toman el lugar de los acetatos.
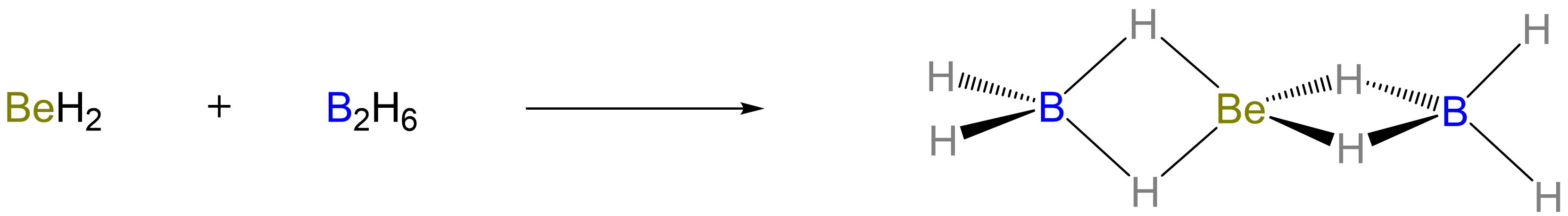
El hidruro de berilio incluso forma un aducto con dos BH 3 para dar la estructura a en la que un Be central está unido a los grupos BH 2 terminales por enlaces Be-H-B de 3-centro-2 electrones, como se muestra en el Esquema\(\sf{\PageIndex{V}}\). 7
Esquema\(\sf{\PageIndex{V}}\). Formación de un aducto entre BeH 2 y dos BH 3 (en forma de B 2 H 6).
Referencias y Notas
1. Petrocelli, A.W. Superóxidos. En la Enciclopedia de Química de Van Nostrand, G.D. Considine (Ed.). Wiley, 2005. doi: 10.1002/0471740039.vec2421
2. El punto medio del rango de descomposición para MgCo 3, CaCo 3, SrCo 3 y BaCo 3 se calculan a partir de los datos reportados en Maitra, S., Chakrabarty, N., & Pramanik, J.. Cerâmica 2008, 54 (331), 268-272.
3. Las temperaturas de descomposición para BeSO 4, MgSO 4, CaSO 4 y SrSO 4 son de Massey, A. G., Química del grupo principal. E. Horwood: Nueva York, 1990, pág. 152.
4. Seyferth, D., Los reactivos Grignard. Organometálicos 2009, 28 (6), 1598-1605.
5. Toney, J.; Stucky, G. D. J. Organomet. Chem. 1971, 28, 5.
6. Müller, M.; Karttunen, A. J.; Buchner, M. R., Especiación de Be 2+ en amoníaco líquido ácido y formación de cúmulos de amido de berilio tetra y octanuclear. Ciencia Química 2020, 11 (21), 5415-5422.
7. La estructura de BeB 2 H 8 también puede considerarse como un aducto entre Be 2+ y dos ligandos BH 4 -.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

