8.7.4: Química del Silicio (Z=14)
- Page ID
- 81520
El silicio, el segundo elemento más abundante en la tierra, es una parte esencial del mundo mineral. Su configuración tetraédrica estable lo hace increíblemente versátil y se usa de diversas maneras en nuestra vida cotidiana. Encontrado en todo, desde naves espaciales hasta partes sintéticas del cuerpo, el silicio se puede encontrar a nuestro alrededor, y a veces incluso en nosotros.
Introducción
El nombre para el silicio se toma del latín silex que significa “pedernal”. El elemento es superado solo por el oxígeno en abundancia en la corteza terrestre y fue descubierto por Berzelius en 1824. El compuesto más común de silicio,\(SiO_2\), es el compuesto químico más abundante en la corteza terrestre, que lo conocemos mejor como arena común de playa.
Propiedades
El silicio es un semimetal cristalino o metaloide. Una de sus formas es brillante, gris y muy quebradiza (se hará añicos cuando se golpee con un martillo). Es un elemento del grupo 14 en el mismo grupo periódico que el carbono, pero químicamente se comporta de manera distintiva de todas sus contrapartes del grupo. El silicio comparte la versatilidad de unión del carbono, con sus cuatro electrones de valencia, pero por lo demás es un elemento relativamente inerte. Sin embargo, bajo condiciones especiales, el silicio se haga para que sea mucho más reactivo. El silicio exhibe propiedades metaloides, es capaz de expandir su capa de valencia y es capaz de transformarse en un semiconductor; distinguiéndolo de sus miembros periódicos del grupo.
| Símbolo | Si |
|---|---|
| Número atómico | 14 |
| Grupo | 14 (Familia Carbon) |
| Configuración de electrones | [Ne] 3s 2 3p 2 |
| Peso atómico | 28.0855 g |
| Densidad | 2.57 g/mL |
| Punto de fusión | 1414 o C |
| Punto de ebullición | 3265 o C |
| Estados de Oxidación | 4, 3, 2, 1, -1, -2, -3, -4 |
| Electronegatividad | 1.90 |
| Isótopos estables | 28 Si 29 Si 30 Si |
Dónde se encuentra el silicio
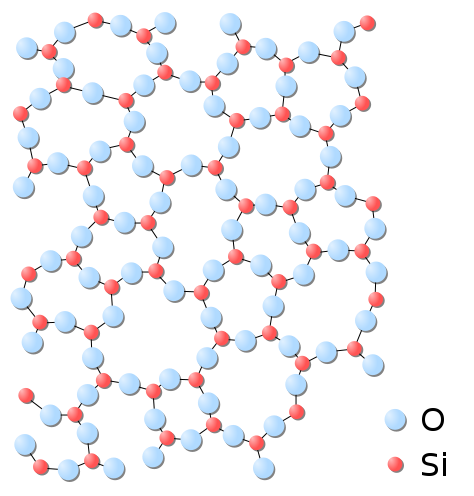
El 27.6% de la corteza terrestre está compuesta por silicio. Aunque es tan abundante, no suele encontrarse en su estado puro, sino su dióxido e hidratos. \(SiO_2\)es el único óxido estable del silicio, y se encuentra en muchas variedades cristalinas. Su forma más pura es el cuarzo, pero también como jaspe y ópalo. El silicio también se puede encontrar en feldespato, micas, olivinos, piroxenos e incluso en agua (Figura 1). En otra forma alotrópica el silicio es un polvo amorfo marrón más familiar en la arena de playa “sucia”. La forma cristalina del silicio es la base de la era de los semiconductores.

Silicatos
El silicio se encuentra más comúnmente en los compuestos de silicato. La sílice es el único óxido estable del silicio, y tiene la fórmula empírica SiO 2. La sílice no es un átomo de silicio con dos dobles enlaces a dos átomos de oxígeno. La sílice está compuesta por un átomo de silicio con cuatro enlaces simples a cuatro moléculas de oxígeno (Figura 2).
El sílice, es decir, el dióxido de silicio, adquiere esta forma molecular, en lugar de la forma característica del dióxido de carbono, porque los orbitales 3p del silicio hacen que sea más energéticamente favorable crear cuatro enlaces simples con cada oxígeno en lugar de hacer dos dobles enlaces con cada átomo de oxígeno. Esto lleva a que los silicatos se unan entre sí en redes -Si-O-Si-O- llamadas silicatos. La forma empírica de la sílice es SiO 2 porque, con respecto al promedio neto del silicato, cada átomo de silicio tiene dos átomos de oxígeno.
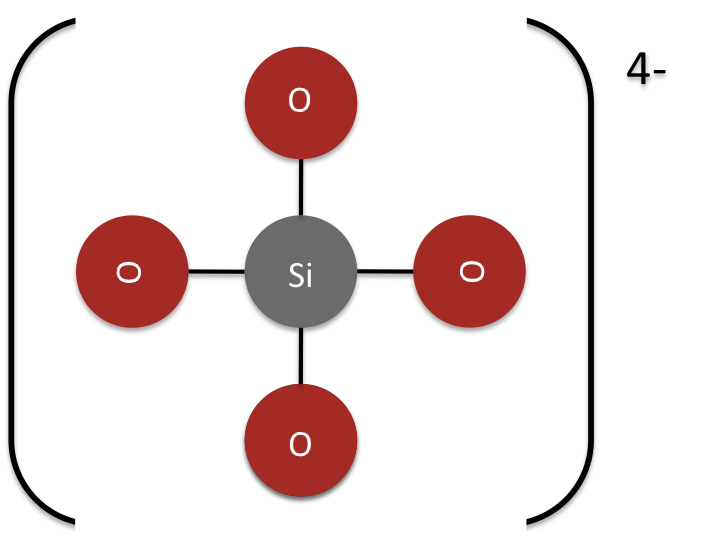
El complejo tetraédrico SiO 4 4 - (ver Figura 3), la unidad central de los silicatos, puede unirse de diversas maneras, creando una amplia gama de minerales. El silicio es un componente integral en los minerales, así como el carbono es un componente esencial de los compuestos orgánicos.
Neosilicatos
En los nesosilicatos el silicato tetraédrico no comparte ninguna molécula de oxígeno con otros tetraedros de silicato, y en su lugar equilibra su carga con otros metales. La estructura central del neosilicato es simplemente una unidad de sílice tetraédrica solitaria (Figura 4). La fórmula empírica para la estructura central de un neosilicato es SiO 4 4-.

Los neosilicatos conforman las franjas externas de un grupo de minerales conocidos como olivinos.
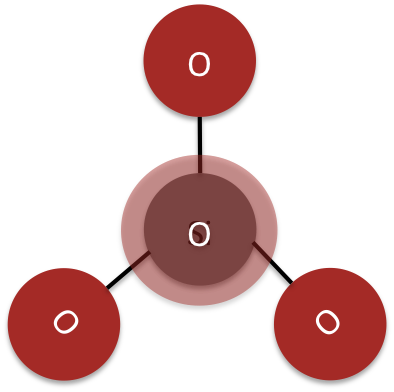
Sorosilicatos
En los sorosilicatos dos tetraedros de silicato se unen compartiendo un átomo de oxígeno en una de sus esquinas. La estructura central de un sorosilicato es un par de tetraedros de sílice. (ver Figura 5)
El mineral thortveitie es un ejemplo de un complejo de sorosilicato.
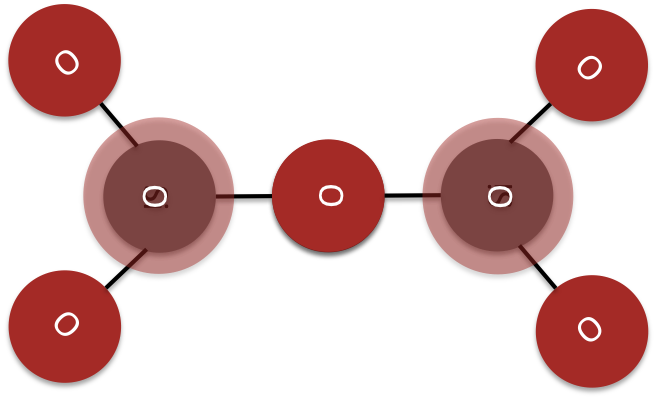
Ciclosilicatos
En los ciclosilicatos tres o más tetraedros de sílice comparten dos esquinas de un átomo de oxígeno. La estructura central de un ciclosilicato es un anillo cerrado de tetraedros de sílice. (ver Figura 6)
El berilo mineral es un ejemplo de un complejo de ciclosilicato.
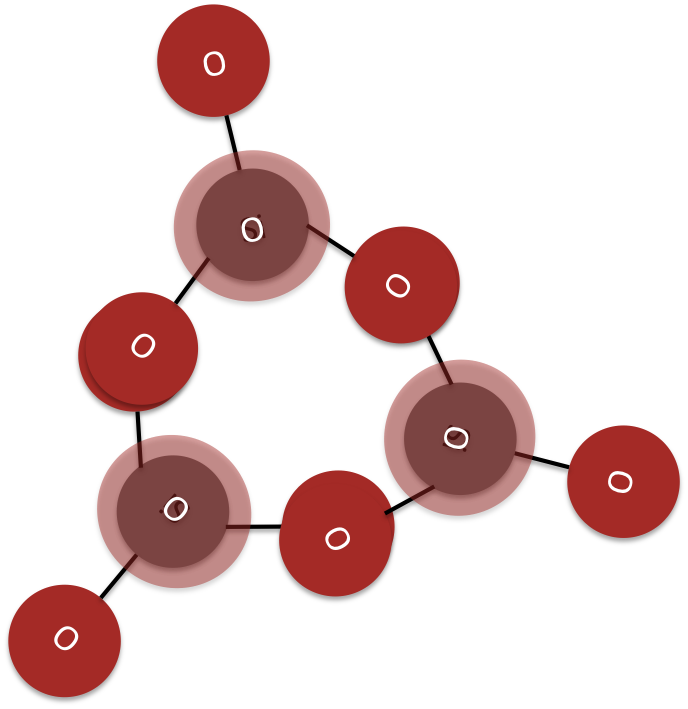
Inosilicatos
Los inosilicatos son complejos donde cada tetraédrico comparte dos esquinas con otro tetraédrico de sílice para crear una sola cadena (ver Figura 7) o tres esquinas para crear una doble cadena (Figura 8). La estructura central de un inosilicato es una cadena infinita simple o doble de tetraedros de silca.
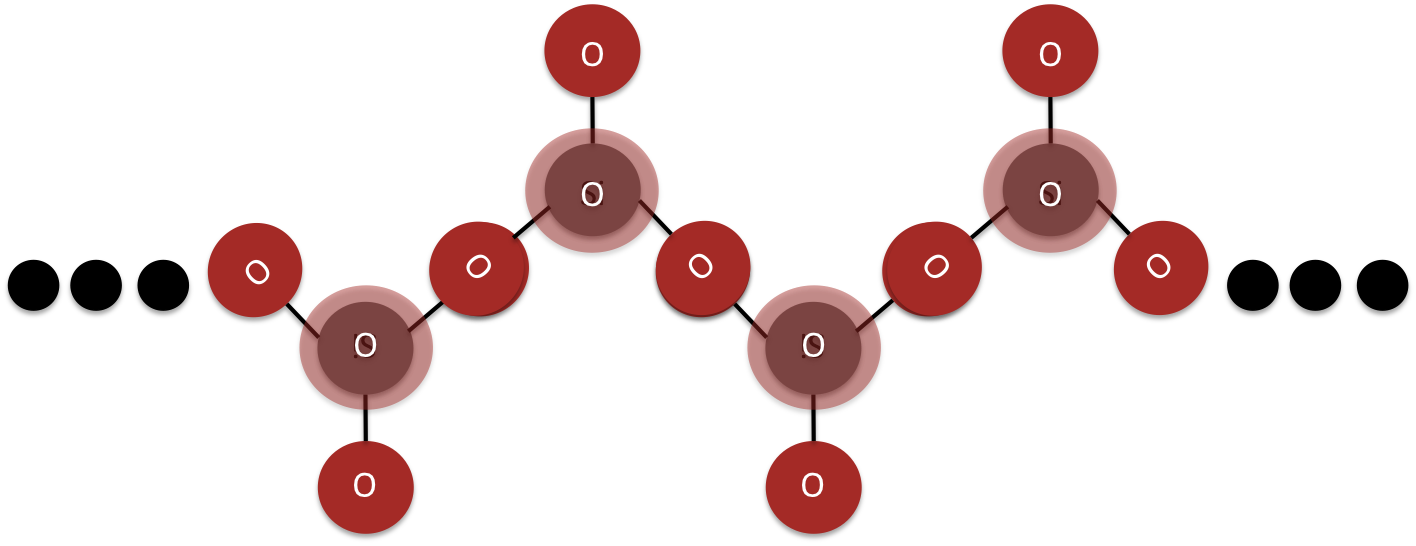
El grupo mineral piroxenos son ejemplos de inosilicatos de cadena sencilla.
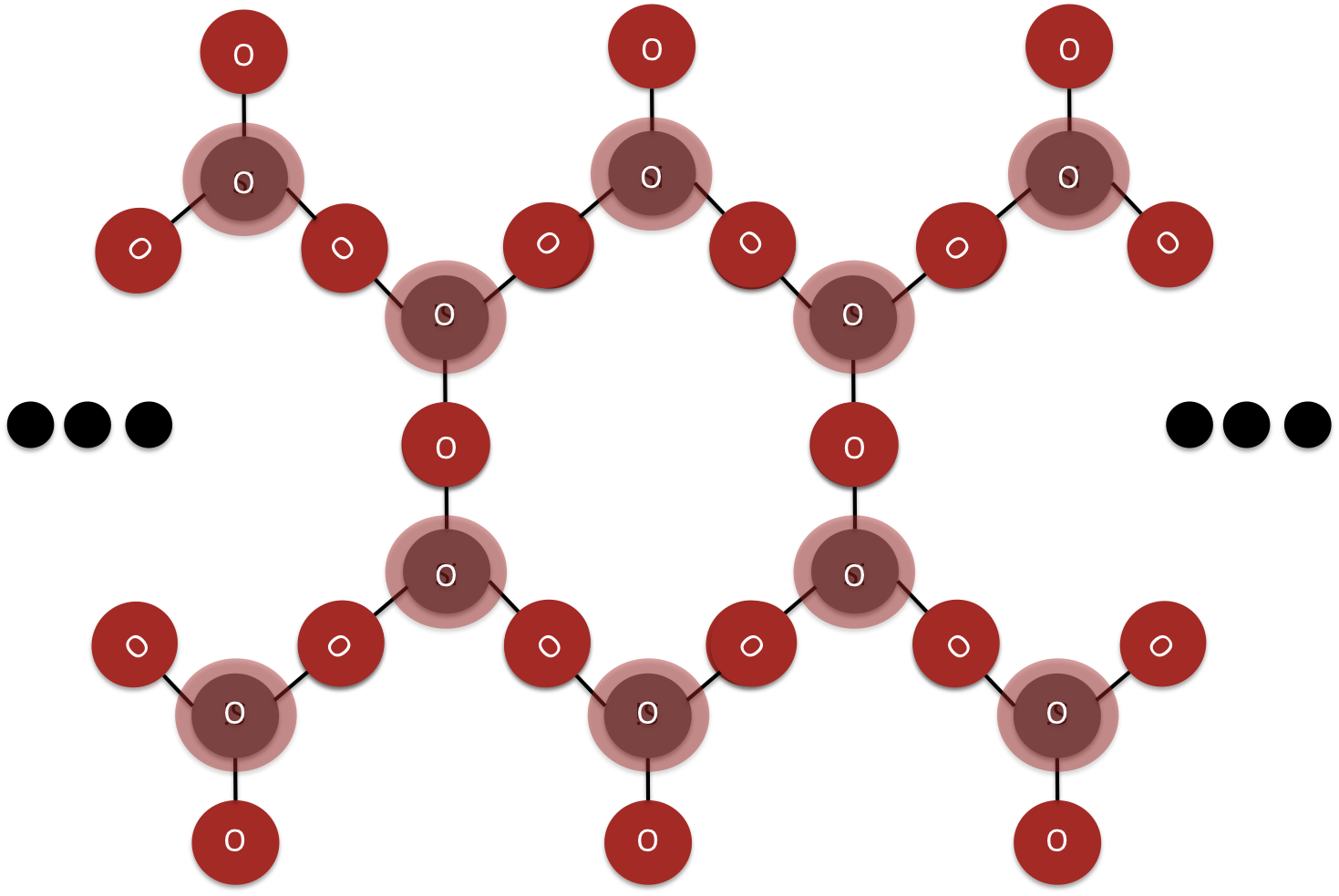
Figura 8: El núcleo de un inosilicato de doble cadena
El anfíbol mineral es un ejemplo de inosilicato de doble cadena.
Filosilicatos
Los filosilicatos son complejos de sílice donde cada tetradedral comparte tres esquinas y crea una lámina de silicio y oxígeno. (ver Figura 9) El complejo central de un filosilicato es una lámina infinita de tetraedros de sílice conectados.

El talco mineral es un ejemplo de un complejo de filosilicato.
Tectosilicatos
Los tectosilicatos son estructuras tridimensionales de silicato. La estructura central de un tectosilicato es una red infinita de tetraedros de sílice conectados. (ver Figura 10)
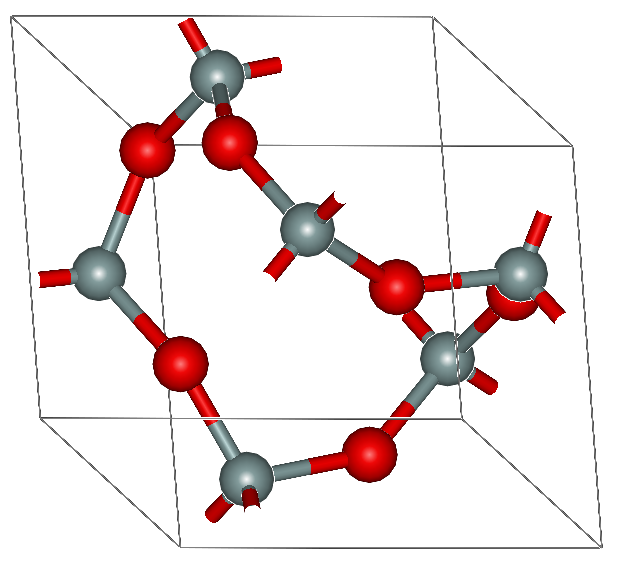
El cuarzo mineral es un ejemplo de un complejo de tectosilicato.
Aunque muchos complejos de sílice forman sólidos covalentes de red, el cuarzo es un ejemplo particularmente bueno de un sólido de red. Los silicatos en general comparten las propiedades de los sólidos covalentes, y esta gama afiliada de propiedades los hace muy útiles en la industria moderna.
Silanes
Los silanos son compuestos de silicio-hidrógeno. Los compuestos carbono-hidrógeno forman la columna vertebral del mundo viviente con cadenas aparentemente interminables de hidrocarburos. Con la misma configuración de valencia y, por lo tanto, la misma versatilidad química, el silicio podría desempeñar un papel de importancia orgánica similar. Pero el silicio no juega un papel integral en nuestra biología del día a día. Una de las principales razones subyace a esto.
Al igual que los hidrocarburos, los silanos crecen progresivamente en tamaño a medida que se agregan átomos de silicio adicionales. Pero hay un final muy rápido a esta tendencia. El silano más grande tiene un máximo de seis átomos de silicio. (ver Figura 11)
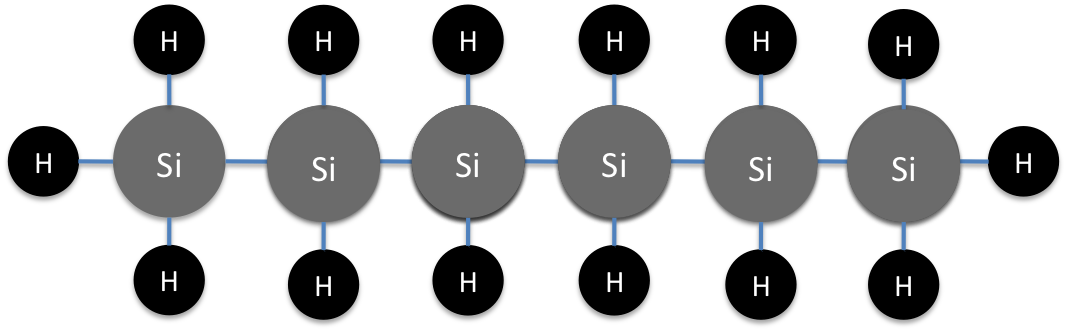
El hexasilanos es el silano más grande posible porque los enlaces Si-Si no son particularmente fuertes. De hecho, los silanos son bastante propensos a la descomposición. Los silanos son particularmente propensos a la descomposición a través del oxígeno. Los silanos también tienen tendencia a intercambiar hidrógenos por otros elementos y convertirse en organosilanos. (ver Figura 12)
Los silanos tienen una variedad de usos industriales y médicos. Entre otras cosas, los silanos se utilizan como repelentes al agua y selladores.
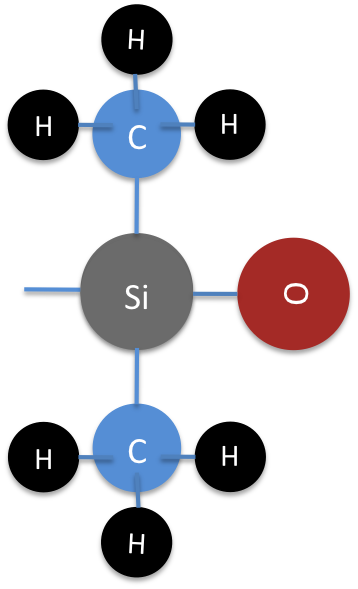
Siliconas
Las siliconas son un compuesto de silicio sintético, no se encuentran en la naturaleza. Cuando se hacen silanos específicos para someterse a una reacción específica, se convierten en silicona, un complejo de silicio muy especial. La silicona es un polímero y es apreciada por su versatilidad, durabilidad a la temperatura, baja volatilidad, resistencia química general y estabilidad térmica. La silicona tiene una estructura química única, pero comparte algunos elementos estructurales centrales tanto con silicatos como con silanos. (Ver Figura 13)
Los polímeros de silicona se utilizan para una gran variedad de cosas. Entre otras muchas cosas, los implantes mamarios están hechos de silicona.
Halouros de Silicio
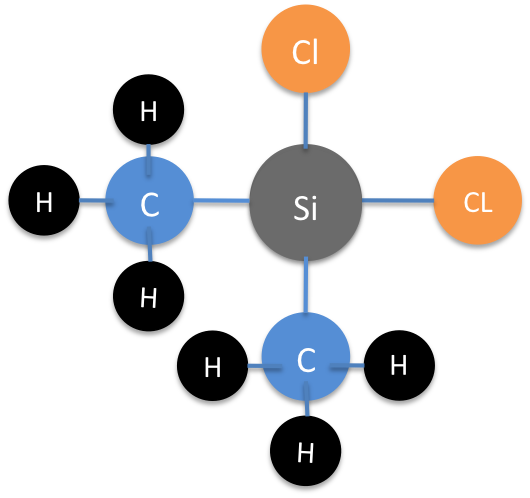
El silicio tiene una tendencia a reaccionar fácilmente con halógenos. La fórmula general que representa esto es SiX 4, donde X representa cualquier halógeno. El silicio también puede expandir su caparazón de valencia, y la preparación de laboratorio de [SiF 6] 2- es un ejemplo definitivo de ello. Sin embargo, es poco probable que el silicio pueda crear tal complejo con cualquier otro halógeno que no sea flúor, porque seis de los iones halógenos más grandes no pueden encajar físicamente alrededor del átomo de silicio central.
Los haluros de silicio se sintetizan para purificar complejos de silicio. Los haluros de silicio se pueden fabricar fácilmente para renunciar a su silicio a través de reacciones químicas específicas que dan como resultado la formación de silicio puro.
Aplicaciones
El silicio es un componente vital de la industria moderna. Su abundancia la hace aún más útil. El silicio se puede encontrar en productos que van desde el concreto hasta los chips de computadora.
Electrónica
La adopción por sectores de alta tecnología del título Silicon Valley subraya la importancia del silicio en la tecnología moderna. El silicio puro, que es esencialmente silicio puro, tiene la capacidad única de poder controlar discretamente el número y la carga de la corriente que pasa a través de él. Esto hace que el silicio desempeñe un papel de suma importancia en dispositivos como transistores, células solares, circuitos integrados, microprocesadores y dispositivos semiconductores, donde dicho control de corriente es una necesidad para un rendimiento adecuado. Los semiconductores ejemplifican el uso del silicio en la tecnología contemporánea.
Semiconductores
Los semiconductores son materiales únicos que no tienen la conductividad eléctrica de un conductor ni de un aislante. Los semiconductores se encuentran en algún lugar entre estas dos clases dándoles una propiedad muy útil. Los semiconductores son capaces de manipular la corriente eléctrica. Se utilizan para rectificar, amplificar y conmutar señales eléctricas y, por lo tanto, son componentes integrales de la electrónica moderna.
Los semiconductores pueden estar hechos de una variedad de materiales, pero la mayoría de los semiconductores están hechos de silicio. Pero los semiconductores no están hechos de silicatos, ni silanos, o siliconas, están hechos de silicio puro, es decir, esencialmente cristal de silicio puro. Al igual que el carbono, el silicio puede hacer un diamante como el cristal. Esta estructura se llama celosía de silicio. (ver Figura 15) El silicio es perfecto para hacer esta estructura reticular porque sus cuatro electrones de valencia le permiten unirse demasiado perfectamente a cuatro de sus vecinos de silicio.
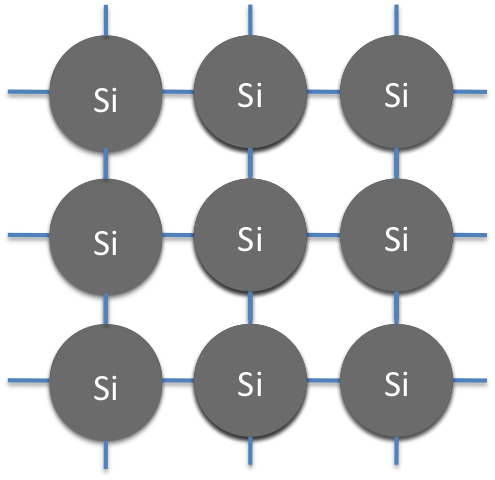
Sin embargo, esta red de silicio es esencialmente un aislante, ya que no hay electrones libres para ningún movimiento de carga, y por lo tanto no es un semiconductor. Esta estructura cristalina se convierte en un semiconductor cuando es dopada. El dopaje se refiere a un proceso mediante el cual las impurezas se introducen en silicio ultra puro, cambiando así sus propiedades eléctricas y convirtiéndolo en un semiconductor. El dopaje convierte el silicio puro en un semiconductor al agregar o eliminar una cantidad muy pequeña de electrones, lo que lo convierte en un aislante ni un conductor, sino un semiconductor con conducción de carga limitada. La sutil manipulación de celosías de silicio puro a través del dopaje genera la amplia variedad de semiconductores que requiere la tecnología eléctrica moderna.
Los semiconductores están hechos de silicio por dos razones fundamentales. El silicio tiene las propiedades necesarias para fabricar semiconductores, y el silicio es el segundo elemento más abundante en la tierra.
Gafas
El vidrio es otro derivado de silicio que es ampliamente utilizado por la sociedad moderna. Si la arena, un depósito de sílice, se mezcla con carbonato de sodio y calcio a temperaturas cercanas a los 1500 grados Celsius, cuando el producto resultante se enfría, se forma vidrio. El vidrio es un estado particularmente interesante de silicio. El vidrio es único porque representa una forma sólida no cristalina de silicio. Los elementos tetraédricos de sílice se unen entre sí, pero en ningún patrón fundamental detrás de la unión. (ver Figura 16)
El resultado final de esta estructura química única es el material a menudo frágil típicamente ópticamente transparente conocido como vidrio. Este complejo de sílice se puede encontrar prácticamente en cualquier lugar donde se encuentre la civilización humana.
El vidrio puede contaminarse agregando impurezas químicas a la estructura basal de sílice. (ver Figura 17) La adición de incluso un poco de Fe 2 O 3 al vidrio de sílice puro le da al vidrio mixto resultante un color verde distintivo.

Figura 17: Sílice no cristalina con impurezas desconocidas
Fibra Óptica
Los cables de fibra óptica modernos deben transmitir datos a través de señales de luz no distorsionadas a grandes distancias. Para llevar a cabo esta tarea, los cables de fibra óptica deben estar hechos de vidrio especial de ultra alta pureza. El secreto detrás de este vidrio de ultra alta pureza es la sílice ultra pura. Para que los cables de fibra óptica cumplan con los estándares operativos, los niveles de impurezas en la sílice de estos cables de fibra óptica se han reducido a partes por mil millones. Este nivel de pureza permite la vasta red de comunicaciones que nuestra sociedad ha llegado a dar por sentada.
Cerámica
El silicio juega un papel integral en la industria de la construcción. El silicio, específicamente la sílice, es un ingrediente principal en componentes de construcción como ladrillos, cemento, cerámica y baldosas.
Adicionalmente, los silicatos, especialmente el cuarzo, son muy estables termodinámicamente. Esto se traduce en cerámicas de silicio que tienen alta tolerancia al calor. Esta propiedad hace que la cerámica de silicio sea particularmente útil desde cosas que van desde cascos de naves espaciales hasta componentes de motores. (ver Figura 18)
 Las cerámicas de sílice en la parte inferior de la órbita se utilizan para la rentry
Las cerámicas de sílice en la parte inferior de la órbita se utilizan para la rentry
Polímeros
Los polímeros de silicona representan otra faceta de la utilidad del silicio. Los polímeros de silicona generalmente se caracterizan por su flexibilidad, resistencia al ataque químico, impermeabilidad al agua y su capacidad para retener sus propiedades tanto a altas como bajas temperaturas. Esta serie de propiedades hace que los polímeros de silicona sean muy útiles. Los polímeros de silicona se utilizan en aislamiento, utensilios de cocina, lubricantes de alta temperatura, equipos médicos, selladores, adhesivos e incluso como alternativa al plástico en los juguetes.
Producción
Como el silicio no se encuentra normalmente en su estado puro, el silicio debe extraerse químicamente de sus compuestos naturales. La sílice es la forma más prevalente de silicio natural. La sílice es un compuesto fuertemente unido y requiere una gran cantidad de energía para extraer el silicio del complejo de sílice. El principal medio de esta extracción es a través de una reacción química a una temperatura muy alta.
La síntesis de silicio es fundamentalmente un proceso de dos etapas. Primero, use un horno potente para calentar la sílice a temperaturas superiores a 1900 grados centígrados y, en segundo lugar, agregue carbono. A temperaturas superiores a 1900 grados centígrados, el carbono reducirá el compuesto de sílice a silicio puro.
Purificación
Para algunas aplicaciones de silicio, la pureza del silicio recién producido no es satisfactoria. Para satisfacer la demanda de silicio de alta pureza, se han ideado técnicas para refinar aún más la pureza del silicio extraído.
La purificación del silicio implica esencialmente tomar silicio sintetizado, convertirlo en un compuesto de silicio que se puede destilar fácilmente, y luego romper este nuevo compuesto de silicio formado para producir un producto de silicio ultra puro. Hay varios métodos de purificación distintos disponibles, pero la mayoría de las formas químicas de purificación involucran complejos tanto de silano como de haluro de silicio.
Trivia
- El silicio es el octavo elemento más abundante del universo.
- El silicio se identificó por primera vez en 1787 pero se descubrió por primera vez como un elemento 1824.
- El silicio es un elemento importante en el metabolismo de las plantas, pero no muy importante en el metabolismo de los animales.
- El silicio es inofensivo para ingerir e inyectar en el cuerpo pero es dañino inhalar.
- Silicosis es el nombre de la enfermedad asociada con la inhalación excesiva del compuesto de silicio sílice. Aflicta principalmente a los trabajadores de la construcción.
- El sílice es un componente químico importante del asbesto.
Referencias
- Krasnoshchekov, V.V. y LV Myshlyaeva. Química Analtica del Silicio. Nueva York: Halsted Press, 1974. p. 1-6.
- Rochow, Eugene G. Silicio y Siliconas. Nueva York: Springer-Verlag, 1987. prefacio y p 1-30
- Campion, Gillis y Oxtoby. “Principios de la Química Moderna”. 6a Ed. Belmont, CA: Thomson Brooks/Cole.
- Petrucci, Ralph H., Harwood, William S., Herring, F. G., y Madura Jeffrey D. “Química general: principios y aplicaciones modernas”. 9a ed. Nueva Jersey: Pearson Education, Inc., 2007.
Problemas
Destacar área junto a “Ans” para ver respuesta
¿Cuántos óxidos tiene el Silicio y cuáles son?
Ans: 1 óxido O 2
¿Cómo equilibra un silicato tetraédrico su carga si no se une con otro silicato?
Ans: Por bondin g a metales con carga positiva.
El carbono es a compuestos orgánicos ya que la sílice es para:
Ans: minerales
¿Qué tan grande es el compuesto de silicio-hidrógeno más grande?
Respuesta: El silano más grande es el hexasilanos, con seis átomos de silicio y catorce hidrógenos.
¿Por qué es importante el silicio para las computadoras?
Respuesta: Se utiliza para hacer semiconductores.
Colaboradores y Atribuciones
- Thomas Bottyan (2010), Christina Rabago (2008)

