8.7.4.2: Silicio y Elementos del Grupo 14
- Page ID
- 81529
Objetivos de aprendizaje
- Predecir algunas reacciones químicas para un conjunto de condiciones.
- Describir algunas propiedades químicas y físicas de\(\ce{C}\) y\(\ce{Si}\).
Grupo 14 Elementos C, Si, Ge, Sn, Pb
Los elementos del grupo 14 juegan papeles más importantes en nuestras vidas y nuestra civilización que los elementos de cualquier otro grupo. Así, toda persona educada debe saber algo de ellos.
- Carbono - El elemento de la química orgánica y la vida.
- Silicio - El elemento de la tecnología de la información.
- Germanio - El elemento de la base del transistor.
- Estaño y plomo - Elementos conocidos por los alquimistas.
Química del Carbono
El carbono existe como diamante, grafito, fullerenos y carbón. Sus estructuras son interesantes; también lo son sus propiedades. Probablemente se sabe mucho sobre el diamante y el grafito, pero los fullerenos fueron descubiertos después de 1970, y este descubrimiento ha abierto la puerta a muchas investigaciones interesantes. Lee sobre ellos en libros, revistas y revistas. Quizá algún día te encuentres trabajando con ellos.
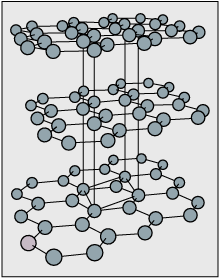
Entre los fullerenos, una de las “moléculas” más comunes tiene 60\(\ce C\) átomos, y está representada por\(\ce{C60}\); aquí se muestra un diagrama. Si conecta los 60 átomos de carbono con enlaces, la estructura parece una jaula con anillos de 5 y 6 miembros. La síntesis, la unión, la simetría y la estabilidad de los fullerenos en forma de jaula ya han atraído mucha atención, y sus propiedades son aún más fascinantes.

En cuanto a los compuestos de carbono, ya se sabe algo\(\ce{CO2}\) e\(\ce{CO}\) incluye sus roles en el medio ambiente. Los carburos duros como\(\ce{Fe3C}\),\(\ce{WC}\), y\(\ce{TiC}\) son más interesantes para los científicos e ingenieros de materiales por su aplicación en herramientas de corte. El carburo de calcio\(\ce{CaC2}\) producido por la reducción\(\ce{CaO}\) por carbono fue un bien valioso a la vez debido a su reacción con agua para dar gas acetileno:
\(\ce{CaC_2 + 2 H_2O \rightarrow Ca(OH)_2 + C_2H_{2\large{(g)}}}\)
El acetileno es un gas industrial importante, para la fabricación de polímeros.
Silicio
¿Sabes que:
- \(\ce{Si}\)comprende 27.7% de la corteza terrestre?
- silicatos, minerales a\(\ce{SiO2}\) base, ¿están en todas partes?
- \(\ce{Si}\)es un elemento esencial para el crecimiento óseo?
- \(\ce{Si}\)los cristales son las bases de los chips de computadora?
- la estructura de\(\ce{Si}\) es la misma que la del diamante, y esta característica es importante para los chips de computadora?
- ¿Cómo convertimos\(\ce{SiO2}\) en\(\ce{Si}\) elemento?
Silicatos
En peso, el silicio es el elemento más abundante en la corteza terrestre. Por lo general existe en forma de óxido,\(\ce{SiO2}\). Esta fórmula no hace justicia para representar tantos materiales diferentes que llamamos silicatos, pero estas sustancias sí lo son\(\ce{SiO2}\). Algunos de los minerales contienen impurezas.
En forma pura,\(\ce{SiO2}\) es cuarzo. Pequeñas partículas de cuarzo son arena. Ellos son duros. En la estructura a nivel atómico, cada átomo de silicio está unido a 4 átomos de oxígeno, y cada oxígeno está unido a dos\(\ce{Si}\) átomos. Los cuatro\(\ce{Si-O}\) enlaces apuntan hacia las esquinas de un tetraedro, al igual que los\(\ce{C-C}\) enlaces en la estructura de diamante. Cuando la impureza está presente, el cuarzo puede estar coloreado. Debido a diversos arreglos de los\(\ce{Si-O-Si}\) bonos, la misma sustancia aparece en muchas formas.
Una unidad básica de estructuras de silicato es\(\ce{SiO4^4-}\). La piedra preciosa circón tiene una fórmula\(\ce{ZrSiO4}\), y el olivino tiene una fórmula química de\(\ce{(MgFe)2SiO4}\). Dos\(\ce{SiO4^4-}\) unidades se combinan para dar la unidad de pirosilicato\(\ce{Si2O7^6-}\), y aparece en acermanita,\(\ce{Ca2MgSi2O7}\). Cuando aumenta el número de unidades, las unidades tetraédricas se combinan para formar anillos, cadenas, capas y redes tridimensionales. Así, la estructura y clasificación del silicato es una parte importante de los minerales. (Este sitio tiene algunas fotos interesantes.)
Silicio y Silano
El silicio elemental se puede obtener a partir de la reducción de silicatos. La reducción de la arena,\(\ce{SiO2}\) por carbono a 3300 K en la reacción,
\(\ce{SiO_2 + 2 C \rightarrow Si_{\large{(l)}} + 2 CO} \;\;\; \textrm{at 3300 K}\)
da silicio líquido. El silicio así obtenido no suele ser puro, y para la industria informática, el elemento debe ser purificado. El crecimiento cristalino y la fabricación de silicio dominan la industria en las décadas de 1980 y 1990, y tal vez en el próximo siglo, y la producción del elemento es solo el comienzo del proceso.
Si se forma un elemento más reactivo\(\ce{Mg}\),,\(\ce{Mg2Si}\) en la reducción,
\(\ce{SiO_2 + 4 Mg \rightarrow Mg_2Si + 2 MgO}\)
\(\ce{Mg2Si}\)es un compuesto, y reacciona con el agua para formar silano.
Silano\(\ce{SiH4}\),, se puede producir por reacción\(\ce{Mg2Si}\) con ácidos
\(\ce{Mg_2Si + 4 H_2O \rightarrow 2 Mg(OH)_2 + SiH_4}\)
y\(\ce{SiH4}\) se enciende cuando entra en contacto con el aire, mucho más reactivo que el metano,
\(\ce{SiH_4 + O_2 \rightarrow SiO_2 + H_2O}\)
En una solución básica,\(\ce{SiH4}\) reacciona con agua para dar\(\ce{SiO(OH)3-}\),
\(\ce{SiH_4 + OH^- + 3H_2O \rightarrow SiO(OH)_3^- + 4 H_2}\)
Halouros de Silicio
El tetrafluoruro de silicio se forma cuando el vidrio (\(\ce{SiO2}\)) se expone a\(\ce{HF}\), y cuando\(\ce{Si}\) reacciona con\(\ce{F2}\),
\(\ce{SiO2 + 4 HF_{\large{(aq)}} \rightarrow 2 H2O + SiF_{4\large{(g)}}}\)
\(\ce{Si + 2 F2 \rightarrow SiF_{4\large{(g)}}}\)
Cuando el cloro pasa a través de la arena caliente (\(\ce{SiO2}\)) y el carbono,\(\ce{SiCl4}\) se produce,
\(\ce{SiO2 + Cl + 2 C2 \rightarrow 2CO + SiCl_{4\large{(g)}}}\)
\(\ce{SiCl4}\)y\(\ce{SiF4}\) reaccionar con agua para dar ácido silícico,
\(\ce{SiCl4 + 4H2O \rightarrow 4 HCl + Si(OH)_{4\large{(aq)}}}\),
\(\ce{SiF4 + 4H2O \rightarrow 4 HF + Si(OH)_{4\large{(aq)}}}\).
Polímeros de silicona
Las siliconas son polímeros con fórmula general\(\mathrm{(R_2SiO_2)_{\large n}}\) o\(\mathrm{(RSiO_3)_{\large n}}\), (\(\ce{R}\)=\(\ce{CH3}\),\(\ce{C2H5}\),\(\ce{C6H5}\), etc). La cadena se mantiene unida por\(\ce{Si-O-Si}\) enlaces. Una simple es\(\mathrm{((CH_3)_2SiO_2)_{\large n}}\),
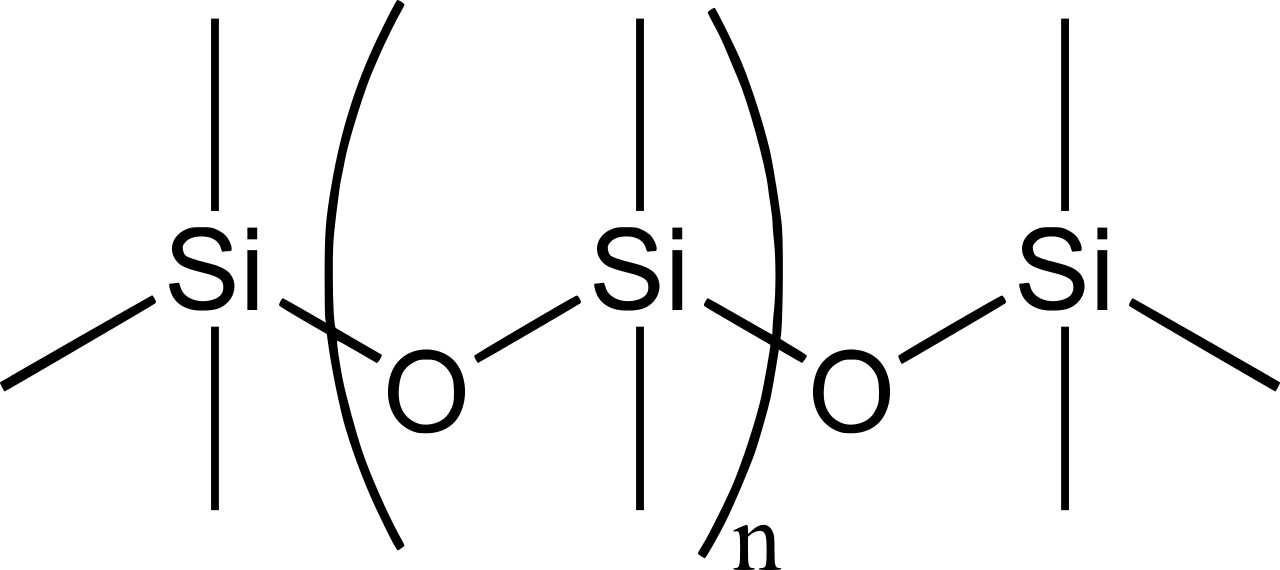
Figura 2: Estructura química del polidimetilsiloxano de silicona (PDMS).
Por supuesto, los 4 enlaces alrededor del\(\ce{Si}\) atoms point to the corners of a tetrahedron. These siloxane polymers are widely used as sealants, adhesives, additives, flame retardants, and lubricants. They have a wide application in industries. Depending on the organic group attached to silicon, the inorganic polymer Silicones has been an important class of materials.
Questions
- Which one lists the group 14 elements in order of increasing atomic weight?
- \(\textrm{B Al Ga In Tl}\)
- \(\textrm{C Si Ge Sn Pb}\)
- \(\textrm{N P As Sb Bi}\)
- \(\textrm{O S Se Te Po}\)
- \(\textrm{F Cl Br I At}\)
- Which allotrope of carbon is the hardest: diamond, graphite, or fullerenes?
- What compound of carbon reacts with water to give acetylene gas?
- When you want to extract silicon element, what do you use to reduce the sand: \(\ce{SiO2}\), \(\ce{C}\) or \(\ce{Mg}\)?
- Which is stable towards air: methane or silane?
- Give the name of polymers whose chains are held together by \(\ce{Si-O-Si}\) bonds.
- In the crystal structure of \(\ce{Si}\), how many other \(\ce{Si}\) atoms are connected to a particular \(\ce{Si}\) atom?
Solutions
- Answer b
Hint...
Knowing the groups of elements enables us to correlate their chemical properties. Each list of choices is a group of elements on the period table.
a = 3A, b = 14, c = 5A, d = 6A, e = 7A. -
Answer diamond
Hint...
Diamond is the hardest thing in the world. Fullerenes are large molecules consisting of 40 to hundreds of carbon atoms, with \(\mathrm{C_{60}}\) being the most common. -
Answer . . .\(\ce{CaC2}\)
Hint...
The reaction to produce acetylene gas is\(\ce{CaC2 + H2O \rightarrow C2H2 + Ca(OH)2}\)
Acetylene is still an important industrial gas, as raw material for polymers.
-
Answer ...\(\ce{C}\)
Hint...
Carbon or coke is used for silicon metal, because \(\ce{Mg2Si}\) is formed if \(\ce{Mg}\) is used. -
Answer ... methane is stable
Hint...
Methane is the major component of natural gas, and it will not react with air until ignited, whereas silane ignites explosively as soon as it contacts air. -
Answer ...silicones
Hint...
Silicon polymers are an important class of materials invented not too long ago. - Answer ... 4
Hint...
Silicon and diamond have the same crystal structure. The edge of unit cells of \(\ce{Si}\) is larger than that of diamond.

Contributors and Attributions
Chung (Peter) Chieh (Chemistry, University of Waterloo)

