8.9.2: Química del Nitrógeno (Z=7)
- Page ID
- 81568
El nitrógeno está presente en casi todas las proteínas y juega un papel importante tanto en aplicaciones bioquímicas como en aplicaciones industriales. El nitrógeno forma enlaces fuertes debido a su capacidad para formar un triple enlace con su yo y otros elementos. Así, hay mucha energía en los compuestos del nitrógeno. Antes de hace 100 años, poco se sabía sobre el nitrógeno. Ahora, el nitrógeno se usa comúnmente para conservar los alimentos, y como fertilizante.
Introducción
Se encuentra que el nitrógeno tiene 3 o 5 electrones de valencia y se encuentra en la parte superior del Grupo 15 en la tabla periódica. Puede tener 3 o 5 electrones de valencia porque puede unirse en los orbitales exteriores de 2p y 2s. Nitrógeno molecular (\(N_2\)) is not reactive at standard temperature and pressure and is a colorless and odorless gas.
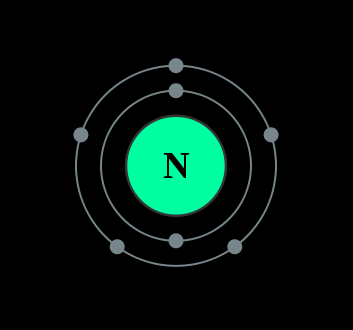
El nitrógeno es un elemento no metálico que se presenta con mayor abundancia en la atmósfera, el gas nitrógeno (N 2) comprende 78.1% del volumen del aire de la Tierra. Sólo aparece en 0.002% de la corteza terrestre en masa. Los compuestos de nitrógeno se encuentran en alimentos, explosivos, venenos y fertilizantes. El nitrógeno constituye el ADN en forma de bases nitrogenadas así como en neurotransmisores. Es uno de los gases industriales más grandes, y se produce comercialmente como gas y líquido.
| Nombre y Símbolo | Nitrógeno, N |
| Categoría | no metálicos |
| Peso atómico | 14.0067 |
| Grupo | 15 |
| Configuración de electrones | 1s 2 2s 2 2p 3 |
| Electrones de valencia | 2, 5 |
| Fase | Gas |
Historia
El nitrógeno, que constituye alrededor del 78% de nuestra atmósfera, es un gas incoloro, inodoro, insípido y químicamente no reactivo a temperatura ambiente. Se llama del griego nitron + genes para la formación de soda. Durante muchos años, durante los años 1500 y 1600, los científicos insinuaron que había otro gas en la atmósfera además del dióxido de carbono y el oxígeno. No fue hasta los 1700 que los científicos pudieron demostrar que de hecho había otro gas que ocupaba masa en la atmósfera de la Tierra.
Descubierto en 1772 por Daniel Rutherford (e independientemente por otros como Sacerdotal y Cavendish) quien fue capaz de eliminar oxígeno y dióxido de carbono de un tubo contenido lleno de aire. Demostró que había gas residual que no soportaba la combustión como el oxígeno o el dióxido de carbono. Si bien su experimento fue el que demostró que existía nitrógeno, otros experimentos también iban en Londres donde llamaban a la sustancia “quemada” o “aire desflogisticado”.
El nitrógeno es el cuarto elemento más abundante en humanos y es más abundante en el universo conocido que el carbono o el silicio. La mayor parte del gas nitrógeno producido comercialmente se recupera del aire licuado. De esa cantidad, la mayoría se utiliza para fabricar amoníaco (\(NH_3\)) a través del proceso Haber. Mucho también se convierte en ácido nítrico (\(HNO_3\)).
Isótopos
El nitrógeno tiene dos isótopos naturales, el nitrógeno-14 y el nitrógeno-15, que pueden separarse con intercambios químicos o difusión térmica. El nitrógeno también tiene isótopos con 12, 13, 16, 17 masas, pero son radiactivos.
- El Nitrógeno 14 es la forma más abundante de nitrógeno y constituye más del 99% de todo el nitrógeno que se encuentra en la Tierra. Es un compuesto estable y no es radiactivo. El Nitrógeno-14 tiene los usos más prácticos, y se encuentra en prácticas agrícolas, conservación de alimentos, bioquímicos e investigación biomédica. El Nitrógeno-14 se encuentra en abundancia en la atmósfera y entre muchos organismos vivos. Tiene 5 electrones de valencia y no es un buen conductor eléctrico.
- El nitrógeno-15 es la otra forma estable de nitrógeno. A menudo se utiliza en la investigación y preservación médica. El elemento no es radiactivo y por lo tanto también puede ser utilizado a veces en prácticas agrícolas. El nitrógeno-15 también se utiliza en la investigación cerebral, específicamente la espectroscopia de resonancia magnética nuclear (RMN), ya que a diferencia del nitrógeno-14 (espín nuclear de 1), tiene un espín nuclear de 1/2 lo que tiene beneficios a la hora de observar la investigación de MRI y las observaciones de RMN. Por último, el nitrógeno-15 puede ser utilizado como marcador o en algunas proteínas en biología. Los científicos utilizan principalmente este compuesto con fines de investigación y aún no han visto todo su potencial para su uso en la investigación cerebral.
Compuestos
Los dos compuestos más comunes de nitrógeno son Nitrato de Potasio (KNO 3) y Nitrato de Sodio (NaNO 3). Estos dos compuestos se forman descomponiendo materia orgánica que tiene presente potasio o sodio y que a menudo se encuentran en fertilizantes y subproductos de residuos industriales. La mayoría de los compuestos de nitrógeno tienen una energía libre de Gibbs positiva (es decir, las reacciones no son espontáneas).
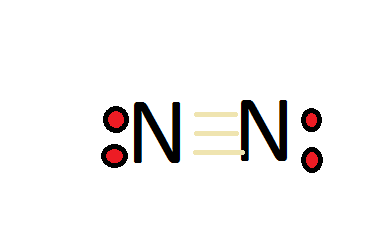
La molécula de dinitrógeno (\(N_2\)) es un compuesto “inusualmente estable”, particularmente porque el nitrógeno forma un triple enlace consigo mismo. Este triple enlace es difícil de romper. Para que el dinitrógeno siga la regla del octeto, debe tener un triple enlace. El nitrógeno tiene un total de 5 electrones de valencia, por lo que duplicando eso, tendríamos un total de 10 electrones de valencia con dos átomos de nitrógeno. El octeto requiere de un átomo para tener 8 electrones totales para tener una capa de valencia completa, por lo tanto necesita tener un triple enlace. El compuesto también es muy inerte, ya que tiene un triple enlace. Los enlaces triples son muy difíciles de romper, por lo que mantienen su caparazón de valencia completa en lugar de reaccionar con otros compuestos o átomos. Piénsalo de esta manera, cada triple enlace es como una banda de goma, con tres bandas de goma, los átomos de nitrógeno están muy atraídos entre sí.
Nitruros
Los nitruros son compuestos de nitrógeno con un átomo menos electronegativo; en otras palabras, es un compuesto con átomos que tienen una capa de valencia menos completa. Estos compuestos se forman con litio y metales del Grupo 2. Los nitruros suelen tener un estado de oxidación de -3.
\[3Mg + N_2 \rightarrow Mg_3N_2 \label{1}\]
Cuando se mezcla con agua, el nitrógeno formará amoníaco y, este ion nitruro actúa como una base muy fuerte.
\[N + 3H_2O_{(l)} \rightarrow NH_3 + 3OH^-_{(aq)} \label{2}\]
Cuando el nitrógeno se forma con otros compuestos, forma principalmente enlaces covalentes. Estos normalmente se hacen con otros metales y se ven como: MN, M 3 N y M 4 N. Estos compuestos son típicamente duros, inertes y tienen altos puntos de fusión debido a la capacidad del nitrógeno para formar enlaces triples covalentes.
Iones Amonio
El nitrógeno pasa por fijación por reacción con gas hidrógeno sobre un catalizador. Este proceso se utiliza para producir amoníaco. Como se mencionó anteriormente, este proceso nos permite utilizar nitrógeno como fertilizante porque descompone el fuerte triple enlace que sostiene N 2. El famoso proceso Haber-Bosch para la síntesis de amoníaco se ve así:
\[N_2 + 3H_2 \rightarrow 2NH_3 \label{3}\]
El amoníaco es una base y también se utiliza en reacciones ácido-base típicas.
\[2NH_{3(aq)} + H_2SO_4 \rightarrow (NH_4)_2SO_{4(aq)} \label{4}\]
Los iones nitruro son bases muy fuertes, especialmente en soluciones acuosas.
Óxidos de nitrógeno
Los nitruros utilizan una variedad de diferentes números de oxidación de +1 a +5 para compuestos de óxido. Casi todos los óxidos que se forman son gases, y existen a 25 grados centígrados. Los óxidos de nitrógeno son ácidos y se adhieren fácilmente a los protones.
\[N_2O_5 + H_2O \rightarrow 2HNO_{3 (aq)} \label{5}\]
Los óxidos juegan un papel importante en los organismos vivos. Pueden ser útiles, pero peligrosos.
- El monóxido de dinitrógeno (N 2 O) es un anestésico utilizado en el odontólogo como gas de risa.
- El dióxido de nitrógeno (NO 2) es dañino. Se une a las moléculas de hemoglobina no permitiendo que la molécula libere oxígeno por todo el cuerpo. Se libera de los autos y es muy dañino.
- El nitrato (NO 3 -) es un ion poliatómico.
- Los óxidos de nitrógeno más inestables permiten el desplazamiento espacial.
Hidruros
Los hidruros de nitrógeno incluyen amoníaco (NH 3) e hidrazina (N 2 H 4).
- En solución acuosa, el amoníaco forma el ion amonio que describimos anteriormente y tiene propiedades anfipróticas especiales.
- La hidrazina se usa comúnmente como combustible para cohetes
Aplicaciones de Nitrógeno
- El nitrógeno proporciona un recubrimiento para nuestra atmósfera para la producción de químicos y compartimentos electrónicos.
- El nitrógeno se utiliza como fertilizante en la agricultura para promover el crecimiento.
- Gas presurizado para petróleo.
- Refrigerante (como congelar comida rápida)
- Explosivos.
- Tratamiento/protector de metales a través de la exposición a nitrógeno en lugar de oxígeno
Referencias
- Petrucci, Ralph H, William Harwood y F. Arenque. Química General: Principios y Aplicaciones Modernas. 8 Ed. Nueva Jersey: Pearson Education Inc, 2001.
- Sadava, David et al. VIDA: La ciencia de la biología. Octava Edición. Asociado Sinauer.
- Tomás, Jacob. El nitrógeno y sus aplicaciones al futuro moderno. San Diego State University Prensa: 2007.
Problemas
- Completa y equilibra las siguientes ecuaciones
N 2 + ___H 2 → ___NH _
H 2 N 2 O 2 →?
2NH 3 + CO 2 →?
__Mg + N 2 → Mg _ N _
N 2 H 5 + H 2 O →?
- ¿Cuáles son los diferentes isótopos del Nitrógeno?
- Enumerar los estados de oxidación de diversos óxidos de nitrógeno: N 2 O, NO, N 2 O 3, N 2 O 4, N 2 O 5
- Enumere los diferentes elementos con los que reaccionará el Nitrógeno para hacerlo básico o ácido...
- Usos del nitrógeno
RESPUESTAS
- Completa y equilibra las siguientes ecuaciones
N 2 + 3H 2 → 2NH 3 (Proceso Haber)
H 2 N 2 O 2 → HNO
2NH 3 + CO 2 → (NH 2) 2 CO + H 2 O
2Mg + 3N 2 → Mg 3 N 2
N 2 H 5 + H 2 O → N 2 + H + H 2 O
- ¿Cuáles son los diferentes isótopos del Nitrógeno?
Las formas estables incluyen nitrógeno-14 y nitrógeno-15
- Enumerar los estados de oxidación de diversos óxidos de nitrógeno: +1, +2, +3, +4, +5 respectivamente
- Enumere los diferentes elementos con los que reaccionará el nitrógeno para hacerlo básico o ácido: el ion nitruro es una base fuerte cuando reacciona con agua, el amoníaco es generalmente un ácido débil
- Los usos del nitrógeno incluyen anestésico, refrigerante, protector del metal
Colaboradores
- Adam Wandell (UC Davis)

