8.11.2.1: Ozono
- Page ID
- 81425
El ozono es una forma alotrópica de oxígeno. Su fórmula molecular es O 3 y la masa molar es de 48 g mol -1.
Ocurrencia de ozono
Schonbein (1840) concluyó que las observaciones de Van Marums en 1785 de un olor peculiar, cuando se pasaba una descarga eléctrica a través del oxígeno (o aire), era de hecho un gas nuevo. Lo llamó Ozono, que se deriva de una palabra griega ozoaterr que significa olor. Soret en 1860, le asignó la fórmula molecular O 3. La ocurrencia de ozono es en pequeñas cantidades, en la capa superior de la atmósfera, donde se forma debido a la acción de los rayos ultravioleta sobre el oxígeno del aire. También está presente en el agua de mar donde se forma debido a la reacción del flúor con el agua.
En la estructura del ozono, la longitud de enlace de 127.8 pm es intermedia entre un enlace sencillo (longitud de enlace 148pm) y un enlace doble (longitud de enlace 110pm). Por lo tanto, se considera que el ozono es un híbrido de resonancia de las siguientes formas canónicas:

Usos del ozono
- Para la purificación del aire en los lugares abarrotados como salas de cine y túneles ferroviarios. Debido a su fuerte poder oxidante también destruye el olor asqueroso en los mataderos.
- En esterilizar el agua potable oxidando todos los gérmenes y bacterias.
- Para la conservación de la carne en cámara frigorífica.
- Para blanquear tejidos delicados como seda, marfil, aceites, almidón y cera.
- Ayuda a localizar un doble enlace en cualquier compuesto orgánico insaturado por ozonólisis.
Preparación de ozono
Cuando se pasa una descarga eléctrica silenciosa a través del oxígeno seco, se forma ozono. El oxígeno nunca se convierte completamente en ozono y siempre obtenemos una mezcla de oxígeno y ozono. Esta mezcla se llama oxígeno ozonizado.
\[ \ce{3O_2 ->[\text{electric}][\text{discharge}] 2O_3} \;\;\; \Delta{H} = +284.5\;kJ/mol\]
La reacción se inicia por una descarga eléctrica sin chispeo o silenciosa, para producir menos calor, ya que el ozono es propenso a descomponerse nuevamente en oxígeno con un aumento de temperatura (Principio de Le Chatelier). De ahí que el ozono se prepare en un aparato especialmente diseñado llamado ozonizador para facilitar las condiciones anteriores. Un 'ozonizador' es el aparato utilizado para preparar ozono por el paso de la descarga eléctrica silenciosa. Comúnmente se utilizan dos tipos de ozonizadores: los Ozonizadores Siemen y Brodie.
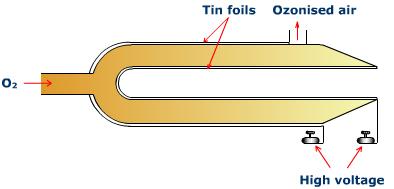
Ozonizador de Siemen
Consta de dos tubos de vidrio coaxiales fundidos entre sí. La lámina de estaño se utiliza para recubrir el lado interno del tubo interno y el lado externo del tubo exterior. Los recubrimientos de estaño interior y exterior están conectados a los terminales de una bobina de inducción, que produce corriente de alto voltaje. Una corriente lenta de oxígeno puro y seco se pasa a través del espacio anular. Al someter el oxígeno a descarga eléctrica silenciosa, se forma oxígeno ozonizado que contiene 10-15% de ozono. Al tomar las siguientes precauciones, se puede aumentar el rendimiento de ozono en el oxígeno ozonizado:
- Solo se debe usar oxígeno puro y seco.
- El ozonizador debe estar perfectamente seco.
- Se debe mantener una temperatura bastante baja (alrededor de 0°C).
- No debería haber chispas.
Ozonizador de Brodie
En principio, este ozonizador es como el ozonizador de Siemen pero el ácido sulfúrico diluido reemplaza la lámina de estaño. Dos electrodos de carbono se sumergen en el ácido y se conectan a una bobina de inducción. Se pasa una corriente de oxígeno seco a través del espacio entre los tubos. El oxígeno ozonizado que contiene alrededor del 5%\(O_3\) sale en el otro extremo. Si el aparato se mantiene fresco, la proporción de ozono puede subir 20-25%.

Problemas
- ¿Cómo se forma el ozono en la atmósfera superior?
Solución
- El ozono se forma en la atmósfera superior en dos etapas:
i) Fotodisociación de oxígeno por radiaciones ultravioletas de longitud de onda inferior a 240 nm.
\[ \ce{O_2 ->[h\nu] O^{\boldsymbol{\cdot}} + O^{\boldsymbol{\cdot}} }\]
Los átomos de oxígeno son realmente dirradicales con dos electrones orbitales p desapareados, pero aquí están representados con un solo electrón.
ii) Combinación de átomos de oxígeno altamente reactivos con moléculas de oxígeno.
\[ \ce{O_2 + O^{\boldsymbol{\cdot}} \rightarrow O_3 }\]
12. ¿Cuál es el principio de preparación del ozono?
Colaboradores y Atribuciones
Binod Shrestha (University of Lorraine)

