8.11.2: Química del Oxígeno (Z=8)
- Page ID
- 81418
El oxígeno es un elemento ampliamente conocido por el público en general por el gran papel que juega en el sostenimiento de la vida. Sin oxígeno, los animales serían incapaces de respirar y en consecuencia morirían. El oxígeno no solo es importante para apoyar la vida, sino que juega un papel importante en muchas otras reacciones químicas. El oxígeno es el elemento más común en la corteza terrestre y constituye alrededor del 20% del aire que respiramos. Históricamente, el descubrimiento del oxígeno como elemento esencial para la combustión se encuentra en el centro de la controversia del flogistón (ver abajo).
El origen y la historia
El oxígeno se encuentra en el grupo 16 elementos y es considerado como calcógeno. Nombrado del griego oxys + genes, “ácido-formador”, el oxígeno fue descubierto en 1772 por Scheele e independientemente por Sacerdotal en 1774. Oxígeno fue dado su nombre por el científico francés, Antoine Lavoisier.
Scheele descubrió oxígeno, a través de un experimento, que implicó quemar óxido de manganeso. Scheele llegó a encontrar que el óxido de manganeso caliente producía un gas al que llamó “aire de fuego”. También llegó a encontrar que cuando este gas pudo entrar en contacto con el carbón, producía hermosas chispas brillantes. Todos los demás elementos produjeron el mismo gas. A pesar de que Scheele descubrió oxígeno, no publicó su obra hasta tres años después de que otro químico, José Sacerdotal, descubriera el oxígeno. Joseph Priestly, un químico inglés, repitió el experimento de Scheele en 1774 usando una configuración ligeramente diferente. Sacerdotal utilizó un vidrio ardiente de 12in y apuntó la luz solar directamente hacia el compuesto que estaba probando, óxido mercúrico. Como resultado, pudo “descubrir mejor aire” que se demostró que ampliaba la vida útil de un ratón a cuatro veces más tiempo y provocó que una llama ardiera con mayor intensidad. A pesar de estos experimentos, ambos químicos no pudieron precisar exactamente cuál era este elemento. No fue hasta 1775 que Antoine Lavoisier, químico francés, pudo reconocer como elemento a este gas desconocido.
Nuestra atmósfera contiene actualmente alrededor de 21% de oxígeno libre. El oxígeno se produce de diversas maneras. El proceso de disociación fotoquímica en el que las moléculas de agua se rompen por los rayos ultravioleta produce alrededor del 1-2% de nuestro oxígeno. Otro proceso que produce oxígeno es la fotosíntesis que es realizada por plantas y bacterias fotosintéticas. La fotosíntesis se produce a través de la siguiente reacción general:
\[\ce{CO2 + H2O + h\nu \rightarrow} \text{organic compounds} \ce{+ O2}\]
Los peligros del flogistón
La teoría del flogistón es la creencia obsoleta de que un elemento similar al fuego llamado flogiston está contenido dentro de cuerpos combustibles y liberado durante la combustión. El nombre proviene del griego antiguo φλογιστον phlogistón (ardiendo), del φλphlóx (llama). Fue declarado por primera vez en 1667 por Johann Joachim Becher, y luego armarlo más formalmente por Georg Ernst Stahl. La teoría intentó explicar procesos de combustión como la combustión y la oxidación, que ahora se conocen colectivamente como oxidación.
Propiedades
- Número de elemento: 8
- Peso atómico 15.9994
- Color: forma de gas- incoloro, líquido- azul pálido
- Punto de fusión: 54.36K
- Punto de ebullición: 90.2 K
- Densidad: .001429
- 21% de la atmósfera terrestre
- Tercer elemento más abundante del universo
- Elemento más abundante en la corteza terrestre con 45.4%
- 3 Isótopos estables
- Energía de ionización: 13.618 eV
- El oxígeno se reduce fácilmente y es un gran agente oxidante que lo hace fácilmente reactivo con otros elementos
Propiedades magnéticas del oxígeno
El oxígeno (O 2) es paramagnético. Una molécula de oxígeno tiene seis electrones de valencia, por lo que la molécula O 2 tiene 12 electrones de valencia con la configuración de electrones que se muestra a continuación: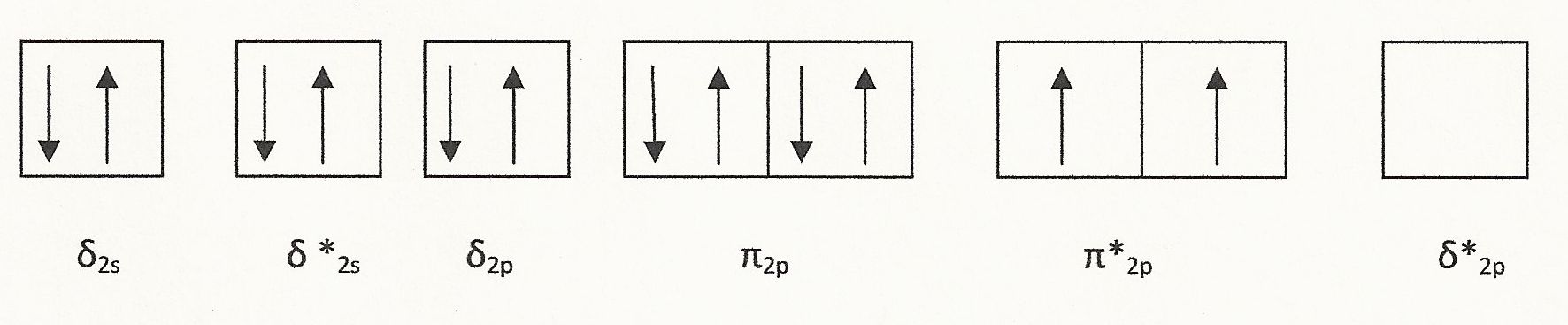
Como se muestra, hay dos electrones desapareados lo que hace que O 2 sea paramagnético. También hay ocho electrones de valencia en los orbitales de unión y cuatro en orbitales antienlace lo que hace que el enlace sea el orden 2. Esto explica el doble enlace covalente que está presente en O 2.
Video\(\PageIndex{1}\): Demostración química del paramagnetismo del oxígeno molecular, como lo demuestra la atracción del oxígeno líquido a los imanes.
Como se muestra en Video\(\PageIndex{1}\), dado que el oxígeno molecular (\(O_2\)tiene electrones desapareados, es paramagnético y es atraído por el imán. En contraste, el nitrógeno molecular (\(N_2\)) no tiene electrones desapareados y no es atraído por el imán.
Química General del Oxígeno
El oxígeno normalmente tiene un estado de oxidación de -2 pero es capaz de tener estados de oxidación de -2, -1, -1/2, 0, +1 y +2. Los estados de oxidación de los óxidos, peróxidos y superóxidos son los siguientes:- Óxidos: O -2,
- peróxidos: O 2 -2,
- súper óxido: O 2 -1.
El oxígeno no reacciona consigo mismo, nitrógeno o agua en condiciones normales. Sin embargo, el oxígeno se disuelve en agua a 20 grados Celsius y 1 atmósfera. El oxígeno tampoco reacciona normalmente con bases o ácidos. Los metales del grupo 1 (metales alcalinos) son muy reactivos con el oxígeno y deben almacenarse lejos del oxígeno para evitar que se oxiden. Los metales en la parte inferior del grupo son más reactivos que los de la parte superior. Las reacciones de algunos de estos metales se exploran con más detalle a continuación.
Litio: Reacciona con oxígeno para formar óxido de litio blanco en la siguiente reacción.
\[\ce{4Li + O_2 \rightarrow 2Li_2O} \label{1}\]
Sodio: Reacciona con oxígeno para formar una mezcla blanca de óxido de sodio y peróxido de sodio. A continuación se muestran las reacciones.
- oxígeno con óxido de sodio:\[\ce{4Na + O_2 \rightarrow 2Na_2O} \label{2}\]
- oxígeno con peróxido de sodio:\[\ce{2Na + O_2 \rightarrow Na_2O_2} \label{3}\]
Potasio: Reacciona con oxígeno para formar una mezcla de peróxido de potasio y superóxido de potasio. A continuación se muestran las reacciones.
- Peróxido de potasio:\[\ce{2K + O_2 \rightarrow 2K_2O_2} \label{4}\]
- superóxido de potasio:\[\ce{K + O_2 \rightarrow KO_2} \label{5}\]
Rubidio y Cesio: Ambos metales reaccionan para producir superóxidos a través del mismo proceso que el de la reacción del superóxido de potasio.
Los óxidos de estos metales forman hidróxidos metálicos cuando reaccionan con agua. Estos hidróxidos metálicos hacen que la solución sea básica o alcalina de ahí el nombre de metales alcalinos.
Los metales del grupo 2 (metales alcalinotérreos) reaccionan con el oxígeno a través del proceso de combustión para formar óxidos metálicos pero hay algunas excepciones.
El berilio es muy difícil de quemar porque tiene una capa de óxido de berilio en su superficie lo que impide una mayor interacción con el oxígeno. El estroncio y el bario reaccionan con el oxígeno para formar peróxidos. La reacción de bario y oxígeno se muestra a continuación y la reacción con estroncio sería la misma.
\[\ce{Ba(s) + O2 (g) \rightarrow BaO2 (s) }\label{6}\]
El grupo 13 reacciona con el oxígeno para formar óxidos e hidróxidos que son de la forma\(X_2O_3\) y\(X(OH)_3\). La variable X representa los distintos elementos del grupo 13. A medida que vas bajando del grupo, los óxidos e hidróxidos se vuelven cada vez más básicos.
Los elementos del grupo 14 reaccionan con el oxígeno para formar óxidos. Los óxidos formados en la parte superior del grupo son más ácidos que los de la parte inferior del grupo. El oxígeno reacciona con el silicio y el carbono para formar dióxido de silicio y dióxido de carbono. El carbono también es capaz de reaccionar con el oxígeno para formar monóxido de carbono que es ligeramente ácido. El germanio, el estaño y el plomo reaccionan con el oxígeno para formar monóxidos y dióxidos que son anfóteros, lo que significa que reaccionan tanto con ácidos como con bases.
Los elementos del grupo 15 reaccionan con el oxígeno para formar óxidos. Los más importantes se enumeran a continuación.
- Nitrógeno: N 2 O, NO, N 2 O 3, N 2 O 4, N 2 O 5
- Fósforo: P 4 O 6, P 4 O 8, P 2 O 5
- Arsénico: Como 2 O 3, As 2 O 5
- Antimonio: Sb 2 O 3, Sb 2 O 5
- Bismuto: Bi 2 O 3, Bi 2 O 5
Los elementos del grupo 16 reaccionan con el oxígeno para formar diversos óxidos. Algunos de los óxidos se enumeran a continuación.
- Azufre: SO, SO 2, SO 3, S 2 O 7
- Selenio: SeO 2, SeO 3
- Teluro: TeO, TeO 2, TeO 3
- Polonio: PoO, PoO 2, PoO 3
Los elementos del grupo 17 (halógenos) flúor, cloro, bromo y yodo reaccionan con el oxígeno para formar óxidos. El flúor forma dos óxidos con oxígeno los cuales son F 2 O y F 2 O 2. Ambos óxidos de flúor se llaman fluoruros de oxígeno porque el flúor es el elemento más electronegativo. A continuación se muestra una de las reacciones de flúor.
\[\ce{O2 (g) + F2 (g) \rightarrow F2O2 (g)} \label{7}\]
Grupo 18 Algunos asumirían que los Gases Noble no reaccionarían con el oxígeno. Sin embargo, el xenón reacciona con el oxígeno para formar\(\ce{XeO_3}\) y\(\ce{XeO_4}\). La energía de ionización del xenón es lo suficientemente baja como para que el átomo de oxígeno electronegativo “robe” electrones. Desafortunadamente,\(\ce{XeO_3}\) es ALTAMENTE inestable, y se sabe que detonó espontáneamente en un ambiente limpio y seco.
Los metales de transición reaccionan con el oxígeno para formar óxidos metálicos. Sin embargo, el oro, la plata y el platino no reaccionan con el oxígeno. A continuación se muestran algunas reacciones que involucran metales de transición.
\[2Sn_{(s)} + O_{2(g)} \rightarrow 2SnO_{(s)} \label{8} \]
\[4Fe_{(s)} + 3O_{2(g)} \rightarrow 2Fe_2O_{3(s)} \label{9A}\]
\[4Al_{(s)} + 3O_{2(g)} \rightarrow 2Al_2O_{3(s)} \label{9B}\]
Reacción de Óxidos
Estaremos discutiendo óxidos metálicos de la forma\(X_2O\). La variable\(X\) representa cualquier metal que sea capaz de unirse al oxígeno para formar un óxido.
- Reacción con agua: Los óxidos reaccionan con el agua para formar un hidróxido metálico.
\[X_2O + H_2O \rightarrow 2XOH\]
- Reacción con ácidos diluidos: Los óxidos reaccionan con ácidos diluidos para formar una sal y agua.
\[X_2O + 2HCl \rightarrow 2XCl + H_2O\]
Reacciones de Peróxidos
Los peróxidos que estaremos discutiendo son de la forma\(X_2O_2\). La variable\(X\) representa cualquier metal que pueda formar un peróxido con oxígeno.
Reacción con agua: Si la temperatura de la reacción se mantiene constante a pesar de que la reacción es exotérmica, entonces la reacción procede de la siguiente manera.
\[X_2O_2+ 2H_2O \rightarrow 2XOH + H_2O_2\]
Si la reacción no se realiza a una temperatura constante, entonces la reacción del peróxido y el agua dará como resultado que el peróxido de hidrógeno que se produce se descomponga en agua y oxígeno.
Reacción con ácido diluido: Esta reacción es más exotérmica que la del agua. El calor producido hace que el peróxido de hidrógeno se descomponga en agua y oxígeno. La reacción se muestra a continuación.
\[X_2O_2 + 2HCl \rightarrow 2XCl + H_2O_2\]
Reacción de Superóxidos
Los superóxidos de los que hablaremos son de la forma\(XO_2\). con\(X\) representar cualquier metal que forme un superóxido al reaccionar con el oxígeno.
Reacción con agua: El superóxido y el agua reaccionan en una reacción muy exotérmica que se muestra a continuación. El calor que se produce al formar el peróxido de hidrógeno hará que el peróxido de hidrógeno se descomponga en agua y oxígeno.
\[2XO_2 + 2H_2O \rightarrow 2XOH + H_2O_2 + O_2\]
Reacción con ácidos diluidos: El superóxido y el ácido diluido reaccionan en una reacción muy exotérmica que se muestra a continuación. El calor producido hará que el peróxido de hidrógeno se descomponga en agua y oxígeno.
\[2XO_2 + 2HCl \rightarrow 2XCl + H_2O_2 + O_2\]
Alótropos de Oxígeno
Hay dos alótropos de oxígeno; dioxígeno (O 2) y trioxígeno (O 3) que se llama ozono. La reacción de convertir el dioxígeno en ozono es muy endotérmica, lo que hace que ocurra raramente y solo en la atmósfera baja. La reacción se muestra a continuación:
\[3O_{2 (g)} \rightarrow 2O_{3 (g)} \;\;\; ΔH^o= +285 \;kJ\]
El ozono es inestable y se descompone rápidamente de nuevo en oxígeno pero es un gran agente oxidante.
Reacciones misceláneas
Reacción con alcanos: Las reacciones más comunes que involucran alcanos ocurren con el oxígeno. Los alcanos son capaces de quemar y es el proceso de oxidación de los hidrocarburos lo que los hace importantes como combustibles. Un ejemplo de una reacción de alcano es la reacción de octano con oxígeno como se muestra a continuación.
C 8 H 18 (l) + 25/2 O 2 (g) → 8CO 2 (g) + 9H 2 O (l) ∆H o = -5.48 X 10 3 kJ
Reacción con amoníaco: El oxígeno es capaz de reaccionar con amoníaco para producir dinitrógeno (N 2) y agua (H 2 O) a través de la reacción que se muestra a continuación.
\[4NH_3 + 3O_2 \rightarrow 2N_2 + 6H_2O\]
Reacción con Óxido de Nitrógeno: El oxígeno es capaz de reaccionar con el óxido de nitrógeno para producir dióxido de nitrógeno mediante la reacción que se muestra a continuación.
\[NO + O_2 \rightarrow NO_2\]
Problemas
- ¿El oxígeno es reactivo con los gases nobel?
- ¿Con qué metales de transición no reacciona el oxígeno?
- ¿Qué se produce cuando un óxido reacciona con el agua?
- ¿El oxígeno es reactivo con los metales alcalinos? ¿Por qué se nombra así a los metales alcalinos?
- Si el oxígeno es reactivo con los metales alcalinos, ¿se producen óxidos, peróxidos o superóxidos?
Soluciones
- No, los gases nobles no son reactivos con el oxígeno.
- El oxígeno es en su mayoría no reactivo con el oro y el platino.
- Cuando un óxido reacciona con el agua, se produce un hidróxido metálico.
- El oxígeno es muy reactivo con los metales alcalinos. A los metales alcalinos se les da el nombre álcali porque los óxidos de estos metales reaccionan con el agua para formar un hidróxido metálico que es básico o alcalino.
- El litio produce un óxido, el sodio produce un peróxido y el potasio, el cesio y el rubidio producen superóxidos.
Referencias
- Braathen, Per Christian. “Determinación del Contenido de Oxígeno del Aire”. J. Chem. Educ. 2000 77 1410.
- Najdoski, Metodija; Petrusevski, Vladimir M. "Un experimento novedoso para la determinación rápida y sencilla del contenido de oxígeno en el aire" J. Chem. Educ. 2000 77 1447.
- Petrucci, Ralph H. Química General. 9ª ed. Río Upper Saddle: Prentice Hall, 2007. Imprimir
- McNaught, Ian J. “Una Demostración de Globo de Hidrógeno/Oxígeno Modificado”. J. Chem. Educ. 1998 75 52.
Colaboradores y Atribuciones
- Phillip Ball (UCD), Katharine Williams (UCD)

