8.11.3: Química del Azufre (Z=16)
- Page ID
- 81434
Objetivos de aprendizaje
- Describir la química del grupo de oxígeno.
- Dar la tendencia de diversas propiedades.
- Recuerda los nombres de los elementos del Grupo 16.
- Explicar el proceso de Frasch.
- Describir propiedades y aplicaciones de\(\mathrm{H_2SO_4}\).
- Explicar propiedades y aplicaciones de\(\mathrm{H_2S}\).
El azufre es un elemento químico que se representa con el símbolo químico “S” y el número atómico 16 en la tabla periódica. Debido a que es 0.0384% de la corteza terrestre, el azufre es el decimoséptimo elemento más abundante después del estroncio. El azufre también toma muchas formas, que incluyen azufre elemental, compuestos de órgano-azufre en petróleo y carbón, H 2 S (g) en gas natural y sulfuros y sulfatos minerales. Este elemento se extrae mediante el proceso de Frasch (discutido a continuación), un método donde se utiliza agua sobrecalentada y aire comprimido para extraer azufre líquido a la superficie. Los sitios en alta mar, Texas y Luisiana son los principales sitios que producen grandes cantidades de azufre elemental. Sin embargo, el azufre elemental también se puede producir reduciendo H 2 S, comúnmente encontrado en petróleo y gas natural. Sin embargo, en su mayor parte, el azufre se utiliza para producir SO 2 (g) y H 2 SO 4.
Conocido desde la antigüedad (mencionado en las escrituras hebreas como azufre), el azufre fue clasificado como elemento en 1777 por Lavoisier. El azufre puro es insípido e inodoro con un color amarillo claro. Las muestras de azufre que a menudo se encuentran en el laboratorio tienen un olor notable. El azufre es el décimo elemento más abundante en el universo conocido.
| Número atómico | 16 |
| Símbolo atómico | S |
| Peso atómico | 32.07 gramos por mol |
| Estructura | ortorrómbico |
| Fase a temperatura ambiente | sólido |
| Clasificación | no metálico |
Propiedades físicas del azufre
El azufre tiene un peso atómico de 32.066 gramos por mol y forma parte del grupo 16, la familia del oxígeno. Es un no metálico y tiene un calor específico de 0.706 J g -1 o C -1. La afinidad electrónica si es 200 kJ mol -1 y la electronegatividad es de 2.58 (sin unidades). El azufre se encuentra típicamente como un sólido amarillo claro, opaco y quebradizo en grandes cantidades de pequeños cristales ortorrómbicos. No sólo el azufre tiene el doble de densidad del agua, también es insoluble en agua. Por otro lado, el azufre es altamente soluble en disulfuro de carbono y ligeramente soluble en muchos solventes comunes. El azufre también puede variar en color y se ennegrece al hervir debido a las impurezas carbonosas. Incluso tan poco como 0.05% de la materia carbonosa oscurece significativamente el azufre.
La mayor parte del azufre se recupera directamente como elemento de los depósitos subterráneos inyectando agua sobrecalentada y canalizando el azufre fundido (el azufre se funde a 112 o C). En comparación con otros elementos, el azufre tiene la mayor cantidad de alótropos. Si bien el anillo S 8 es el alótropo más común, existen otras 6 estructuras con hasta 20 átomos de azufre por anillo.
- En condiciones apropiadas, el vapor de azufre puede contener\(S\)\(S_2\),\(S_4\),\(S_6\), y\(S_8\).
- A temperatura ambiente, el azufre rómbico (S α) es un sólido estable compuesto por\(S_8\) moléculas cíclicas.
- A 95.5 °C, el azufre rómbico se convierte en azufre monoclínico (S β). La estructura cristalina encontrada en el azufre monoclínico difiere de la del azufre rómbico. El azufre monoclínico también está compuesto por\(S_8\) moléculas.
- El azufre monoclínico se convierte en azufre líquido (S λ) a 119 °C. El azufre líquido es un líquido de color pajizo compuesto por\(S_8\) moléculas y otras moléculas cíclicas que contienen un rango de seis a veinte átomos.
- A 160 o C, este se convierte en un líquido oscuro y viscoso llamado azufre líquido (S μ). Las moléculas todavía están compuestas por ocho átomos de azufre, pero la molécula se abre y se transforma de un círculo en una molécula de cadena espiral larga.
- A 180 °C, la longitud de la cadena y la viscosidad alcanzan su máximo. Las cadenas se rompen y la viscosidad disminuye a temperaturas que superan los 180 °C.
- El vapor de azufre se produce cuando el líquido hierve a 445 °C. En el vapor que se produce,\(S_8\) las moléculas dominan pero a medida que el vapor continúa calentándose, las moléculas se descomponen en grupos más pequeños de azufre.
- Para producir azufre plástico, Sis se vertió en agua fría. El azufre plástico es similar al caucho y está compuesto por moléculas largas de cadena en espiral. Si el azufre plástico se asienta por mucho tiempo, se reconvertirá en azufre rómbico.
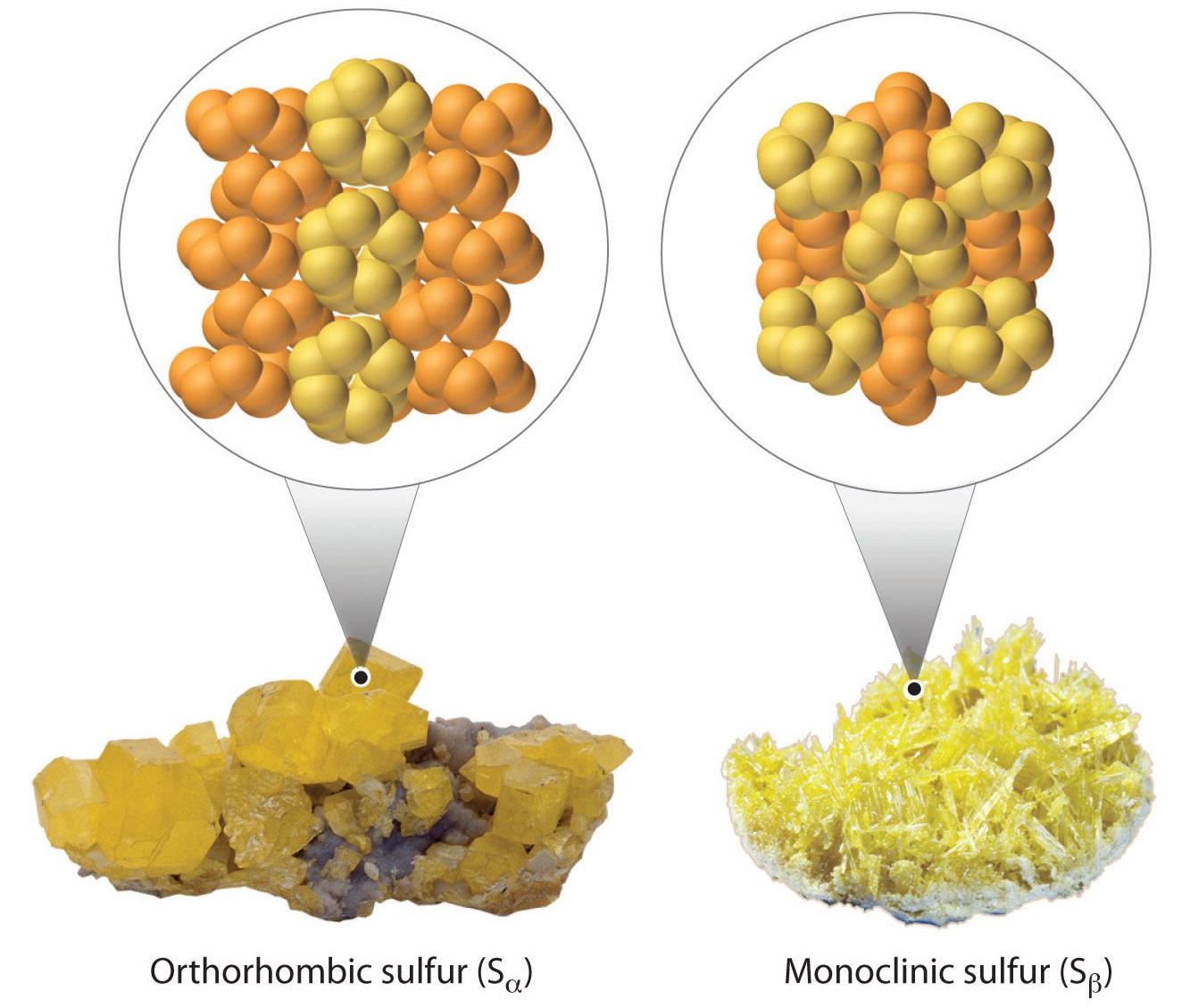
Si bien el oxígeno tiene menos alótropos que el azufre\(\ce{O}\), incluyendo\(\ce{O_2}\),\(\ce{O_3}\),\(\ce{O_4}\),\(\ce{O_8}\),,, metálico\(\ce{O}\) (y otras cuatro fases sólidas), muchos de estos en realidad tienen una variante de azufre correspondiente. Sin embargo, el azufre tiene más tendencia a catenar (el enlace de átomos del mismo elemento en cadenas más largas). Aquí están los valores de las entalpías de enlace simple y doble:
\[\begin{array}{c|r} \ce {O-O} & \ce{142\ kJ/mol} \\ \ce {S–S} & \ce{268\ kJ/mol} \\ \ce {O=O} & \ce{499\ kJ/mol} \\ \ce {S=S} & \ce{352\ kJ/mol} \\ \end{array}\]
Esto significa que\(\ce{O=O}\) es más fuerte que\(\ce{S=S}\), mientras que\(\ce{O–O}\) es más débil que\(\ce{S–S}\). Entonces, en azufre, se favorecen los enlaces simples y la catenación es más fácil que en los compuestos de oxígeno. Parece que la razón de los\(\ce{S=S}\) dobles enlaces más débiles tiene sus raíces en el tamaño del átomo: es más difícil que los dos átomos lleguen a una distancia lo suficientemente pequeña, de modo que los\(p\) orbitales se superponen son pequeños y el\(\pi\) enlace es débil. Esto se atestigua mirando hacia abajo la tabla periódica:\(\ce{Se=Se}\) tiene una entalpía de enlace aún más débil de\(\ce{272 kJ/mol}\).
¿Qué sucede cuando el azufre sólido se derrite? Las\(\ce{S8}\) moléculas se rompen. Cuando se enfría repentinamente, se forman moléculas de cadena larga en el azufre plástico que se comportan como caucho. El azufre plástico se transforma en azufre rómbico con el tiempo.
Compuestos
Al leer las siguientes reacciones, averiguar y notar el cambio del estado de oxidación de\(\ce{S}\) en los reactivos y productos. Los estados comunes de oxidación del azufre son -2, 0, +4 y +6. Azufre (azufre, piedra que quema) reacciona\(\ce{O2}\) dando una llama azul (Figura\(\PageIndex{1}\)):
\[\ce{S + O_2 \rightarrow SO_2}\]
\(\ce{SO2}\)se produce siempre que se oxida sulfuro metálico. Se recupera y se oxida más para dar\(\mathrm{SO_3}\), para la producción de\(\mathrm{H_2SO_4}\). \(\mathrm{SO_2}\)reacciona con\(\mathrm{H_2S}\) para formar\(\mathrm{H_2O}\) y\(\ce{S}\).
\[\mathrm{2 SO_2 + O_2 \rightleftharpoons 2 SO_3}\]
\[\mathrm{SO_3 + H_2O \rightleftharpoons H_2SO_4} \;\;(\text{a valuable commodity})\]
\[\mathrm{SO_3 + H_2SO_4 \rightleftharpoons H_2S_2O_7} \;\;\; (\text{pyrosulfuric acid})\]
El azufre reacciona con iones sulfito en solución para formar tiosulfato,
\[\ce{S + SO_3^{2-} -> S_2O_3^{2-}}\]
pero la reacción se invierte en una solución ácida.
Óxidos
Hay muchos óxidos de azufre estables diferentes, pero los dos que se encuentran comúnmente son el dióxido de azufre y el trióxido de azufre. El dióxido de azufre es un óxido de azufre que se encuentra comúnmente. Es un gas incoloro, acre y no inflamable. Tiene una densidad de 2.8 kg/m 3 y un punto de fusión de -72.5 o C. Debido a que los materiales orgánicos son más solubles en\(SO_2\) que en agua, la forma líquida es un buen solvente. \(SO_2\)se utiliza principalmente para producir\(SO_3\). La combustión directa de azufre y el tostado de sulfuros metálicos rinden\(SO_2\) a través del proceso de contacto:
\[\underbrace{S(s) + O_2(g) \rightarrow SO_2(g)}_{\text{Direct combustion}}\]
\[\underbrace{2 ZnS(s) + 3 O_2(g) \rightarrow 2 ZnO(s) + 2 SO_2(g)}_{\text{Roasting of metal sulfides}}\]
El trióxido de azufre es otro de los óxidos de azufre comúnmente encontrados. Es un líquido incoloro con un punto de fusión de 16.9 o C y una densidad de kg/m 3. \(SO_3\)se utiliza para producir ácido sulfúrico. \(SO_2\)se utiliza en la síntesis de\(SO_3\):
\[\underbrace{2 SO_2 (g) + O_2(g) \rightleftharpoons 2 SO_3(g)}_{\text{Exothermic, reversible reaction}}\]
Esta reacción necesita un catalizador para ser completado en una cantidad razonable de tiempo con\(V_2O_5\) el catalizador más comúnmente utilizado.
Sulfuro de Hidrógeno H 2 S
- El sulfuro de hidrógeno,\(\ce{H2S}\) es un ácido diprótico. Los equilibrios a continuación,\[\mathrm{H_2S \rightleftharpoons HS^- + H^+}\]\[\mathrm{HS^- \rightleftharpoons S^{2-} + H^+}\] han sido discutidos en relación con los ácidos polipróticos.
Otros Compuestos que contienen Azufre
Quizás el compuesto más significativo de azufre utilizado en las sociedades industrializadas modernas es el ácido sulfúrico (\(H_2SO_4\)). El dióxido de azufre (\(SO_2\)) encuentra aplicaciones prácticas en el blanqueo y la refrigeración, pero también es un gas molesto resultante de la quema de carbones sulfurosos. El gas dióxido de azufre reacciona entonces con el vapor de agua en el aire para producir un ácido débil, ácido sulfuroso (\(H_2SO_3\)) que contribuye al problema de la lluvia ácida.
- El ácido sulfúrico, H 2 SO 4, se produce al reaccionar\(SO_3\) con agua. Sin embargo, esto a menudo conduce a problemas de contaminación. Se hace reaccionar SO 3 (g) con 98% H 2 SO 4 en torres llenas de material cerámico para producir H 2 S 2 O 7 u óleum. El agua circula en la torre para mantener la concentración correcta y el ácido se diluye con agua al final para producir la concentración correcta. El ácido sulfúrico puro no tiene color ni olor, y es un líquido oleoso e higroscópico. Sin embargo, el vapor de ácido sulfúrico produce humo blanco pesado y un olor sofocante.
- Ácido sulfúrico diluido, H 2 SO 4 (aq) reacciona con metales y actúa como un ácido fuerte en reacciones químicas comunes. Se utiliza para producir H 2 (g) y liberar CO 2 (g) y puede neutralizar bases fuertes.
- El ácido sulfúrico concentrado, H 2 SO 4 (conc.) tiene una fuerte afinidad por el agua. En algunos casos, elimina los átomos de H y O. El ácido sulfúrico concentrado también es un buen agente oxidante y reacciona con algunos metales.
\[C_{12}H_{22}O_{11}(s) \rightarrow 12 C(s) + 11 H_2O(l)\]
(Ácido sulfúrico concentrado utilizado en la reacción directa para eliminar los átomos de H y O).
Aplicaciones del ácido sulfúrico
- como un ácido fuerte para hacer\(\ce{HCl}\) y\(\mathrm{HNO_3}\).
- como agente oxidante para metales.
- como agente deshidratante.
- para la fabricación de fertilizantes y otros productos básicos.
- El ácido sulfuroso (H 2 SO 3) se produce cuando\(SO_2\) (g) reacciona con el agua. No puede aislarse en su forma pura, sin embargo, forma sales como sulfitos. Los sulfitos pueden actuar tanto como agentes reductores como agentes oxidantes.
O 2 (g) + 2 SO 3 2 - (aq)\ fila derecha 2 SO 4 2 - (aq) (Agente reductor)
2 H 2 S (g) + 2 H + (aq) + SO 3 2 - (aq)\ fila derecha 3 H 2 O (l) + 3 S (s) (Agente oxidante)
H 2 SO 3 es un ácido diprótico que actúa como un ácido débil en ambas etapas y H 2 SO 4 también es un ácido diprótico pero actúa como un ácido fuerte en la primera etapa y un ácido débil en la segunda etapa. Los ácidos como NaHSO 3 y NaHSO 4 se denominan sales ácidas porque son el producto del primer paso de estos ácidos dipróticos.
La ebullición de azufre elemental en una solución de sulfito de sodio produce tiosulfato. Los tiosulfatos no solo son importantes en el procesamiento fotográfico, sino que también son reactivos analíticos comunes utilizados con yodo (como en las siguientes dos reacciones).
\[2 Cu^{2+}_{(aq)} + 5 I^-_{(aq)} \rightarrow 2 CuI_{(s)} + I^-_{3(aq)} \]
\[I^-_{3(aq)} + 2 S_2O^{2-}_{3(aq)} \rightarrow 3 I^-_{(aq)} + S_4O^{2-}_{6(aq)}\]
con exceso de iones triyoduro titulado con Na 2 S 2 O 3 (ac).
Aparte del ácido sulfúrico, quizás el compuesto de azufre más familiar en el laboratorio de química es el gas sulfuro de hidrógeno maloliente\(H_2S\), que huele a huevos podridos.
- Los haluros de azufre son compuestos formados entre el azufre y los halógenos. Los compuestos comunes incluyen SF 2, S 2 F 2, SF 4 y SF 6. Si bien SF 4 es un potente agente fluorante, SF 6 es un gas incoloro, inodoro y no reactivo. Los compuestos formados por azufre y cloruro incluyen S 2 Cl 2, SCl 4 y SCl 2. SCl 2 es un líquido rojo de mal olor que se utiliza para producir gas mostaza (\( S(CH_2CH_2Cl)_2\)).
\[SCl_2 + 2CH_2CH_2 \rightarrow S(CH_2CH_2Cl)_2 \]
Producción -El Proceso Frasch
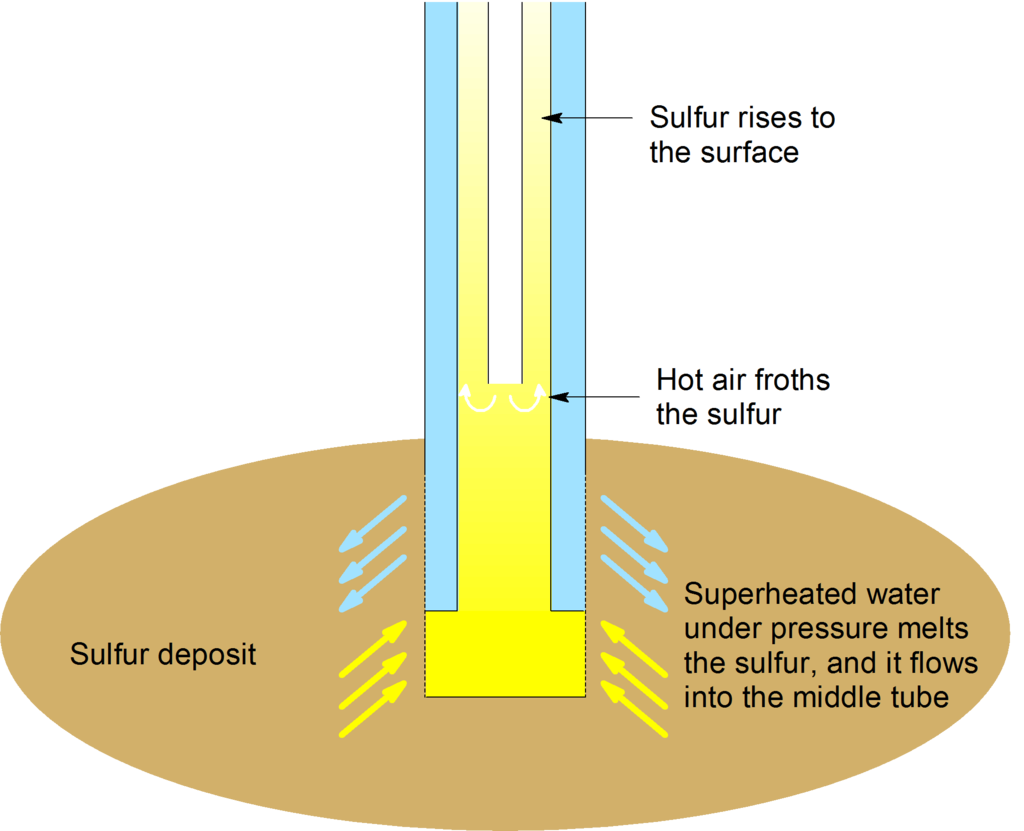
El azufre se puede extraer mediante el proceso de Frasch. Este proceso ha hecho del azufre un producto químico de alta pureza (hasta 99.9 por ciento puro) en grandes cantidades. La mayoría de los minerales que contienen azufre son sulfuros metálicos, y el más conocido es quizás la pirita (\(\mathrm{FeS_2}\), conocida como tontos oro por su color dorado). El mineral que contiene sulfato más común es el yeso\(\mathrm{CaSO_4 \cdot 2H_2O}\),, también conocido como yeso de París.
El proceso de Frasch se basa en el hecho de que el azufre tiene un punto de fusión comparativamente bajo. El proceso expulsa el azufre (99.5% puro) mediante el uso de agua caliente y aire. En este proceso, el agua sobrecalentada es forzada a bajar por la parte más externa de las tres tuberías concéntricas. El aire comprimido se bombea por el tubo central y una mezcla de azufre elemental, agua caliente y aire sube por la tubería central. El azufre se funde con agua sobrecalentada (a 170 °C bajo alta presión) y se fuerza a la superficie de la tierra como una suspensión.
El azufre se utiliza principalmente para la producción de ácido sulfúrico,\(\ce{H2SO4}\). La mayor parte del azufre extraído por el proceso de Frasch se utiliza en la industria para la fabricación de ácido sulfúrico. El ácido sulfúrico, el químico más abundantemente producido en Estados Unidos, se fabrica mediante el proceso de contacto. La mayor parte (alrededor del 70%) del ácido sulfúrico producido en el mundo se utiliza en la industria de fertilizantes. El ácido sulfúrico puede actuar como un ácido fuerte, un agente deshidratante y un agente oxidante. Sus aplicaciones utilizan estas propiedades. El azufre es un elemento esencial de la vida en las proteínas que contienen azufre.
Aplicaciones
El azufre tiene muchas aplicaciones prácticas. Como fungicida, el azufre se utiliza para contrarrestar la costra de la manzana en la producción de manzana cultivada orgánicamente. Otros cultivos que utilizan fungicidas de azufre incluyen uvas, fresas y muchos vegetales. En general, el azufre es efectivo contra las enfermedades del moho y la mancha negra. El azufre también se puede utilizar como insecticida orgánico. Los sulfitos se utilizan frecuentemente para blanquear papel y conservar frutos secos.
La vulcanización del caucho también incluye el uso de azufre. El celofán y el rayón se producen con disulfuro de carbono, un producto de azufre y metano. Los compuestos de azufre también se pueden encontrar en detergentes, tratamientos para el acné y agroquímicos. El sulfato de magnesio (sal de epsom) tiene muchos usos, que van desde aditivos de baño hasta exfoliantes. El azufre también se utiliza cada vez más como fertilizante. Debido a que el azufre estándar es hidrófobo, es cubierto con un surfactante por bacterias antes de que pueda ocurrir la oxidación. Por lo tanto, el azufre es un fertilizante de liberación lenta. Por último, el azufre funciona como medio generador de luz en lámparas de azufre.
El ácido sulfúrico concentrado fue una vez uno de los químicos más producidos en Estados Unidos, la mayoría del H 2 SO 4 que ahora se produce se utiliza en fertilizantes. También se utiliza en la refinación de petróleo, producción de dióxido de titanio, en fuentes de alimentación de emergencia y baterías de automóviles. El yeso mineral es sulfato de calcio dihidratado se utiliza en la fabricación de yeso de París. Más de un millón de toneladas de sulfato de aluminio se producen cada año en Estados Unidos al reaccionar H 2 SO 4 y Al 2 O 3. Este compuesto es importante en la purificación del agua. El sulfato de cobre se utiliza en galvanoplastia. Los sulfitos se utilizan en la industria de fabricación de papel porque producen una sustancia que recubre la celulosa en la palabra y libera las fibras de la madera para su tratamiento.
Emisiones y Medio Ambiente
Las partículas, SO 2 (g) y la niebla H 2 SO 4 son los componentes del smog industrial. Debido a que las centrales eléctricas queman carbón o fuelóleos con alto contenido de azufre, el SO 2 (g) se libera al aire. Cuando se cataliza en las superficies de partículas en el aire, el SO 2 se puede oxidar a SO 3. Una reacción con NO 2 funciona tan bien como se muestra en la siguiente reacción:
\[ SO_{2(g)} + NO_{2(g)} \rightarrow SO_{3(g)} + NO_{(g)}\]
Luego se produce la niebla H 2 SO 4 después de que el SO 3 reacciona con el vapor de agua en el aire. Si H 2 SO 4 reacciona con NH 3 aerotransportado, se produce (NH 4) 2 SO 4. Cuando SO 2 (g) y H 2 SO 4 alcanzan niveles que superan los 0.10 ppm, son potencialmente dañinos. Al eliminar el azufre de los combustibles y controlar las emisiones, la lluvia ácida y el smog industrial pueden mantenerse bajo control. Se han presentado procesos como la combustión en lecho fluidizado para eliminar SO 2 de los gases de chimenea.
Enlaces externos
- Dhawale, S.W. “Tiosulfato: Un oxoanión de azufre interesante que es útil tanto en la medicina como en la industria, pero que está implicado en la corrosión”. J. Chem. Educ. 1993, 70, 12.
- Lebowitz, Samuel H. “Un modelo de trabajo de demostración del proceso de Frasch para la minería de azufre”. J. Chem. Educ. 1931, 8, 1630.
- Nagel, Miriam C. “Herman Frasch, rey del azufre (PERFILES).” J. Chem. Educ. 1981, 58, 60.
- Riethmiller, Steven. “Charles H. Winston y el ácido sulfúrico confederado”. J. Chem. Educ. 1995 72 575.
- Sharma, B. D. “Alótropos y polimorfos”. J. Chem. Educ. 1987, 64, 404.
- Silverstein, Todd P.; Zhang, Yi. “Deshidratación de azúcar sin ácido sulfúrico: ¡no más humos asfixiantes en el aula!” J. Chem. Educ. 1998 75 748.
- Tykodi, R. J. “En alabanza al tiosulfato”. J. Chem. Educ. 1990, 67, 146.
- Thomas Jefferson National Accelerator Facility - Oficina de Educación Científica”. Es Elemental-El Elemento Azufre”. Laboratorio Jefferson.
- Cáscara de electrones de azufre
Referencias
- Petrucci, Ralph H. Química General, Principios y Aplicaciones Modernas. Editorial Macmillan, Novena Edición. Página 930-937.Karchmer, J.H.. La Química Analítica del Azufre y sus Compuestos. Nueva York: John Wiley & Sons, Inc., 1970.
Problemas
- Dibuja un diagrama que resuma la alotropía del azufre. Usa símbolos, flechas y números.
- La combustión directa de azufre es el único método para producir SO 2 (g). Verdadero o Falso.
- Los sulfitos no son agentes oxidantes. Son buenos agentes reductores. Verdadero o Falso.
- Dar la reacción para la producción de trióxido de azufre.
- Elija la declaración incorrecta.
- El azufre produce celofán y rayón.
- El azufre estándar es hidrofóbico.
- SO 2 puede oxidarse a SO 3
- El azufre influye en el desarrollo de la lluvia ácida y el smog industrial.
- Todo lo anterior es correcto.
- ¿Qué reacción es la responsable de la destrucción de estatuas y edificios de piedra caliza y mármol?
- \(\ce{CaCO3 \rightarrow CaO + CO2}\)
- \(\ce{SO2 + H2O \rightarrow H2SO3}\)
- \(\ce{BaO + CO2 \rightarrow BaCO3 \rightarrow BaSO3}\)tras la reacción con\(\ce{SO2}\)
- \(\ce{CaCO3 + H2O \rightarrow Ca(OH)2 + CO2}\)
- \(\ce{CaCO3 + SO2 \rightarrow CaSO3 + CO2 \rightarrow CaSO4}\)tras la oxidación
- Dar la fórmula del ion tiosulfato.
- ¿Cuál es el estado de oxidación de\(\ce{S}\) in\(\ce{SF6}\)\(\ce{H2SO4}\),\(\ce{NaHSO4}\),,\(\ce{SO4^2-}\), y\(\ce{SO3}\)?
- ¿Cuál es la fase del azufre a 298 K? Ingresa el tipo de cristales.
- Dar el nombre del proceso por el cual el azufre es forzado a salir del suelo usando agua caliente y aire.
Soluciones
- El diagrama puede ser dibujado de cualquier manera. Sin embargo, los símbolos (S2), (S 4), (S 6), (S? ), y S 8 (g) deben estar incluidos. Las temperaturas deben escribirse junto a las flechas.
- Falso
- Falso
- \(2 SO_{2(g)} + O_{2(g)} \rightarrow 2 SO_{3(g)}\)
- A
- e.
Considerar...
\(\ce{SO2}\)in\(\ce{H2SO3}\) es el ácido en la lluvia ácida, que ataca\(\ce{CaCO3}\), canicas. \(\ce{SO2}\)reduce los pigmentos en materia orgánica - \(\ce{S2O3^2-}\)
Considerar...
El sulfato es\(\ce{SO4^2-}\); reemplazo de un\(\ce{O}\) por un\(\ce{S}\) da tiosulfato\(\ce{S2O3^2-}\). Los dos\(\ce{S}\) en\(\ce{S2O3^2-}\) tienen diferentes estados de oxidación: uno es +6, el otro es (-2), promedio +2. - 6
Considera...
El estado de oxidación para\(\ce{S}\) in\(\ce{H2SO3}\)\(\ce{SO3^2-}\),\(\ce{SO2}\),, etc. es 4. El estado de oxidación de\(\ce{S}\) es el mismo para todos en la lista. - azufre rómbico
Considerar...
El término rómbico describe un tipo de cristal. El azufre monoclínico es metaestable a 298 K. - Proceso de Frasch
Considerar...
El proceso de Frasch se utiliza para extraer azufre elemental.
Colaboradores y Atribuciones
- StackExchange
Chung (Peter) Chieh (Chemistry, University of Waterloo)

