9.3: Nomenclatura y Ligandos
- Page ID
- 81558
Los sistemas de nomenclatura y fórmulas se pretenden como herramientas, a emplear en la medida en que sean útiles
Existen reglas bien establecidas para nombrar y escribir las fórmulas de los compuestos de coordinación. El propósito de estas reglas es facilitar una comunicación clara y precisa entre los químicos. Al igual que con todas esas reglas, algunas son más gravosas que otras de emplear, y algunas cumplen papeles más cruciales en el proceso de comunicación mientras que otras son más periféricas -y todas están mal utilizadas al servicio de la tiranía pedante, especialmente cuando se usan contra quienes de otra manera están haciendo un buen trabajo. Por ello, se le exhorta a acercarse a las reglas con un espíritu de generosidad hacia los demás en
- nombrar y escribir fórmulas con la mayor precisión posible para que los ligandos y los metales estén donde los lectores los esperan y así puedan entender lo que quiere decir con mayor facilidad.
- ser amable con los muchos químicos inorgánicos profesionales que se adhieren vagamente a algunas de las reglas que estás a punto de aprender.
- reconociendo que en los casos en que una estructura es particularmente compleja y una imagen puede hacer que sea particularmente útil, debe proporcionar una (Ver la nota a continuación).
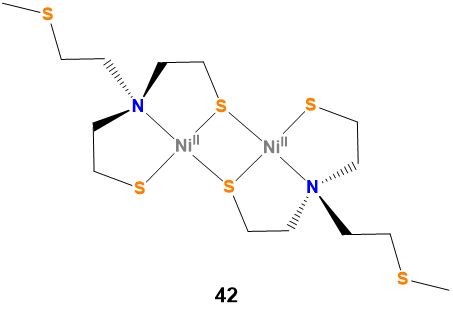
Aunque las reglas de nomenclatura de la IUPAC permiten especificar incluso las estructuras más complejas, a menudo es mucho más fácil y efectivo suministrar una estructura numerada a la que se pueda hacer referencia en lugar del nombre de la IUPAC. Considere bis {[(\(\mu\)-2-mercaptoetil) (2-mercaptoetil) -metiltioetilaminato (2-)] Níquel (II)}. ¿Cuál es más fácil, esperar que lectores y oyentes resuelvan la estructura a partir de ese nombre o simplemente remitirlos al compuesto 42 en Scheme\(\sf{\PageIndex{I}}\)?
Los complejos de coordinación se nombran como los derivados del ligando de un metal
Una variedad de sistemas se han utilizado para nombrar compuestos de coordinación desde el desarrollo de la disciplina en la época de Alfred Werner. En esta sección se describirán los enfoques más comunes ya que actualmente son utilizados por los químicos en ejercicio. Se alienta a quienes necesitan un conocimiento más minucioso y preciso de las reglas completas de nomenclatura de la IUPAC a consultar la breve guía de nomenclatura inorgánica de la IUPAC seguida de pautas completas, comúnmente conocidas como el libro rojo de la IUPAC. Si esos todavía no son suficientes una lectura cuidadosa de nota\(\sf{\PageIndex{1}}\) is suggested.
Los sistemas para nombrar compuestos de coordinación utilizados en la actualidad son aditivos, lo que significa que consideran que los compuestos de coordinación comprenden un metal central al que se le añaden ligandos. Para especificar la estructura y unión en este complejo metal-ligando implica entonces:
- cuando existen varias formas diferentes de unir el metal y los ligandos, especificando el estereoisómero estructural
- enumerar sistemáticamente los ligandos de manera que, según sea necesario, transmita información sobre cómo están vinculados al metal y su estereoquímica
- proporcionar la identidad del metal y su estado de oxidación, o si el estado de oxidación no está claro, al menos la carga global en el complejo
- especificar los contraiones presentes
Dado que la estereoquímica de los compuestos de coordinación forma el tema de la siguiente sección, en esta sección se abordará simplemente dando los prefijos que designan a la estereoquímica como si fueran evidentes. No te preocupes por estos por ahora. Tendrán sentido después de que hayas aprendido más sobre la estereoquímica en la siguiente sección. En ese momento, puedes repasar los ejemplos de esa sección para solidificar tu comprensión de cómo nombrar los compuestos de coordinación.
Sin embargo, para nombrar con precisión los compuestos de coordinación necesitarás aprender a pensar y nombrar a los ligandos primero.
Ligandos
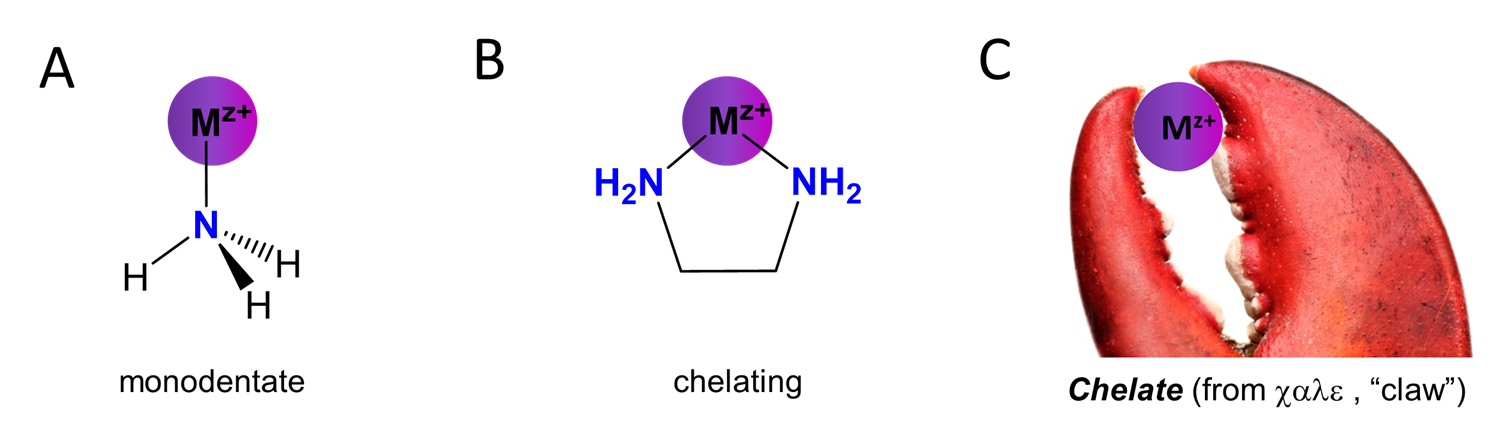
Los ligandos se clasifican en función de si se unen al centro metálico a través de un solo sitio en el ligando o si se unen en múltiples sitios. Los ligandos que se unen a través de un solo sitio se llaman monodentados de la palabra latina para diente; en contraste, los que se unen a través de múltiples sitios se llaman quelantes después del griego\(\chi \alpha \lambda \epsilon \) para “garra”. Estas relaciones se resumen en la Figura\(\sf{\PageIndex{1}}\).
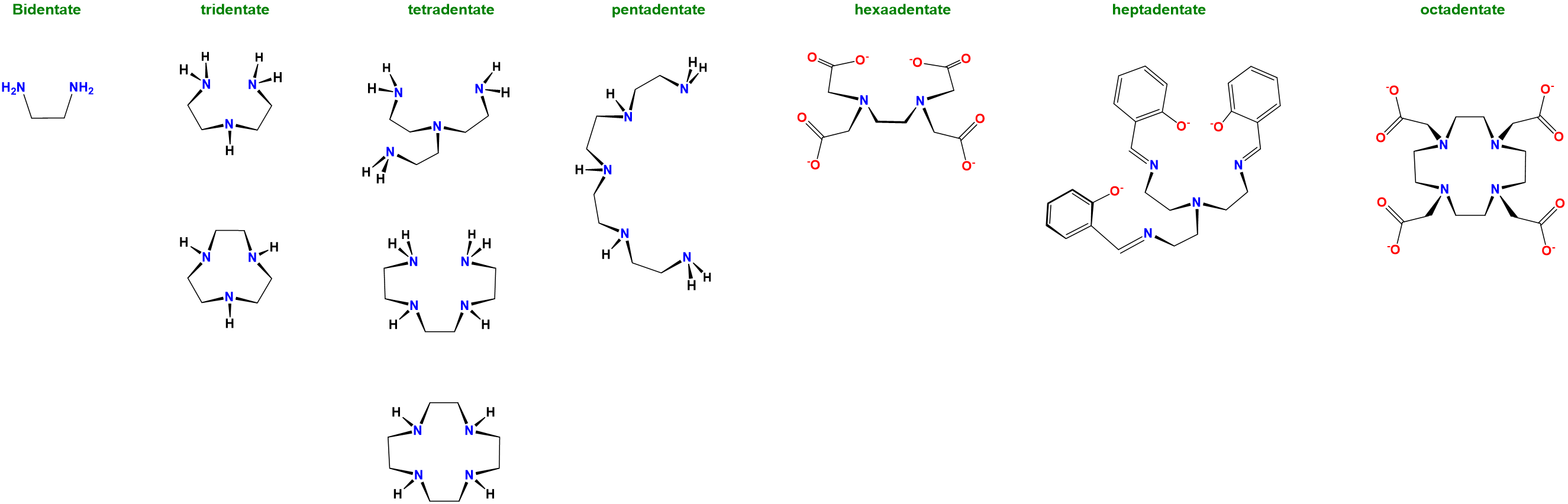
Siguiendo naturalmente la clasificación de los ligandos no quelantes como monodentados, los ligandos quelantes se clasifican adicionalmente de acuerdo con el número de sitios que pueden usar para unirse a un centro metálico. Este número de sitios de unión se denomina denticidad y los ligandos se denominan monodentados (no quelantes), bidentados, tridentados, etc., con base en el número de sitios disponibles. Los ligandos con dos sitios de unión tienen una denticidad de dos y se dice que son bidentados; aquellos con tres son tridentados, cuatro tetradentados, y así sucesivamente. Para ilustrar este sistema de clasificación se dan ejemplos de ligandos quelantes clasificados de acuerdo con la denticidad en el Esquema\(\sf{\PageIndex{I}}\).
Esquema\(\sf{\PageIndex{I}}\). Selección de ligandos quelantes clasificados según denticidad.
Aunque solo un oxígeno carboxilato generalmente se une a un metal, todavía es posible unir un metal usando ambos oxígenos. Como se muestra en el Esquema\(\sf{\PageIndex{IIB}}\), se conocen complejos en los que ambos carboxilatos se unen a un metal, y de hecho son comunes en los sitios activos de algunas enzimas. Es solo que la unión de ambos oxígenos da un anillo tenso de cuatro miembros que suele ser inestable.
Esquema\(\sf{\PageIndex{II}}\). (A) Solo un oxígeno por carboxilato cuenta hacia la denticidad del EDTA ya que al unirse el otro oxígeno generalmente apunta lejos del centro metálico, como en la estructura del Fe (EDTA) -. Esto no significa que ambos oxígenos de un carboxilato nunca puedan unirse ambos a centros metálicos en un complejo. (B) Las estructuras en las que ambos oxígenos de una cadena lateral de carboxilato se unen a un metal a veces se encuentran en los sitios activos de algunas de las enzimas de hierro no hemo que su cuerpo usa para descomponer los aminoácidos.
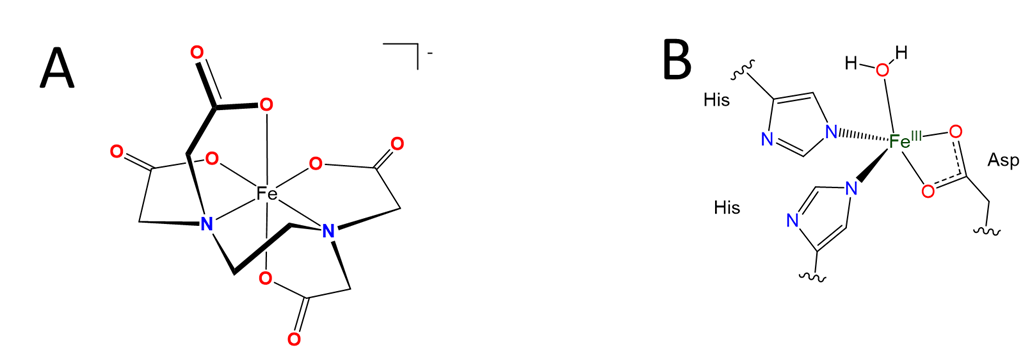
Esquema\(\sf{\PageIndex{III}}\). Al igual que en este complejo, los ditiocarbamatos comúnmente unen metales a través de ambos átomos de azufre. En consecuencia, los ditiocarbamatos se clasifican como bidentados. Esta obra de Stephen Conakes está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Debido a estos factores es técnicamente más correcto decir que los carboxilatos suelen actuar como ligandos monodentados y los ditiocarbamatos bidentados que decir que los carboxilatos son ligandos monodentados y los ditiocarbamatos bidentados. Entonces, en otras palabras, las clasificaciones de ligandos presentadas aquí solo representan modos de unión comunes.
Determinar la denticidad de cada ligando en la siguiente lista y clasificarlos como monodentados, tridentados, etc.
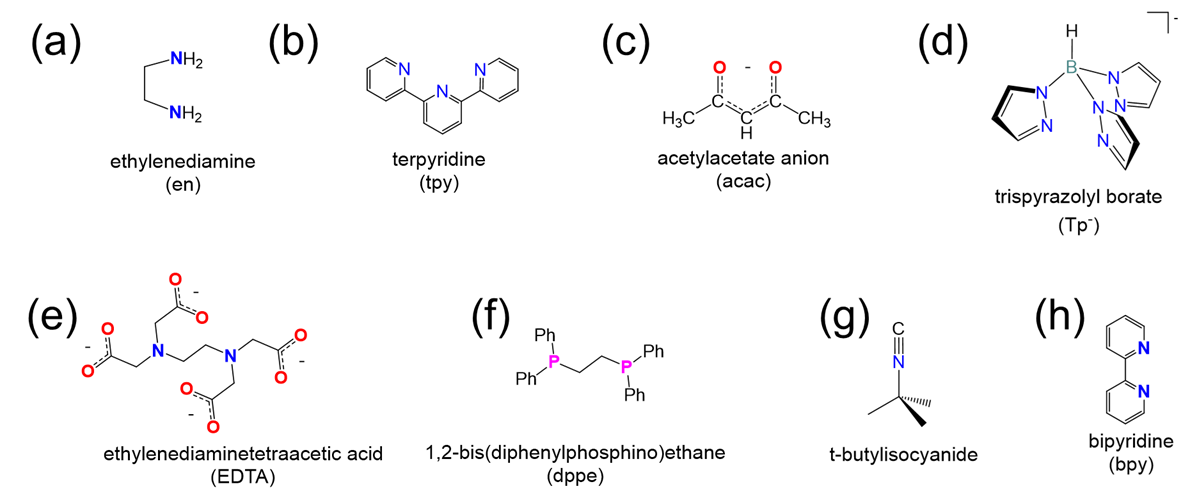
- Contestar
-
(a) bidentados
b) tridentados
c) bidentados
(d) tridentado (solo el N inferior de cada anillo tiene un par solitario que se puede usar para unir el metal)
e) hexadentado (recuerde que cada carboxilato solo cuenta como un punto de unión)
f) bidentados
(g) monodentado (a través del par solitario en el cianuro C)
h) bidentados
Esta clasificación de base experimental de ditiocarbamatos como bidentado y carboxilatos como monodentado puede ser confusa para un principiante. Afortunadamente, tales clasificaciones basadas experimentalmente están incrustadas en las listas de ligandos monodentados comunes como se dan en la Tabla\(\sf{\PageIndex{1}}\) y ligandos quelantes comunes en la Tabla\(\sf{\PageIndex{2}}\).
Una lectura de los ligandos en la Tabla\(\sf{\PageIndex{1}}\) revela que varios pueden unirse a un metal de múltiples maneras. Por ejemplo, tiocianato, SCN - puede unir metales a través de sus átomos S o N. Dichos ligandos se denominan ligandos ambidentados. Al nombrar un ligando ambidentado, el átomo a través del cual se une al metal se especifica comúnmente después del nombre del ligando usando el símbolo del elemento en cursiva o, más formalmente, a\(\kappa\) seguido del símbolo del elemento en cursiva. Un ejemplo se da en Scheme\(\sf{\PageIndex{I}}\). 2
Esquema\(\sf{\PageIndex{I}}\). Dos posibles modos de unión de nitrito actuando como ligando. 3
| Ligando | Nombre común | Nombre de la IUPAC |
|---|---|---|
| H - (Los ligandos H siempre se consideran aniones para fines de nomenclatura) | hydrido | hydrido |
| F - | fluoro | fluorido |
| Cl - | cloro | clorido |
| Br - | bromo | bromido |
| I - | iodo | iodido |
| CN -, como M-CN | ciano | cianuro o cianuro-\(\kappa\) C o cianuro- C |
| CN -, como M-NC | isociano | isocianido o cianuro-\(\kappa\) N o cianuro- N |
| CH 3 NC | metilisocianuro | metilisocianuro |
| N 3 - | azido | azido |
| SCN -, por ejemplo, tiocianato como M-SCN | tiocianato | tiocianato-\(\kappa\) S o tiocianato- S |
| NCS -, por ejemplo, tiocianato como M-NCS | isotiocianato | tiocianato-\(\kappa\) N o tiocianato- N |
| CH 3 CO 2 - | acetato | etanoato |
| N 3- | nitrido | nitrido |
| NH 2 - | imido | azanediido |
| NH 2 - | amido | azanido |
| NH 3 | ammine | ammine |
| RNH 2, R 2 NH, R 3 N |
alquilamina, dialquilamina, trialcalamina (por ejemplo, metilamina para CH 3 NH 2) |
alquilamina, dialquilamina, trialcalamina (por ejemplo, metilamina para CH 3 NH 2) |
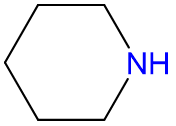 , piperidina, pip abreviado , piperidina, pip abreviado |
piperidina | piperidina |
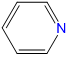 , piridina, abreviado py , piridina, abreviado py |
piridina | piridina |
| CH 3 CN, acetonitrilo, MeCN abreviado | acetonitrilo | acetonitrilo |
| P 3- | fosfido | fosfido |
| PH 3 | fosfina | fosfano |
| PR 3 | trialquilfosfina (por ejemplo, trimetilfosfina para Me 3 P) | trialquilfosfano (por ejemplo, trimetilfosfano para Me 3 P) |
| PaR 3 | triarilfosfina (por ejemplo, trifenilfosfina para Ph 3 P) | triarilfosfina (por ejemplo, trifenilfosfano para Ph 3 P) |
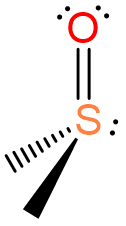 , dimetilsulfóxido o DMSO o dmso , dimetilsulfóxido o DMSO o dmso |
dimetilsulfóxido (a veces llamado dimetilsulfoxo pero este uso es raro y viola las reglas de nomenclatura para ligandos neutros) |
(metanosulfinil) metano o dimetil (óxido) azufre |
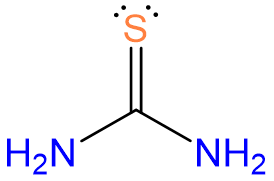 , tiourea o tu , tiourea o tu |
tiourea | tiourea |
| O 2- | oxo | Óxido |
| OH - | hidroxo | hidróxido |
| H 2 O | aqua | aqua |
| S 2- | sulfo | sulfo |
| HS - | hidrosulfido | hidrosulfido |
| RS - | alcanotiolato (por ejemplo, etantiolato para ET -) | tioalcanoato |
| H 2 S | sulfuro de hidrógeno | sulfuro de hidrógeno |
| R 2 S | alquilsulfanilalcano (por ejemplo, etilsulfaniletano para Et 2 S) | sulfuro de dialquilo |
| O 2 | dioxígeno | dioxígeno |
| O 2 -, superóxido | superóxido | di6xido (1-) o super6xido |
| O 2 2 -, peróxido | peróxido | dióxido (2-) o peróxido |
| N 2 | dinitrogen | dinitrogen |
| NO (siempre se consideran neutrales para fines de nomenclatura) | nitrosil | nitrosil |
| CO | carbonilo | carbonilo |
| CS | tiocarbonilo | tiocarbonilo |
| SO, como M-SO | sulfino | monóxido de azufre-\(\kappa\) S o monóxido de azufre- S |
| NO 2, como M-NO 2 | nitryl | dióxido de nitrógeno-\(\kappa\) N o dióxido de nitrógeno- N |
| CO 3 2 - | carbonato | carbonato |
| NO 2 -, como M-NO 2 | nitro o nitrito- N | nitrito-\(\kappa\) N o nitrito- N |
| NO 2 -, como M-ONO | nitrito o nitrito- O | nitrito-\(\kappa\) O o nitrito- O |
| NO 3 - | nitrato | nitrato |
| SO 3 2 - | sulfito | sulfito |
| SO 4 2 - | sulfato | sulfato |
| S 2 O 3 2 -, como M-S-SO 2 -O - | tiosulfato- S | tiosulfato-\(\kappa\) S o tiosulfato- S |
| S 2 O 3 2 -, como M-O-SO 2 -S - | tiosulfato- O | tiosulfato-\(\kappa\) O o tiosulfato- O |
| Nombre común del ligando | Nombre del ligando IUPAC | abreviatura (si procede) | estructura o estructura representativa/padre (mostrada en el estado de ionización en el que se unen a un metal) |
|---|---|---|---|
| ligandos bidentados | |||
| acetilacetonato | 2,4-pentanediono | acac | 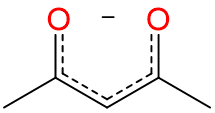 |
| R-BINAP y S-BINAP | R - o S-2,2'-bis (difenilfosfino) -1,1'-binafilo | BINAP | 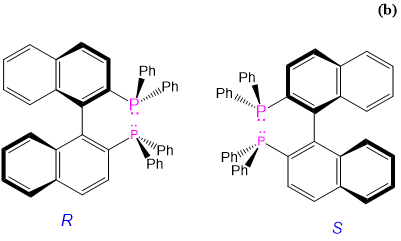 |
| 2,2'-bipiridina | 2,2'-bipiridina | bpy o bipy | 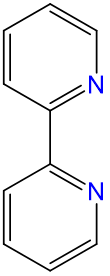 |
| ciclooctadieno | 1,5-ciclooctadieno | BACALAO |
(la unión al metal ocurre a través de la\(\pi\) nube de alqueno) |
| dialquilditiocarbamato | dialquilcarbamoditiolato | R 2 NCS 2 - o dtc | 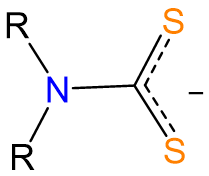 |
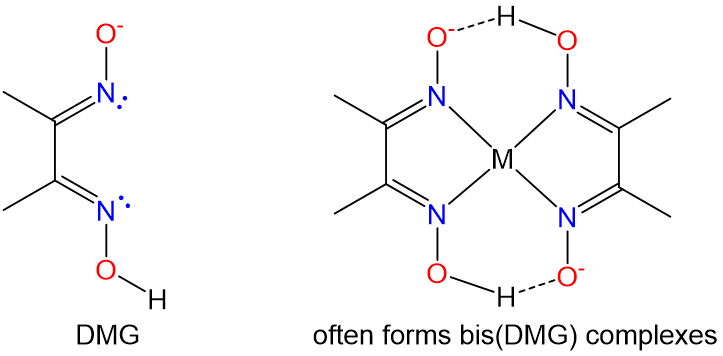
| dimetilgloximato | butanodienodioxima |
Hdmg o DMG |
 |
|
difenilfosfinoetano o 1,2- (difenilfosfino) etano |
Etano-1,2-diilbis (difenilfosfano) | dppe | 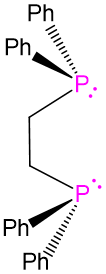 |
| etilendiamina | Etano-1,2-diamina | es | 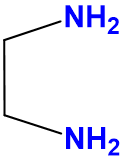 |
| etilenditiolato | Etano-1,2-ditiolato | C 2 H 2 S 2 2 - | 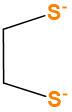 |
| nacnac | N, N' -difenil-2,4-pentanodiiminato | nacnac | 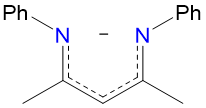 |
| oxalato | oxalato | buey | 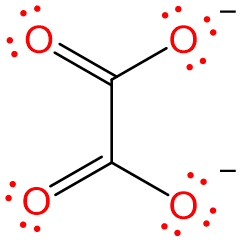 |
| 1,10-fenantrolina u o-fenantrolina | 1,10-fenantrolina | phen o -phen | 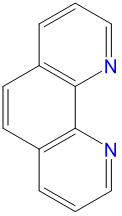 |
| fenilpiridinato |
2-Fenilpiridinato-C 2, N o 2-fenilpiridinato-\(\kappa\) C 2, N |
ppy | 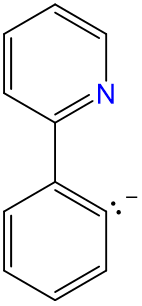 |
| ligandos tridentados | |||
| triazaciclononano | 1,3,7-triazaciclononano | tacn | 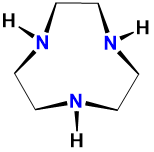 |
| dietientriamina | 1,4,7-triazaheptano | dien | 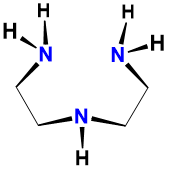 |
|
pirazoilborato (escorpionato) |
hidrotris (pirazo-1-il) borato | Tp | 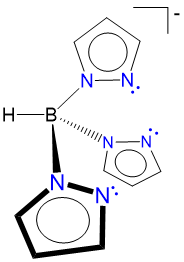 |
|
terpiridina o 2,2'; 6',2"-terpiridina |
1 2 ,2 2:2 6 ,3 2 -terpiridina o 2,6-bis (2-piridil) piridina, tripiridilo, 2,2′:6′,2″-terpiridina |
tpy o terpy | 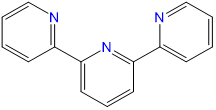 |
| ligandos tetradentados | |||
| \(\beta\),\(\beta\) ',\(\beta\) “-triaminotrietilamina | \(\beta\),\(\beta\) ',\(\beta\) “-tris (2-aminoetil) amina | tren | 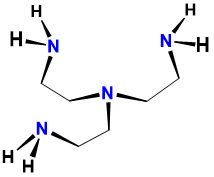 |
| trietilatetramina | 1,4,7,10-tetraazadecano | trien | 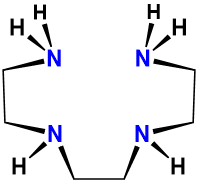 |
| corroe | variable y generalmente no utilizada | cor o Cor | 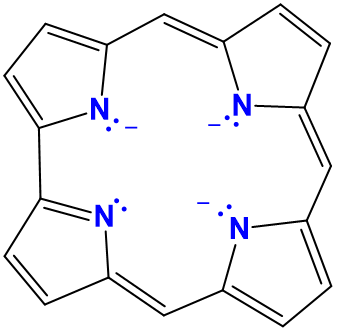 |
| 12-corona-4 | 1,4,7,10-tetraoxaciclododecano | 12-corona-4 | 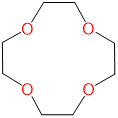 |
| tetrametilciclam | 1,4,8,11-tetrametil-1,4,8,11-tetraazaciclotetradecano | TMC o ciclam | 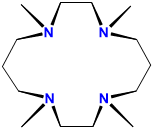 |
| ciclam | 1,4,8,11-tetraazaciclotetradecano | ciclam | 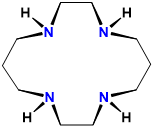 |
| ciclen | 1,4,7,10-tetraazaciclododecano | ciclen | 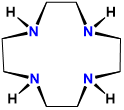 |
| tris (2-piridilmetil) amina | 1-piridin-2-il-N, N-bis (piridin-2-ilmetil) metanamina | tpa o TPA | 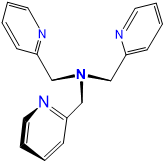 |
| ftalocianinas | variable y generalmente no utilizada | variable, generalmente una Pc modificada | 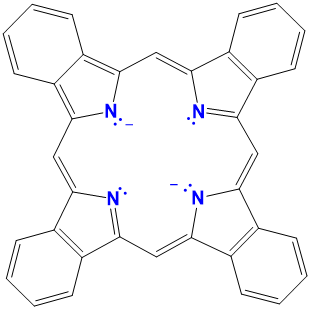 |
| porfirinas | variable y generalmente no utilizada |
variable, generalmente un por, Por o P modificado (por ejemplo, TPP = tetrafenilporfirina) |
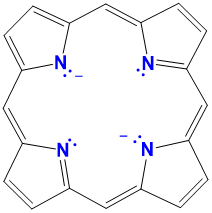 |
| salen | 2,2'-etilenbis (nitrilometilideno) difenóxido | salen | 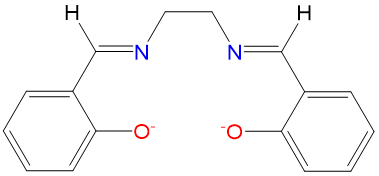 |
| ligandos pentadentados | |||
| 15-corona-5 | 1,4,7,10,13-pentaoxaciclopentadecano | 15-corona-5 | 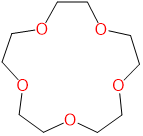 |
| tetraetilenpentamina | 1,4,7,10,13-pentaazatridecano | tepa o TEPA | 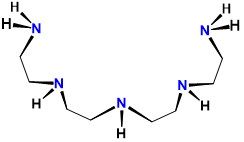 |
| ligandos hexadentados | |||
| 18-corona-6 | 1,4,7,10,13,16-hexaoxaciclooctadecano | 18-corona-6 | 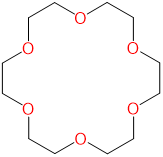 |
| 2,1,1-criptand | 4,7,13,18-Tetraoxa- |
2,1,1-cripta o [2.1.1] -cryptand Kryptofix 211 y variaciones de los mismos |
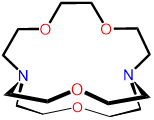 |
| etilendiaminotetraaceto | 2,2′,2″,2′- (etano-1,2-diildinitrilo) tetraaceto | EDTA, EDTA, Y 4- | 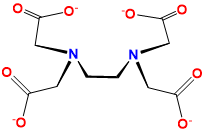 |
| ligandos heptadentados | |||
| 2,2,1-criptand | 4,7,13,16,21-pentaoxa- |
2,2,1-cripta o [2.2.1] -cryptand Kryptofix 221 y variaciones de los mismos |
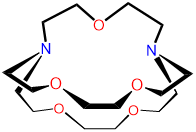 |
| ligandos octadentados | |||
| 2,2,2-criptand | 4,7,13,16,21,24-Hex |
2,2,2-cripta o [2.2.2] -cryptand kryptofix 222 y variaciones de los mismos |
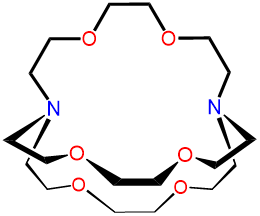 |
| pentetato ácido o dietilenetriaminepentaacetato o DTPA | 2- [bis [2- [bis (carboxilatometil) amino] etil] amino] acetato | DTPA | 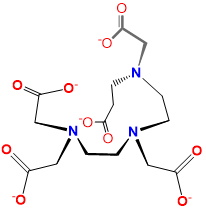 |
| DOTA o tetraxetán | Ácido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacético | Dota | 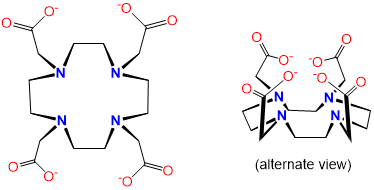 |
Reglas para Nombrar Compuestos de Coordinación
Como se explicó anteriormente, el nombre de un complejo de coordinación comunica
- según corresponda, información sobre isomería
- enumerar sistemáticamente los ligandos de manera que, según sea necesario, transmita información sobre su estado de oxidación y cómo se vinculan al metal
- la identidad del metal y su estado de oxidación
- cualquier contraión presente
Antes de entrar en estas reglas vale la pena señalar algunas cosas.
1. Es más fácil aprender estas reglas comenzando con una o dos de las reglas, aprendiendo a aplicarlas y luego agregando reglas adicionales una a la vez. Para ello, los instructores que deseen utilizar un enfoque más programado pueden encontrar conveniente dirigir primero a sus alumnos a esta página que se enfoca en acertar los nombres de los ligandos y el metal, sin preocuparse por el isomerismo o la estereoquímica.
2. Las reglas también asumen cierta familiaridad con geometrías de coordinación comunes y patrones de isomería en complejos metálicos. Por lo tanto, podría ser más fácil aprender primero sobre geometrías comunes de coordinación, seguido de patrones comunes de isomería en complejos metálicos antes de comenzar esta sección. Si decides sumergirte directamente en esta sección te puede resultar útil saber que al aplicar reglas de nomenclatura y fórmula la mayoría de los libros de texto asumen
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tiene un número de coordinación de cuatro son tetraédricos
Como todas las suposiciones, estas no siempre funcionan en la vida real pero deberían ser lo suficientemente buenas como para llevarte a través de tu primer curso de química inorgánica.
Para los pedantes entre ustedes, tenga en cuenta que los complejos dados como ejemplos y en ejercicios de esta página han sido seleccionados para su utilidad pedagógica. Aunque muchos son compuestos bien conocidos, otros son hipotéticos.
Ahora a las reglas.
Regla 1: Si hay iones presentes, nombra primero el catión, seguido del anión.
Ejemplos:
K 2 [Pt II Cl 4] tetracloroplatinato de potasio (2-)
[Co III (NH 3) 6] (NO 3) 3 hexaamminecobalt (3+) nitrato
[Co III (NH 3) 6] [Cr III (C 2 O 4) 3] hexaamminecobalt (3+) tris (oxalato) cromo (3-)
Regla 2: Cuando sean posibles múltiples isómeros, designe el isómero particular en cursiva al frente del nombre de cada complejo
Si aún no has aprendido del isomerismo en los compuestos de coordinación omita esta regla por ahora y vuelve a ella después de haberla.
Cuando un complejo puede existir como uno de los dos estereoisómeros, los prefijos se usan comúnmente para designar qué isómero está presente. Los casos más comunes se enumeran en la Tabla\(\sf{\PageIndex{3}}\).
| Tipo de isomería | Recordatorio gráfico | Prefijos |
|---|---|---|
| Geométrico, cis-, trans- | 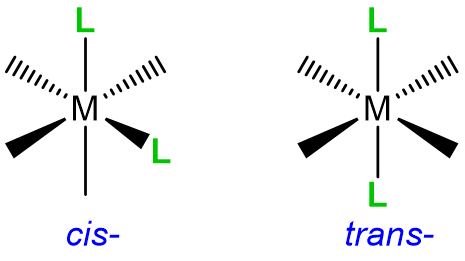 |
cis- o trans- |
| Geométrico, fac- /mer - | 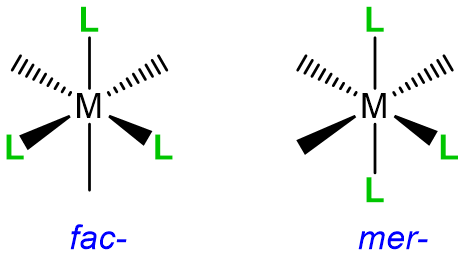 |
fac - o mer - |
| Enantiómeros,\(\Lambda\) -,\(\Delta\) - | 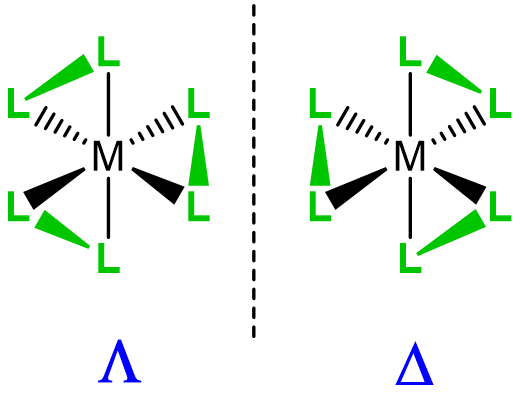 |
\(\Lambda\)- o\(\Delta\) - |
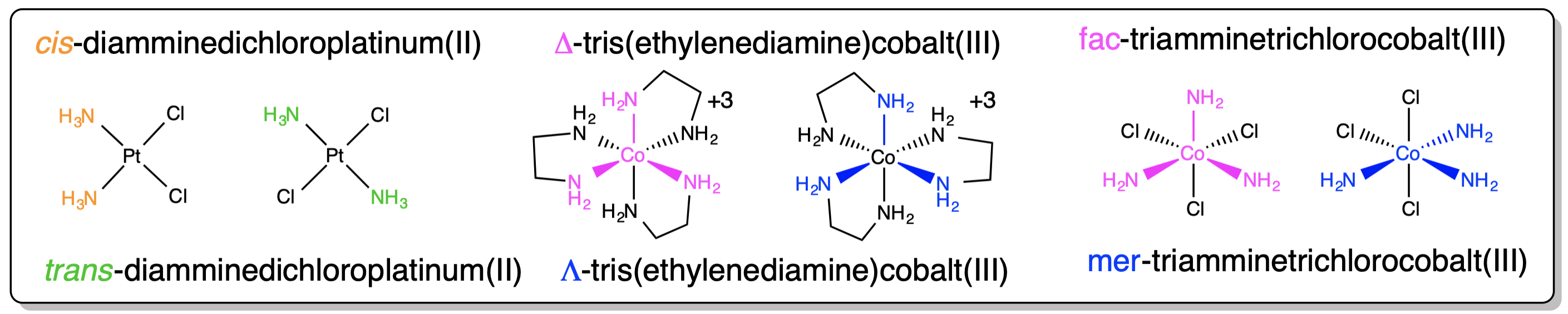
En el Esquema se dan ejemplos de cómo se designa el isomerismo sobre un centro metálico\(\sf{\PageIndex{II}}\).
Esquema\(\sf{\PageIndex{II}}\). Aplicación de reglas de nomenclatura para el estereosimismo sobre un metal. 3
Hay una serie de otros casos en los que podría ser aconsejable especificar la estereoquímica de un complejo. Estos casos implican especificar
- la geometría de coordinación alrededor de un centro metálico (octaédrico, prismático trigonal, tetraédrico, plano cuadrado, etc.)
- la geometría no puede describirse sin ambigüedades mediante una sola relación cis/trans o fac/mer de ligandos
Estos casos también pueden manejarse mediante el uso de un designador para especificar la geometría de coordinación y, según sea necesario, dar la posición de los átomos ligados en términos de posiciones numeradas designadas para esa geometría. Consulte el libro rojo de la IUPAC para más detalles ya que tales casos quedan fuera del alcance de lo que normalmente es recomendable para un curso de pregrado.
Regla 3: Especificar la identidad, número y, según corresponda, isomería de los ligandos presentes en orden alfabético por nombre de ligando.
Antes de especificar el metal, los ligandos se escriben como prefijos del metal.
Al especificar los ligandos se siguen varias reglas.
- Los ligandos están escritos en orden alfabético solo por el nombre del ligando; los símbolos no se consideran y los prefijos no cuentan en orden alfabético determinado.
Ejemplo: En nombre del ion complejo [Co (NH 3) 5 Cl] 2+, pentaminaclorocobalto (II), el ligando de amina se nombra antes que el ligando cloro porque el orden es alfabético por el nombre del ligando en virtud del cual la amina viene antes que el cloro.
- Se utilizan prefijos para indicar el número de cada ligando presente. Específicamente, se utilizan prefijos di -, tri -, tetra -, penta-, hexa-, etc. para indicar múltiples ligandos del mismo tipo EXCEPTO cuando el ligando es polidentado o su nombre ya tiene un di-, tri-, tetra- etc. en eso en su lugar se utilizan casos bis -, tris -, tetrakis -, etc. Estas reglas de prefijo se resumen en Tabla\(\sf{\PageIndex{3}}\).
| Número de ligandos idénticos | prefijo utilizado cuando el nombre del ligando es simple | prefijo utilizado cuando el ligando es polidentado o su nombre ya tiene un di-, tri-, tetra- etc. |
|---|---|---|
| 2 | di- | bis- |
| 3 | tri- | tris- |
| 4 | tetra | tetrakis- |
| 5 | penta- | pentakis- |
| 6 | hexa- | hexakis- |
| 7 | hepta | heptakis- |
| 8 | octa | octakis- |
| 9 | nona | nonakis- |
| 10 | deca- | decakis- |
Un ejemplo de la aplicación de la regla de prefijo se da en Scheme\(\sf{\PageIndex{III}}\).
Esquema\(\sf{\PageIndex{III}}\). Ejemplo del uso de prefijos para especificar el número de ligandos de cada tipo en un complejo. 3
- Los nombres de los ligandos se basan en su carga.
- Los nombres de ligandos neutros y catiónicos son los mismos que los nombres de sus compuestos neutros con dos advertencias:
- los nombres que involucran espacios deben ponerse entre paréntesis o se deben eliminar los espacios (preferido)
Ejemplo: cis-diclorobis (dimetilsulfóxido) platino (II) o cis - diclorobis (dimetilsulfóxido) platino (II)
- A algunos ligandos se les dan nombres comunes.
- H 2 O = aguamarina
- NH 3 = ammine (fíjese que hay dos n's)
- CO = carbonilo
- CS = tiocarbonilo
- NO = nitrosil
- Para los ligandos aniónicos, la vocal al final de sus nombres aniónicos se cambia a una -” o”
Ejemplos: Cl - = cloro, NH 2 - = amido, N 3 - = azido
Advertencia: algunos ligandos aniónicos tienen nombres comunes que también pueden usarse
Ejemplos:
I - = iodo o iodino
CN - = ciano o cianuro
O 2- = oxo u óxido
La IUPAC y los nombres comunes de muchos ligandos se dan en las Tablas\(\sf{\PageIndex{1}}\). y\(\sf{\PageIndex{2}}\).
- Cuando está presente un ligando ambidentado, el átomo a través del cual se une al metal se indica dando ya sea su símbolo de elemento o a\(\kappa\) y su símbolo de elemento en cursiva después del nombre del ligando.
Ejemplo:
M - SCN es tiocianato- S o tiocianato-\(\kappa\) S
M-NCS = tiocianato- N o tiocianato-\(\kappa\) N
El uso de\(\kappa\) un símbolo de elemento para indicar cómo se unen un ligando y un metal se denomina término k. Los términos k más complejos también podrían implicar especificar los átomos por número, aunque su uso está fuera del alcance de este texto.
- Según corresponda, se especifica información adicional sobre la forma en que un ligando se une al centro metálico y/o su estereoquímica usando un prefijo. Los prefijos para proporcionar enlace y estereoquímica para ligandos se dan en la Tabla\(\sf{\PageIndex{4}}\).
| Tipo de isomería | Recordatorio gráfico | Prefijos |
|---|---|---|
| cuando un ligando multidentado se une a través de menos del número completo de átomos | 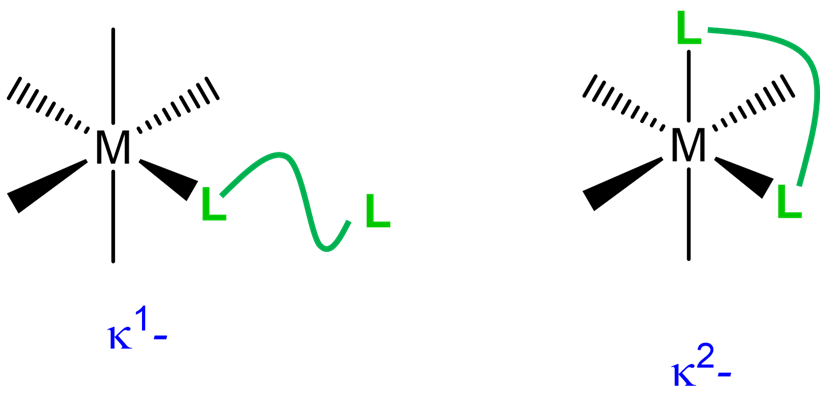 |
\(\kappa\)n donde n es el número de átomos unidos; se usa cuando los átomos unidos no están conectados directamente por un enlace químico. El enlace metal-ligando generalmente implica coordinación\(\sigma\) de tipo. |
| hapticidad | 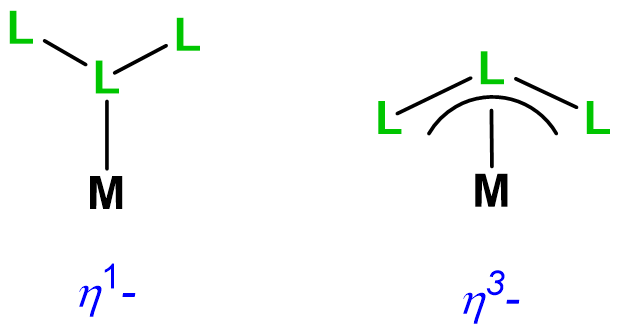 |
\(\eta\)n donde n es el número de átomos unidos; se usa cuando los átomos coordinados están todos conectados por enlaces. Por lo general, la unión metal-ligando implica coordinación\(\pi\) de tipo. En el habla,\(\eta^1\) =monohapto;\(\eta^2\) =dihapto;\(\eta^3\) =trihapto, etc. |
| ligandos de puente | 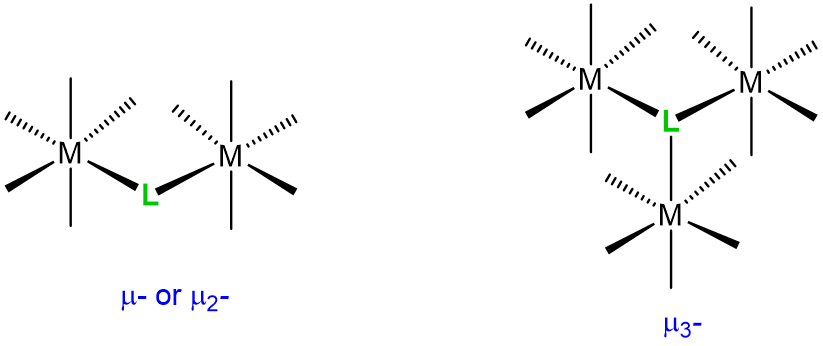 |
\(\mu\)n donde n es el número de átomos puenteados. El número n suele omitirse cuando n =2. |
| torsión del anillo del ligando quelante | 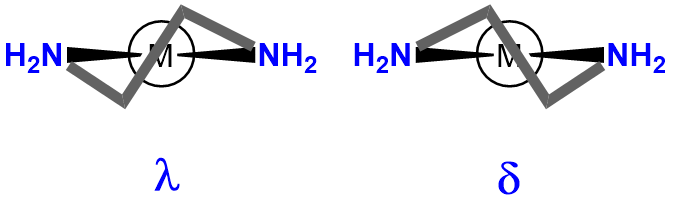 |
\(\lambda\)- o\(\delta\) - |
Un ejemplo que muestra cómo se aplica la regla de nomenclatura a un ligando que puede tener dos modos de coordinación se da en Esquema\(\sf{\PageIndex{IV}}\).
Esquema\(\sf{\PageIndex{IV}}\). Uso de la\(\kappa\) notación para especificar el número de grupos unidos en un ligando multidentado.
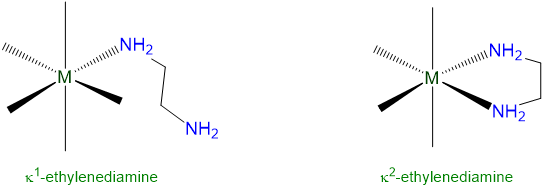
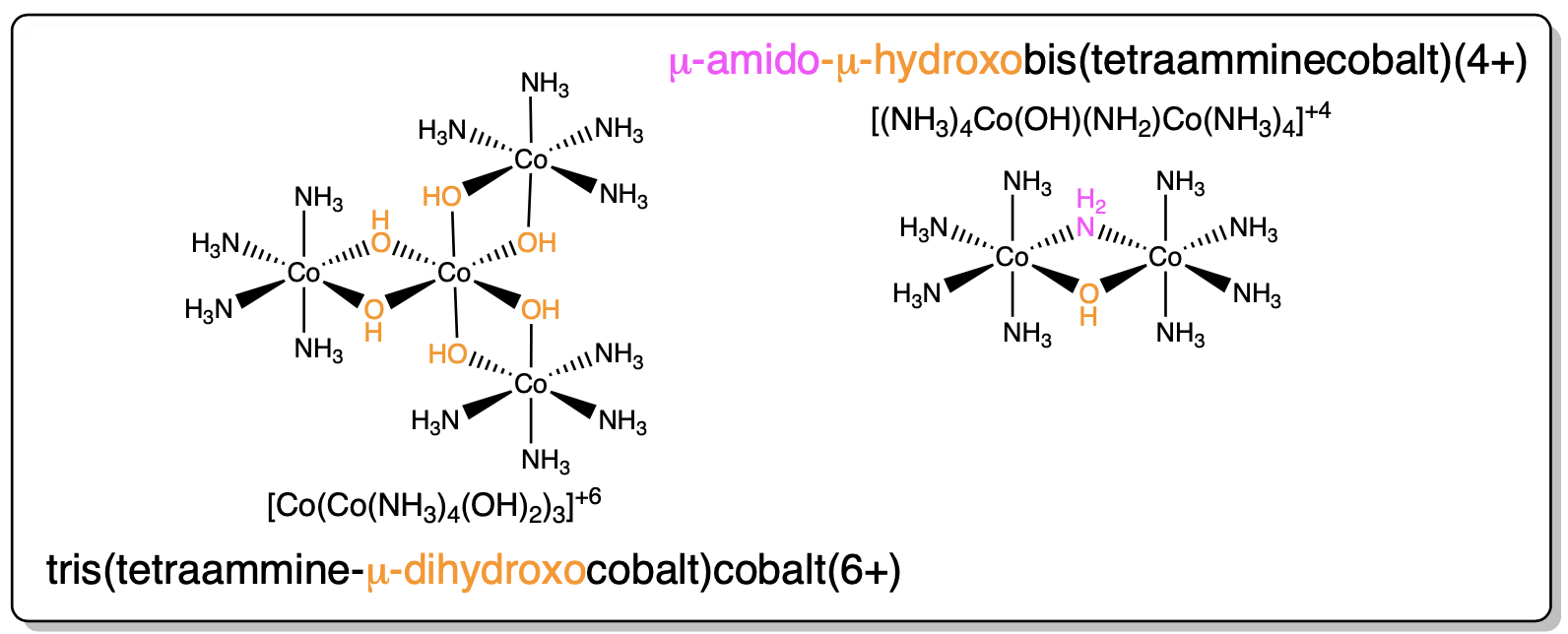
Esquema\(\sf{\PageIndex{V}}\). Uso de la\(\mu\) notación para especificar ligandos puente en complejos metálicos. 3
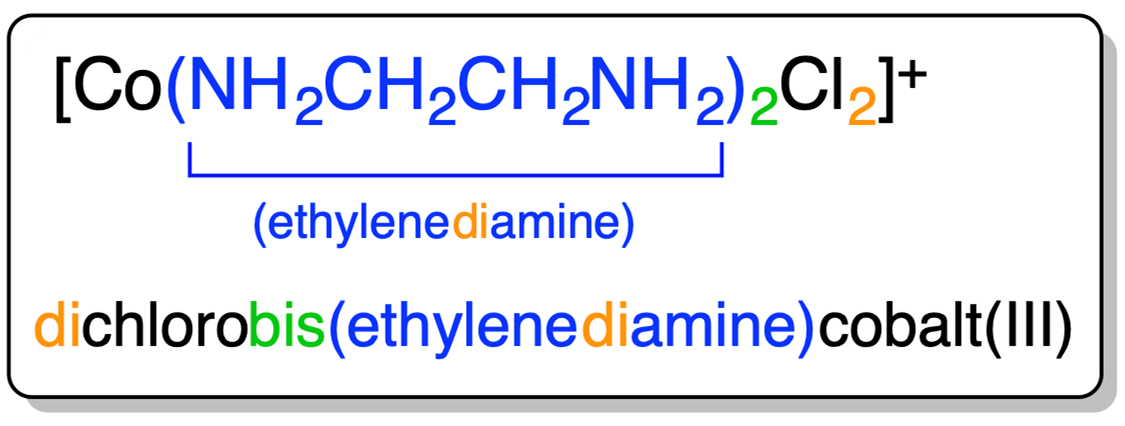
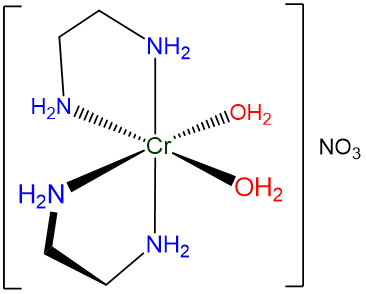
- Si se desea, se pueden usar paréntesis para delinear un nombre de ligando para facilitar su identificación en nombre del complejo. Esto puede ser particularmente útil cuando todo el nombre contiene mucha información para realizar un seguimiento. Un ejemplo se da en Scheme\(\sf{\PageIndex{VI}}\).
Esquema\(\sf{\PageIndex{VI}}\). Al nombrar el complejo mostrado, el nitrato de cis-diaquabis (etilendiamina) cromo (III) es más fácil de leer que el nitrato de cis-diaquabisetilendiaminecromio (III).
Regla 4: Especificar la identidad del metal
- En los complejos neutros y catiónicos se usa el nombre del metal directamente
- por ejemplo, como en rutenio hexammina (III) para [Ru (NH 3) 6] 3+
- En los complejos aniónicos, - ate reemplaza - ium, - en, o — ese o agrega al nombre del metal,
ej., como en el hexacloromanganato (IV) para MnCl 6 2 -
- En los complejos aniónicos de algunos metales se usa un nombre derivado del latino en lugar del nombre inglés del elemento. Estos nombres se dan en la Tabla\(\sf{\PageIndex{5}}\).
| Metal de transición | Latín |
|---|---|
| Cobre | Cuprate |
| Oro | Aurate |
| Hierro | Ferrate |
| Plomo | Plomada |
| Plata | Argentate |
| Estaño | Stannate |
Un ejemplo de la aplicación de las reglas de nomenclatura de metales se da en Scheme\ sf {\ pageIndex {VII}}\).
Esquema\(\sf{\PageIndex{VII}}\). Ejemplo de la aplicación de las reglas de especificación de metales a un complejo catiónico y uno aniónico de platino. 3

Regla 5: Especificar el estado de oxidación del metal.
Se utilizan dos sistemas diferentes para especificar el estado de oxidación del metal.
- En el sistema Stock el estado de oxidación del metal se indica en números romanos después del nombre del metal.
Ejemplos:
[COCl (NH 3) 5] Cl 2 = cloruro de pentaminaclorocobalto (III)
[pTbR 2 (bpy)] = dibromobipiridinoplatinio (II)
K [Ag (SCN) 2] = di-S-tiocianatoargentato de potasio (I)
- En el sistema Ewing-Bassett la carga sobre el complejo se especifica en números arábigos después del nombre complejo. Esto proporciona una manera de especificar un complejo incluso cuando no se conoce el estado de oxidación del metal y, en los casos en que se conoce, el valor del estado de oxidación del metal puede inferirse a partir de la carga del ion complejo.
[COCl (NH 3) 5] Cl 2 = cloruro de pentaminaclorocobalto (2+)
[PtBr 2 (bpy)] = dibromobipiridineplatinio (0)
K [Ag (SCN) 2] = di-S-tiocianatoargentato de potasio (1-)
Resumen de reglas para nombrar complejos de coordinación.
En la Figura se da un resumen gráfico de las reglas para nombrar complejos junto con algunos ejemplos que puede usar para revisar las reglas de nomenclatura \(\sf{\PageIndex{1}}\). Esta obra de Stephen Conakes está bajo una Licencia Creative Commons Atribución 4.0 Internacional.

Al aprender nomenclatura química, la práctica hace la perfección. Se proporcionan los siguientes ejemplos y ejercicios para darte esta práctica. Ejemplos y ejercicios adicionales en el sitio https://chem.libretexts.org/ incluyen un conjunto de ejemplos simples con soluciones explicadas, un conjunto de ejercicios simples con soluciones y un conjunto de ejercicios más desafiantes sin soluciones.
Para nombrar un complejo en el sistema Stock es necesario asignar un estado de oxidación formal al metal. Por esta razón es importante poder asignar el estado de oxidación de un metal en un complejo. Afortunadamente, esto es fácil de hacer si recuerdas
- La suma de todos los estados de oxidación de los átomos será igual a la carga general en el complejo
- Al determinar el estado de oxidación del metal, los ligandos pueden tratarse como teniendo un estado de oxidación igual a su carga, es decir, la carga que poseen en la forma en que coordinan el metal, por lo que si necesitan perder un protón para unirse, no olvide dar cuenta de eso.
Dado lo anterior, asignar el estado de oxidación del metal en los siguientes complejos reales e hipotéticos.
- K 3 [Fe (CN) 6]
- [COCl (NH 3) 5] (NO 3) 2
- K 2 [PtcL 4]
- [MnCl (por)]
- [Ru (bpy) 3] Cl 2
- [PdCl 2 (dppe)]
- [Mn (es) 2 (SCN) 2]
- Respuesta para K 3 [Fe (CN) 6] 3-.
-
Este contiene [Fe (CN) 6] 3-; así O.S. Fe + 6 x (-1) (para CN -) = -3 (la carga del complejo) así que O.S. Fe = +3 o Fe 3 +.
- Respuesta para [CoCl (NH 3) 5] (NO 3) 2.
-
Este contiene [CoCl (NH 3) 5] 2+; así O.S. Co + 1 x (-1) (para Cl -) + 0 x 5 (para NH 3) = +2 (la carga del complejo) así que O.S. Co = +3 o Co 3 +.
- Respuesta para K 2 [PtcL 4].
-
Este contiene 2K + y [PtCl 4] 2-; así O.S. Pt + 4 x (-1) (para Cl -) = -2 (la carga del complejo) así que O.S. Pt = +2 o Pt 2 +.
- Respuesta para [MnCl (por)].
-
O.S. Pt + 1 x (-2) (para por; ver tabla 9.2.2) + 1 x (-1) (para Cl -) = +0 (la carga del complejo) así que O.S. Mn = +3 o Mn 3 +.
- Respuesta [Ru (bpy) 3] Cl 2.
-
El complejo es [Ru (bpy) 3] 2+ entonces O.S. Ru + 0 x 3 (para bpy) = +2 (la carga del complejo) así que O.S. Ru = +2 o Ru 2 +.
- Responder [PdCl 2 (dppe)].
-
O.S. Pd + 2 x (-1) (para Cl -) + 0 x 3 (para dppe) = +0 (la carga del complejo) así que O.S. Pd = +2 o Pd 2 +.
- Responder [Mn (en) 2 (SCN) 2].
-
O.S. Mn + (2 x 0) (para en) + 2 x (-1) (para SCN -) = +0 (la carga del complejo) así que O.S. Mn = +2 o Mn 2 +.
Nombrar los siguientes compuestos en los sistemas Stock y Ewing-Bassett:
- [Ru (NH 3) 6] (NO 3) 3
- K 2 [PtcL 4]
- K [Ag (CN) 2]
- Cs [CubrCl 2 F]
- [Cu (acac) 2]
- Contestar
-
Complejo Nombre del sistema de existencias Nombre del sistema Ewing-Bassett a [Ru (NH 3) 6] (NO 3) 3 Nitrato de hexamminerutenio (III) Nitrato de hexamminerutenio (3+) b K 2 [PtcL 4] tetracloroplatinato de potasio (II) tetracloroplatinato de potasio (2-) c K [Ag (CN) 2] dicianoargentato de potasio (I) dicianoargentato de potasio (1-) d Cs 2 [CubrCl 2 F] bromodiclorofluorocuprato de cesio (II) bromodiclorofluorocuprato de cesio (2-) e [Cu (acac) 2] bis (acetilacetonato) cobre (II) bis (acetilacetonato) cobre (0)
Nombrar los siguientes compuestos e iones tanto en los sistemas Stock como Ewing-Bassett.
- Cu (OH) 4 -
- [AuXe 4] 2+
- AUCl 4 -
- Fe (CN) 6 3-
- K 4 [Fe (CN) 6]
- trans- [Cu (en) 2 (NO 2) 2] (el N está unido a Cu)
- cis-IRCl 2 (CO) (PPh 3) (ignorar la estereoquímica)
- IrCl (PPh 3) 3
- Contestar
-
Compuesto Nombre del sistema de existencias Nombre del sistema Ewing-Bassett a Cu (OH) 4 - tetrahidroxidocuprato (III) o tetrahidroxidocuprato (III) tetrahidroxidocuprato (1-) o tetrahidroxidocuprato (1-) b [AuXe 4] 2+ tetraxenonoro (II) tetraxenonoro (2+) c AUCl 4 - tetracloroaurato (III) tetracloroaurato (1-) d Fe (CN) 6 3- hexacyanoferrato (III) o hexacyanidoferrrato (III) hexacianoferrato (3-) o hexacianidoferrato (3-) e K 4 [Fe (CN) 6] hexacianoferrato de potasio (II) o hexacianidoferrrato de potasio (II) hexacianoferrato de potasio (4-) o hexacianidoferrrato de potasio (4-) f trans- [Cu (en) 2 (NO 2) 2] (el N está unido a Cu) bis (etilendiamina) bisnitrocobre (II) o bis (etilendiamina) bis (nitrito-\(\kappa\) N) cobre (II) bis (etilendiamina) bisnitrocobre (0) o bis (etilendiamina) bis (nitrito-\(\kappa\) N) cobre (0) g cis-IrCl 2 (CO) (PPh 3) cis-diclorocarboniltrifenilfosfineiridio (I)
o cis- dicloro (carbonil) (trifenilfosfina) iridio (I)
cis-diclorocarboniltrifenilfosfineiridio (0)
o cis- dicloro (carbonil) (trifenilfosfina) iridio (0)
h IrCl (PPh 3) 3 clorotris (trifenilfosfina) iridio (I) clorotris (trifenilfosfina) iridio (0)
Nombrar los siguientes compuestos e iones tanto en los sistemas Stock como Ewing-Bassett. Ignora los prefijos para designar isómeros si no ha aprendido sobre esos.
- Fe (acac) 3
- K 2 [CuBr 4]
- ReH 9
- [Ag (NH 3) 2] BF 4
- [Ag (NH 3) 2] [Ag (CN) 2]
- [Ni (CN) 4] 2-
- [Co (N 3) (NH 3) 5] SO 4
- [CobrCl (H 2 O) (NH 3)] I (ignorar la estereoquímica)
- Respuestas de muestra
-
Complejo Nombre del sistema de existencias Nombre del sistema Ewing-Bassett a Fe (acac) 3 tris (acetoacetato) hierro (III) tris (acetoacetato) hierro (0) b Na 2 [CuBr 4] tetrabromocuprato de sodio (II) tetrabromocuprato de sodio (2-) c [Co (NH 3) 6] [Co (buey) 3] hexamminecobalt (III) tris (oxalato) cobalto (III) hexamminecobalt (3+) tris (oxalato) cobalto (3-) d [Ag (NH 3) 2] BF 4 tetrafluoroborato de diamminesilver (I) tetrafluoroborato diamminesilver (1+) e [Ag (NH 3) 2] [Ag (CN) 2] diamminesilver (I) dicianoargentino (I)
o diamminesilver (I) dicianidoargentino (I)
diamminesilver (1+) dicianoargentino (1-)
o diamminesilver (1+) dicianidoargentino (1-)
f [Ni (CN) 4] 2- ion tetracyanonickelato (II) o tetracyanonickelato (II) tetracyanonickelato (2-) o tetracyanonickelato (2-) ion g [Co (N 3) (NH 3) 5] SO 4 sulfato de pentamminazidocobalto (III) pentamminazidocobalto (2+) sulfato h [CobrCl (H 2 O) (NH 3)] I
(ignorar la estereoquímica)
yoduro de aminaacuabromoclorocobalto (III) amminaaquabromoclorocobalto (1+) yoduro
Nombrar los siguientes compuestos e iones tanto en los sistemas Stock como Ewing-Bassett. Ignora los prefijos para designar isómeros si no ha aprendido sobre esos.
- trans- [Cu (dppe) 2 (NO 2) 2] (el N está unido a Cu)
- [Pd (en) 2 (SCN) 2], con los tiocianatos unidos a PD-SCN
- [Mn (CO) 6] BpH 4 (BpH 4 = tetrafenilborato)
- Rb [AgF 4]
- K 2 ReH 9
- K 3 CrCl 6
- [Ru (H 2 O) 6] Cl 2
- [cis- Fe (CO) 4 I 2]
- K 2 [trans -Fe (CN) 4 (CO) 2]
- [cis -MnCl (H 2 O) 4 (NH 3)] (NO 3)
- K 3 [fac -RuCl 3 (PMe 3) 3]
- Contestar
-
Complejo Nombre del sistema de existencias Nombre del sistema Ewing-Bassett a trans- [Cu (dppe) 2 (NO 2) 2] trans- bis (difenilfosfinoetano) bisnitrocobre (II) o trans- bis (difenilfosfinoetano) bis (nitrito-\(\kappa\) N) cobre (II) trans- bis (difenilfosfinoetano) bisnitrocobre (0) o trans- bis (difenilfosfino) etanobis (nitrito-\(\kappa\) N) cobre (0) b [Pd (en) 2 (SCN) 2], con los tiocianatos unidos a PD-SCN bis (etilendiamina) bistiocianatopaladio (II)
o bis (etilendiamina) bis (tiocianato- S) paladio (II)
o bis (etilendiamina) bis (tiocianato-\(\kappa\) S) paladio (II)
bis (etilendiamina) bistiocianatopaladio (0)
o bis (etilendiamina) bis (tiocianato- S) paladio (0)
o bis (etilendiamina) bis (tiocianato-\(\kappa\) S) paladio (0)
c [Mn (CO) 6] BpH 4 hexacarbonilborato de tetrafenilmanganeso (I) hexacarbonilborato de tetrafenilmanganeso (1+) d Rb [AgF 4] tetrafluoroargentato de rubidio (III) tetrafluoroargentato de rubidio (1-) e K 2 ReH 9 potasio nonahidridorhenio (VII) potasio nonahidridorhenio (2-) f K 3 CrCl 6 o K 3 [CrCl 6] hexaclorocrocromo potásico (III) o
hexacloridocromo de potasio (III)
hexaclorocrocromo de potasio (3-) o
hexacloridocromo de potasio (3-)
g [Ru (H 2 O) 6] Cl 2 cloruro de hexaaquarutenio (II) cloruro de hexaaquarutenio (2+) h [cis- Fe (CO) 4 I 2] cis-tetracarbonildiyodohierro (II) cis-tetracarbonildiyodohierro (0) i K 2 [trans -Fe (CN) 4 (CO) 2] trans-dicarboniltetracianoferrato de potasio (II) trans dicarboniltetracianoferrato de potasio (2-) j [cis -MnCl (H 2 O) 4 (NH 3)] (NO 3) cis-aminatetraaquacloromanganeso (0) nitrato cis-aminatetraaquacloromanganeso (1+) nitrato k K [fac -RuCl 3 (PMe 3) 3] potasio fac -triclorotris (trifenilfosfina) rutenio (II) potasio fac -triclorotris (trifenilfosfina) rutenio (1-)
Nombra los compuestos e iones a continuación usando los sistemas Stock y Ewing-Bassett. Ignora los prefijos para designar isómeros si no ha aprendido sobre esos.
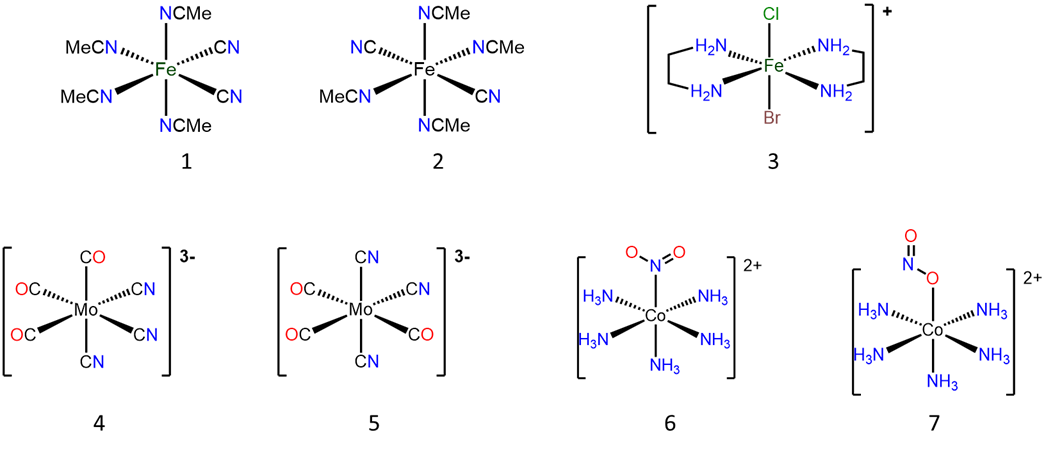
- Contestar
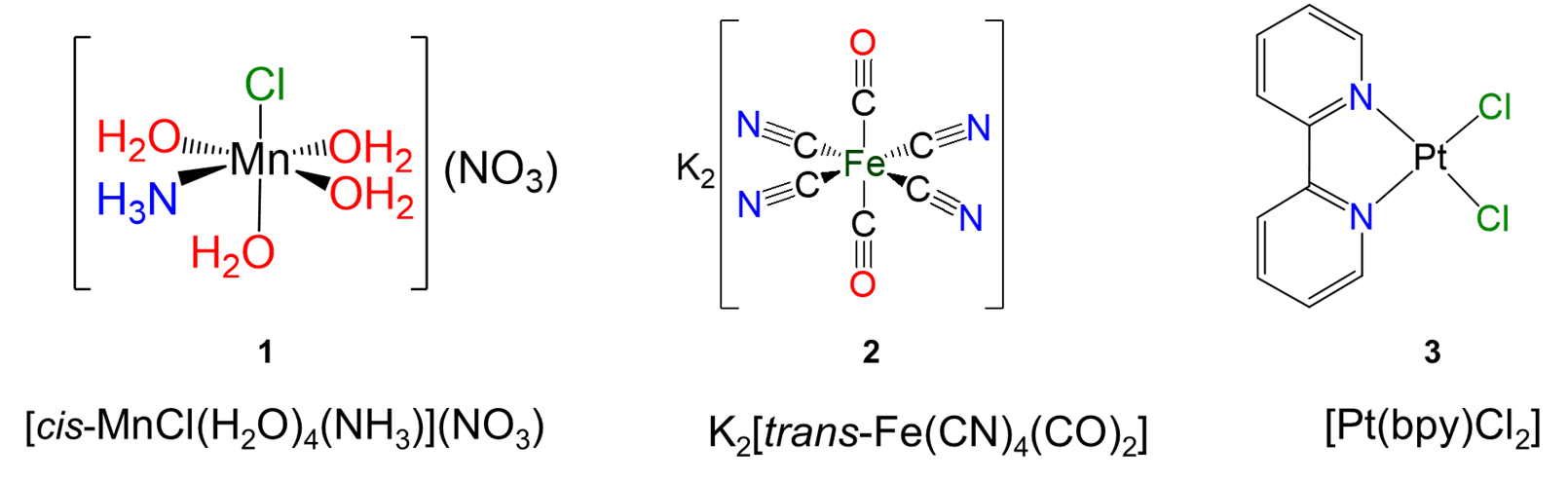
-
# Estructura Nombre del sistema de existencias Nombre del sistema Ewing-Bassett 1 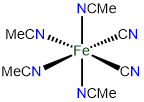
cis-tetraacetonitrilodicianohierro (II)
o cis-tetraacetonitrilodicianidohierro (II)
cis-tetraacetonitrilodicianohierro (0)
o cis-tetraacetonitrilodicianidohierro (0)
2 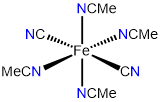
trans-tetraacetonitrilodicianohierro (II)
o trans-tetraacetonitrilodicianidohierro (II)
trans-tetraacetonitrilodicianohierro (0)
o trans-tetraacetonitrilodicianidohierro (0)
3 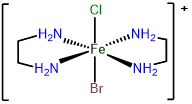
trans-bromoclorobis (etilendiamina) hierro (III)
o trans-bromidocloridobis (etilendiamina) hierro (III)
trans-bromoclorobis (etilendiamina) hierro (1+)
o trans-bromidocloridobis (etilendiamina) hierro (1+)
4 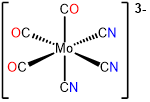
fac -tricarboniltricianomolibdato (0)
o fac -tricarboniltricianidomolibdato (0)
fac -tricarboniltricianomolibdato (3-)
o fac -tricarboniltricianidomolibdato (3-)
5 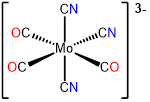
mer -tricarboniltricianomolibdato (0)
o mer -tricarboniltricianidomolibdato (0)
mer -tricarboniltricianomolibdato (3-)
o mer -tricarboniltricianidomolibdato (3-)
6 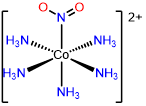
pentamminenitrito- N - cobalto (III),
pentamminenitrito-\(\kappa\) N - cobalto (III),
o pentamminenitrocobalto (III)
pentamminenitrito- N -cobalto (2+),
pentamminenitrito-\(\kappa\) N -cobalto (2+),
o pentamminenitrocobalto (2+)
7 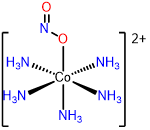
pentamminenitrito- O -cobalto (2+),
pentamminenitrito-\(\kappa\) O -cobalto (2+),
o pentamminenitritocobalt (2+)
pentamminenitrito- O -cobalto (2+),
pentamminenitrito-\(\kappa\) O -cobalto (2+),
o pentamminenitritocobalt (2+)
Dibujar fórmulas estructurales para los siguientes compuestos e iones. Usted puede asumir que
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tenga un número de coordinación de cuatro serán tetraédricos
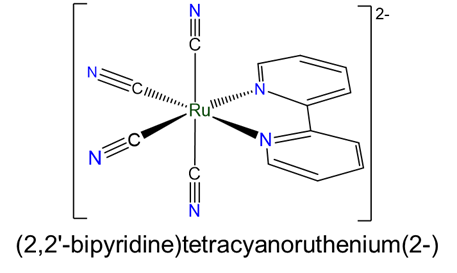
- (2,2'-bipiridina) tetracyanorutenio (2-)
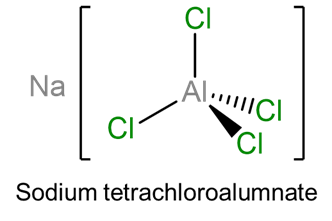
- tetracloroaluminato de sodio (tenga en cuenta que dado que el Al es un metal del grupo principal con un estado de oxidación generalmente fijo no se da ningún estado de oxidación)
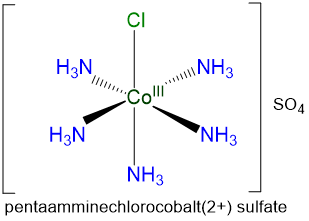
- pentaaminaclorocobalto (2+) sulfato
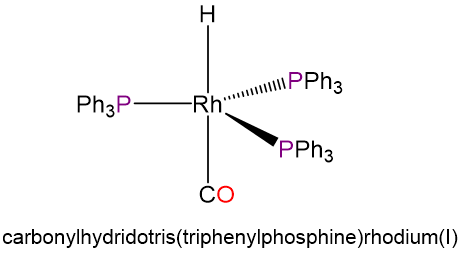
- carbonilhidridotris (trifenilfosfina) rodio (I) (los ligandos en este complejo ocupan posiciones estéricamente preferidas)
- bromotriclorocobaltato (III)
- hexaaquacopper (2+) sulfato
- sodio tris (oxalato) cobalto (III)
- fac - (1,10-fenantrolina) tricarbonilclororrenio (I)
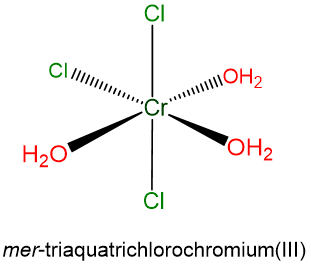
- mer- triaquatriclorocromo (III)
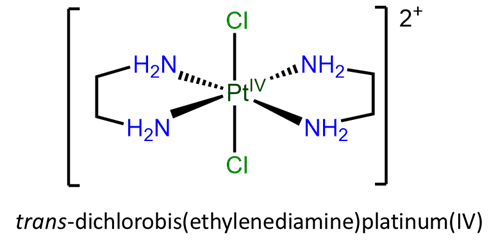
- trans-diclorobis (etilendiamina) platino (IV)
- RESPUESTAS
- a
-
- b
-
- c
-
- d
-
- e
-
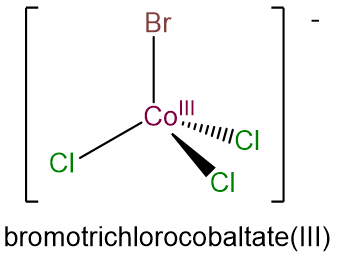
- f
-
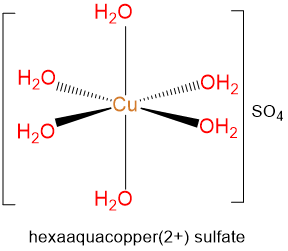
- g
-
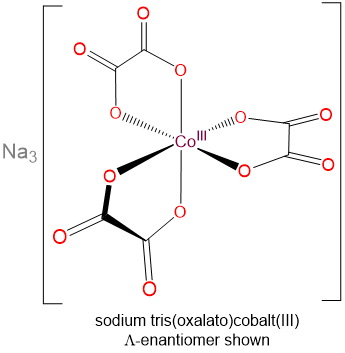
- h
-
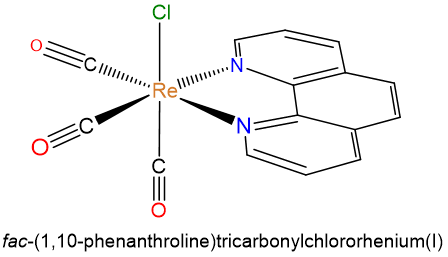
- i
-
- j
-
El nombre de la estructura denominada tris (\(\mu\)tetraamina-dihidroxocobalto) cobalto (6+) en el Esquema\(\sf{\PageIndex{III}}\) (reproducida a continuación) es incompleto. Dar el nombre completo de la estructura tanto en los sistemas Stock como Ewing-Basset.
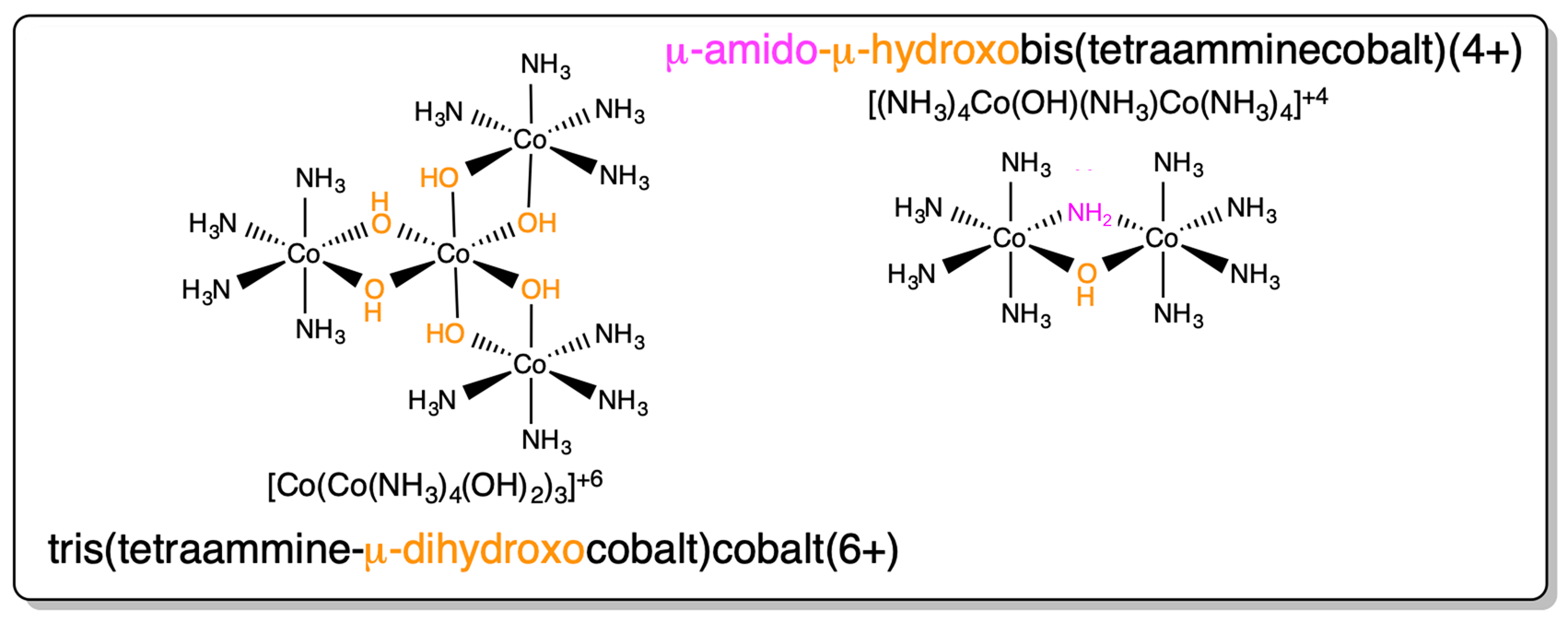
- Contestar
-
\(\Delta\)-tris (\(\mu\)tetraamina-dihidroxocobalto) cobalto (6+) o\(\Delta\) -tris (\(\mu\)tetraamina-dihidroxocobalto (III) cobalto (III) cobalto (III)
Reglas para redactar las fórmulas de los compuestos de coordinación
Las reglas para escribir las fórmulas de los compuestos de coordinación siguen la misma convención utilizada para especificar sus nombres. No obstante, de acuerdo con un mito que ha sido ampliamente propagado en sitios web educativos, no es necesario enumerar el cargo. Como las fórmulas predecibles organizadas pueden ser más fáciles de leer y entender que las escritas al azar, las reglas para escribir las fórmulas de los compuestos de coordinación tienen valor. Para apoyar a quienes deseen emplearlos se les da en esta sección. Las reglas que se dan aquí están adaptadas de un resumen de Robert Lancashire.
- Si hay múltiples iones presentes, enumere los cationes antes que los aniones.
- Encerrar todos los constituyentes de cada ion complejo entre corchetes.
- Para cada ion complejo,
- Dé primero el átomo metálico central.
- Luego ligandos a continuación, enumerados en orden alfabético, ignorando los prefijos de acuerdo a las primeras letras en el símbolo del ligando tal como están escritas. Esto es cierto independientemente de si el símbolo es un símbolo de elemento (como C, N, O, etc.) o un símbolo para el nombre del ligando (bpy, en, MeCN, etc.). Contrario a los mitos ampliamente circulados, la carga del ligando no importa. 4
- Las fórmulas o abreviaturas (por ejemplo, en) para todos los ligandos poliatómicos deben estar encerradas entre paréntesis ordinarios.
- Según corresponda, utilice símbolos atómicos en cursiva para indicar isomerismo de enlace y prefijos como cis -, trans-, fac -, mer -,\(\Lambda\)\(\Delta\) -, κ n, η n, μ n,\(\lambda\) -, -, o \(\delta\)- para indicar estereoquímica.
- Cuando un ligando se une a un metal a través de un átomo particular, preferiblemente coloque ese átomo más cercano al metal, por ejemplo, [Fe (CN) 6] 3- no [Fe (NC) 6] 3- (Nota: esta regla se usa principalmente para ligandos ambidentados; aunque la IUPAC recomienda que el agua los ligandos se escriban como OH 2 cuando el O estaría más cerca de su metal coordinado, todavía suelen escribirse como H 2 O).
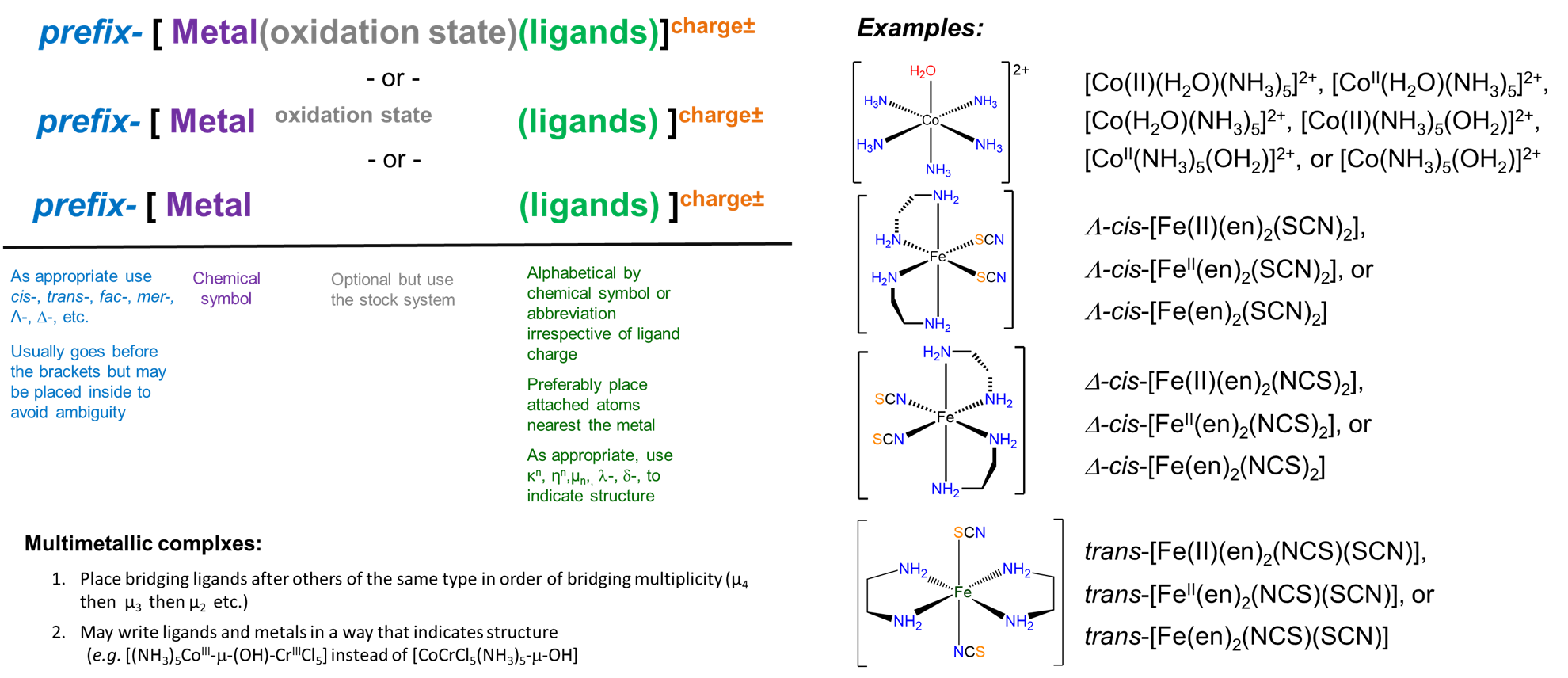
Estas reglas se resumen gráficamente en la Figura\(\sf{\PageIndex{2}}\).
Dar las fórmulas de los siguientes complejos.
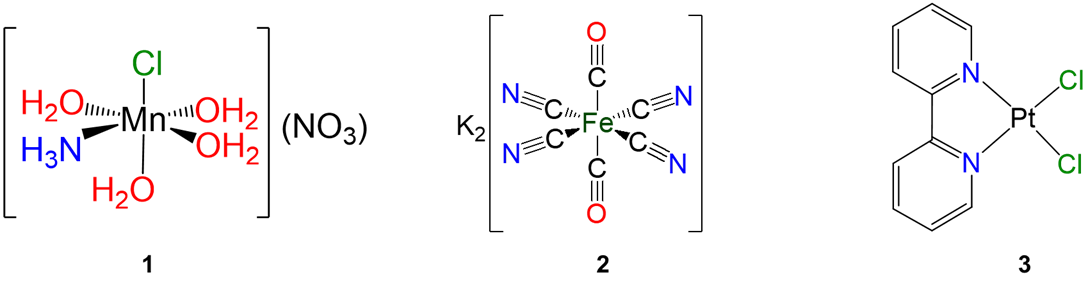
.
- Contestar
-
Escriba fórmulas para cada uno de los siguientes compuestos e iones. Cuando están presentes ligandos multidentados, usa abreviaturas adecuadas.
- pentaaminaclorocobalto (2+) sulfato
- \(\Delta\)-diamminebis (oxalato) manganato (III)
- trans-tetraacetonitrilodicianohierro (II)
- tricarbonildiclorobis (trifenilfosfina) molibdeno
- RESPUESTAS
- a.
-
[COCl (NH 3) 5] (SO 4)
- b.
-
\(\Delta\)- [Mn (NH 3) 2 (buey) 2] -
- c.
-
trans - [Fe (CN) 2 (NCMe) 4]
- d.
-
[MoCl 2 (CO) 3 (PPh 3)] o MoCl 2 (CO) 3 (PPh 3)
- e.
-
mer - [CrBrCl (H 2 O) 3 I]
- f.
-
[Co (O 2) py (salen)]
- g.
-
[Fe (NO) 2 (Set) 2] -
- h.
-
[MnCl (por)] - o [MnCl (porfirina)] -
- i.
-
[Ni (DMG) 2] o [Ni (Hdmg) 2]
- j.
-
potasio trans - [Fe (CN) 2 (CO) 4]
- k.
-
trans - [CuCl (H 2 O) 4 (NH 3)] SO 4
- l.
-
trans - [PtcL 2 (es) 2] 2+
- m.
-
cis - [CobrCl (NH 3) 4] SO 4
- n.
-
K 2 [Fe (CN) 5 NO]
Complejos de coordinación multinuclear
Los complejos de coordinación multinuclear contienen múltiples metales conectados por uno o más ligandos puente. Las estructuras de los complejos puente generalmente se pueden inferir a partir\(\mu\) de sus ligandos etiquetados en sus nombres y fórmulas. Para beneficio de los instructores que deseen que sus alumnos nombren complejos multinucleares, a continuación se presentan las reglas.
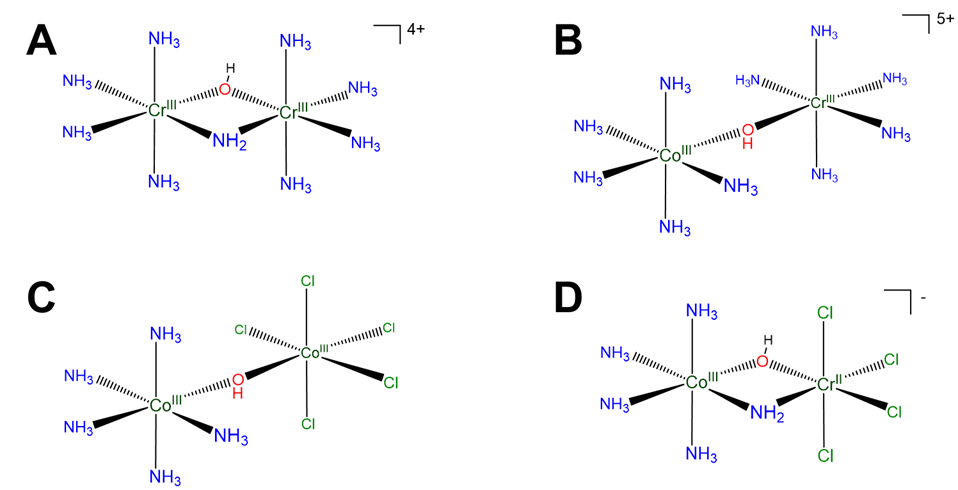
Los complejos multinucleares se nombran de manera diferente dependiendo de si los grupos a ambos lados de los ligandos puente son idénticos o diferentes, como se muestra en el Esquema\(\sf{\PageIndex{VIII}}\).
Esquema\(\sf{\PageIndex{VIII}}\). Los complejos de coordinación multinucleares pueden denominarse de manera diferente dependiendo de si los grupos a ambos lados de los ligandos puente son iguales o diferentes. Los grupos son los mismos si el metal, los ligandos y la disposición de los ligandos son idénticos. Esto es cierto en A pero en B los metales difieren, en C los ligandos difieren, y en D difieren tanto el metal como los ligandos.
Nombramiento de complejos multinucleares
Veamos las reglas para nombrar complejos multinucleares simétricos y asimétricos.
Aplicación del sistema IUPAC y variantes del mismo a complejos simétricos
El sistema de nomenclatura de la IUPAC evita útilmente el tipo de ambigüedades y elecciones ad hoc involucradas en la mayoría de los sistemas de nomenclatura a nivel de libro de texto para complejos multimetálicos. Desafortunadamente, es correspondientemente difícil de emplear para los principiantes. De esta manera, sólo se aplicará en profundidad al caso de complejos simétricos. Los complejos simétricos son particularmente fáciles de nombrar en el sistema IUPAC y en varias de sus variantes que encuentran uso común. En estos
- Los ligandos se dan en orden alfabético. Cuando hay ligandos puente y no puente del mismo tipo, los ligandos de puente se dan primero. Cuando hay múltiples ligandos de puente del mismo tipo pero que usan diferentes modos de puente (por ejemplo,\(\mu\) 4 -,\(\mu\) 3 -,\(\mu\) 2 -), los ligandos de puente se especifican en orden decreciente de multiplicidad de puente, p. \(\mu\)3 -sulfido-di-\(\mu\) -sulfido.
- Los grupos puenteados se dan posteriormente utilizando nombres que siguen las reglas ordinarias. Generalmente esto implica
- nombrar todos los ligandos seguidos de todos los metales, en ambos casos usando prefijos para indicar el número de cada uno, o
- nombrar cada grupo de átomos individualmente como en el sistema de nomenclatura menos formal, usando prefijos para indicar el número de ligandos (esta es una variante no oficial del sistema IUPAC que algunos autores de libros de texto parecen preferir).
Estas dos reglas son suficientes para describir complejos simples de puente simétrico.
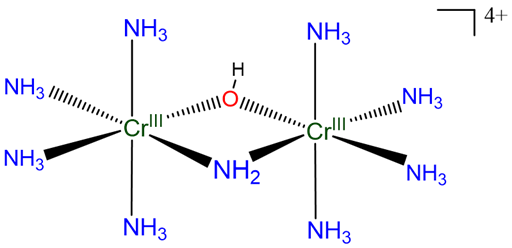
Ejemplo: El compuesto en el Esquema\(\sf{\PageIndex{VIIIA}}\)
puede ser nombrado
[\(\mu\)-amido-\(\mu\) -hidroxo-octaamminedicromo (4+)] ion
o
[\(\mu\)-amido-\(\mu\) -hidroxo-bis (tetraaminocromo (III))] ion
o
[\(\mu\)-amido-\(\mu\) -hidroxo-bis (tetraaminocromo) (4+)] ion
Ejemplo: El complejo 5
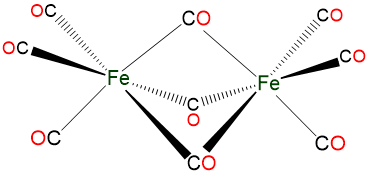
puede denominarse [tri-\(\mu\) carbonil-bis (tricarbonilron) (0)], [tri-\(\mu\) carbonil-bis (tricarbonilron (0))], o [tri-\(\mu\) carbonil-hexacarbonildihierro) (0)]
Ejemplo: El complejo
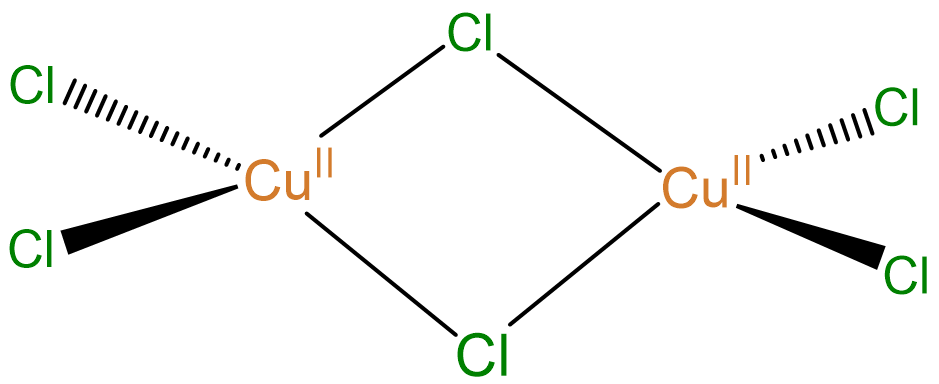
puede denominarse di-\(\mu\) cloruro-tetracloridodicobre (II), di-\(\mu\) cloruro-bis (diclorocobre (II)) o di-\(\mu\) cloruro-bis (diclorocobre) (0)
Nota sobre la aplicación del sistema IUPAC y variantes del mismo a complejos asimétricos
Para un complejo simétrico como el [Cu 2\(\mu\) Cl 4 (-Cl) 2] considerado anteriormente es suficiente especificar la existencia de los dos ligandos puente y cuatro ligandos cloro terminales; no hay necesidad de numerar los ligandos de cloro o especificar exactamente cuáles están involucrados en puente o para aclarar que el puente implica\(\kappa\) 2 coordinaciones de los ligandos de cloro. En los casos en que los dos centros metálicos o los ligandos de cloro difieran es necesario especificar los ligandos y metales exactos involucrados y cómo están conectados.
Por ejemplo, un nombre más extenso de la IUPAC para [Cu 2 Cl 4 (\(\mu\)-Cl) 2] en el que los ligandos de cloro se especifican de manera individual y más completa sería di-\(\mu\) 2 -clorido-tetracloruro-1\(\kappa\) 2 Cl,2\(\kappa\) 2 Cl- dicobre (II).
Sistemas aún más extensos implicarían numerar los metales y especificar cómo están conectados entre sí también. Los detalles de cómo se hace esto suelen estar más allá del nivel de la mayoría de los cursos de pregrado y posgrado en química inorgánica. Quienes quieran conocer los detalles deben consultar el libro rojo. En muchos casos es suficiente reservar el uso de nombres formales de la IUPAC para su uso en publicaciones y emplear un conveniente sistema de nomenclatura abreviada para el uso diario. A continuación se da un ejemplo de un tipo de sistema que a veces se emplea.
Métodos no oficiales pero de uso común aplicables a complejos en los que los grupos puenteados son idénticos o diferentes.
Puede ser bastante complicado usar el sistema IUPAC para nombrar complejos de coordinación multinuclear asimétricos. Afortunadamente rara vez es necesario y hay una variedad de métodos más simples algo ad hoc que funcionan bien para tales casos. Dado que estos métodos son comúnmente utilizados por libros de texto e instructores inorgánicos, es probable que valga la pena aprender sobre sus características generales. En estos métodos
- Un complejo multinuclear se denomina como derivado de uno de los centros metálicos y los otros centros metálicos y sus ligandos se tratan como ligandos para el centro metálico priorizado.
- Desafortunadamente, la mayoría de las veces la elección de qué metales forman parte de los ligandos y cuál es el centro se hace al azar. En otras palabras, no existe un sistema acordado para asignar qué centro metálico es el metal central y cuál debe considerarse como parte de los ligandos que lo rodean. Una manera de ser más sistemática sobre la selección de los metales centrales e incrustados en ligando es asignar el metal central como el metal de mayor prioridad en las reglas de prioridad de la IUPAC. En las reglas de prioridad de la IUPAC, el metal central es el metal de mayor prioridad alfabéticamente por su nombre; entonces, si hay un empate, los ligandos en cada centro de metal atado se clasifican alfabéticamente y gana el centro de metal atado con los ligandos de mayor prioridad (o mayor prioridad).
- Los centros metálicos no elegidos como el centro metálico primario y todos los ligandos alrededor de ellos, incluidos los que se unen al centro metálico ganador, se tratan luego como un solo ligando que coordina el centro metálico ganador.
- Al nombrar los ligandos y el complejo general, nuevamente hay mucho que es fortuito. Sin embargo, en los mejores sistemas cada esfera de coordinación se nombra usando las mismas reglas que para los complejos mononucleares, es decir, los ligandos se dan en orden alfabético, etc.
- Esto es cierto para cualquier ligandoque contenga centro metálico.
- Cuando hay un ligando puente y no puente del mismo tipo, los ligandos puente se dan primero. Cuando hay múltiples ligandos de puente del mismo tipo pero que usan diferentes modos de puente (por ejemplo,\(\mu\) 4 -,\(\mu\) 3 -,\(\mu\) 2 -), los ligandos se especifican en orden decreciente de multiplicidad de puente, p.\(\mu\) 3 -sulfido-di-\(\mu\) -sulfido.
Apliquemos estas reglas a los ejemplos en Scheme\(\sf{\PageIndex{VIII}}\).
Compuesto A:
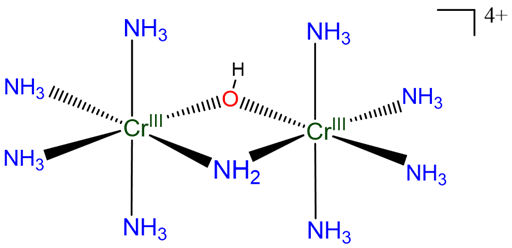
Usando hidroxo para el OH -, puede ser nombrado
[(\(\mu\)-amido-tetraamina-\(\mu\) -hidroxocromo (III)) tetraaminocromo (III)] ion
o
[(\(\mu\)-amido-tetraamina-\(\mu\) -hidroxocromo) cromo (4+)] ion
Compuesto B:
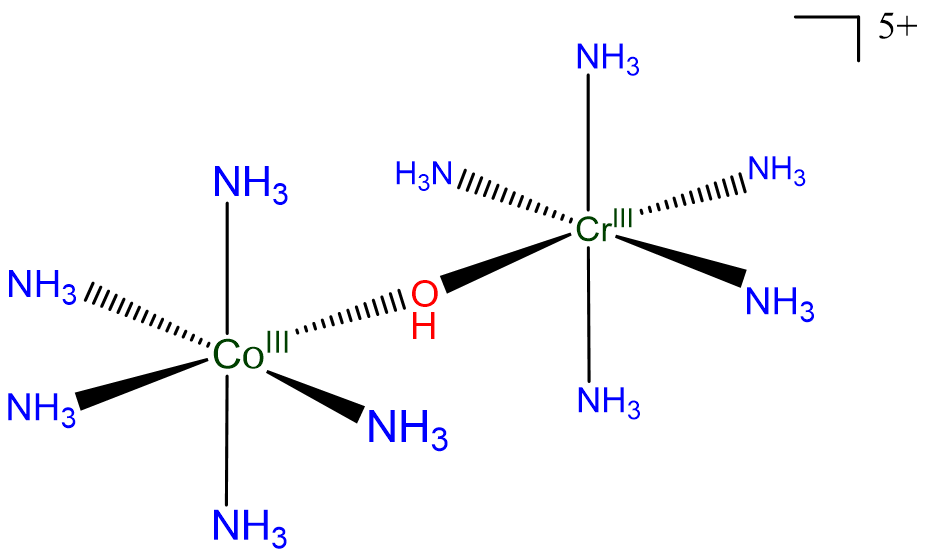
Usando hidroxo para el OH -, puede ser nombrado
[(\(\mu\)pentaamina-hidroxocobalto (III)) tetraaminocromo (III)] ion
o
[(\(\mu\)pentaammina-hidroxocobalto) tetraaminocromo (5+)] ion
Compuesto C:
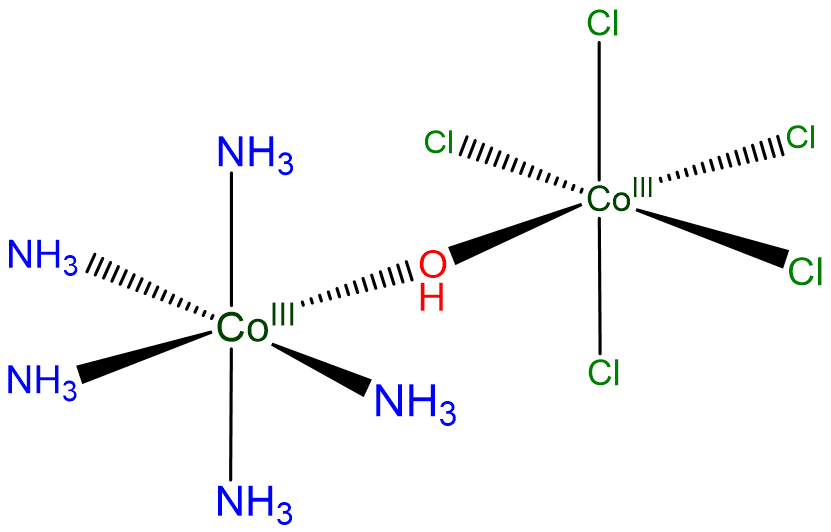
Usando hidroxo para OH -, puede ser nombrado
[pentaamina (\(\mu\)pentacloro-hidroxocobalto (III)) cobalto (III)]
o
[pentaamina (\(\mu\)pentacloro-hidroxocobalto) cobalto] (0)]
Compuesto D:
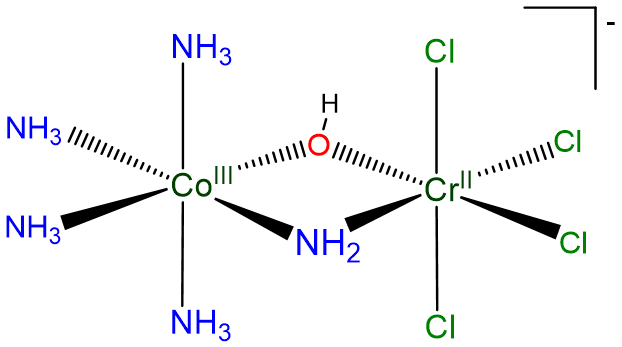
Usando hidroxo para OH - y cloro para Cl -, puede ser nombrado
[pentaamina (\(\mu\)pentacloro-hidroxocobalto (III)) cromato (III)] ion
o
[(\(\mu\)\(\mu\)tetrammina-amina-hidroxocobalto) tetraclorocromato] (1-)] ion
Como puede verse a partir de los ejemplos anteriores, este sistema da nombres útiles para complejos multimetálicos pero esos nombres no son los nombres de la IUPAC y por lo tanto no deben usarse para describir complejos fuera de entornos pedagógicos e informales.
Redacción e interpretación de fórmulas para complejos multinucleares
Las reglas para escribir fórmulas para complejos multinucleares son las mismas que para los mononucleares con dos detalles agregados:
- Escribir ligandos puente después de ligandos no puenteantes del mismo tipo. Por ejemplo, Cu 2 Cl 6 debe escribirse como [Cu 2 Cl 4 - (\(\mu\)-Cl) 2]
- Sin embargo, puede ignorar esa y otras reglas si le resulta útil mantener juntos grupos de metales y ligandos de una manera que transmita mejor cómo están conectados los átomos. Así como la estructura del etano puede transportarse más claramente como H 3 CCH 3 en lugar de CH 3 CH 3, el complejo [Cu 2 Cl 4 (\(\mu\)-Cl) 2] puede escribirse como [(Cl 2 Cu) (\(\mu\)-Cl) 2 (CuCl 2)].
Otros ejemplos:
Para escritura dicromato, [Cr 2 O 6 (\(\mu\)-O)] 2- o [O 5 Cr-\(\mu\) -O-CRO 5] 2-
Para el compuesto C del Esquema\(\sf{\PageIndex{VIII}}\).

escribir [Co 2 Cl 5 (NH 3) 5 (\(\mu\)-OH)] o, mejor aún, [(H 3 N) 5 Co (\(\mu\)-OH) CoCl 5].
Escriba fórmulas razonables para los complejos A, B y D en el Esquema\(\sf{\PageIndex{VIII}}\), que por conveniencia se reproduce a continuación.

- Ejemplos de respuestas para A
-
[Cr 2 (NH 3) 8 -\(\mu\) (NH 2) -\(\mu\) (OH)] 4+ o [(H 3 N) 4 Cr III -\(\mu\) (NH 2) -\(\mu\) (OH) -Cr II (NH 3) 4] y variantes de los mismos que implican escribiendo el H 3 N como NH 3,\(\mu\) as\(\mu_2\), etc.
- Respuestas de muestra para B
-
[CoCr (NH 3) 10 -\(\mu\) (OH)] 5+ o, mejor, [(H 3 N) 5 Co III -\(\mu\) (OH) -Cr III (NH 3) 5] 5+
- Respuestas de muestra para C
-
Esto ya se hizo como ejemplo anterior, [Co 2 Cl 5 (NH 3) 5 -\(\mu\) (OH)] o, mejor, [(NH 3) 5 Co III -\(\mu\) (OH) -Co III Cl 5] y variantes del mismo
- Respuestas de muestra para D
-
[CoCrCl 4 (NH 3) 4 -\(\mu\) (NH 2) -\(\mu\) (OH)] o, mejor, [(H 3 N) 4 Co III -\(\mu\) (NH 2) -\(\mu\) (OH) -Cr II Cl 4]
Referencias
1. Unión Internacional de Química Pura y Aplicada Nomenclatura de Química Inorgánica Cambridge, Reino Unido, 2005.
2. La estructura y el nombre se toma de Choudhury, S. B.; Allan, C. B.; Maroney, M.; Wodward, A. D.; Lucas, C. R. Inorg. Sinteto. 1998, 32, 98-107.
3. Haas, K. Nombramiento de Complejos de Metales de Transición. https://chem.libretexts.org/Courses/Saint_Mary's_College%2C_Notre_Dame%2C_IN/CHEM_342%3A_Bio-inorganic_Chemistry/Readings/Week_2%3A_Introduction_to_Metal-Ligand_Interactions_and_Biomolecules/2.1_Transition_metal_complexes/2.1.6%3A_Naming_Transition_Metal_Complexes
4. Existe un mito ampliamente circulado de que los ligandos aniónicos deben nombrarse antes que los neutros. Este mito es falso. Según el libro rojo de la IUPAC (mina negrienta):
IR-2.15.3.4: Ordenar ligandos en fórmulas y nombres en fórmulas de compuestos de coordinación,
Las fórmulas o abreviaturas que representan los ligandos se citan en orden alfabético como regla general. Los ligandos puente se citan inmediatamente después de los ligandos terminales del mismo tipo, si los hubiera, y en orden creciente de multiplicidad de puente. (Ver también las Secciones IR-9.2.3 e IR-9.2.5.)
IR-9.2.3.1 Secuencia de símbolos dentro de la fórmula de coordinación
(i) El (los) símbolo (s) del átomo central está (n) listado (n) primero.
(ii) Los símbolos de ligando (fórmulas de línea, abreviaturas o siglas) se enumeran entonces en orden alfabético (ver Sección IR-4.4.2.2) .5 Así, CH 3 CN, MeCN y NcMe se ordenarían bajo C, M y N respectivamente, y CO precede a Cl porque los símbolos de una sola letra preceden a dos símbolos de letras. La colocación del ligando en la lista no depende de la carga del ligando.
(iii) Más información es transportada por fórmulas que muestran ligandos con el átomo donante más cercano al átomo central; este procedimiento se recomienda siempre que sea posible, incluso para el agua coordinada.
5. Técnicamente los complejos organometálicos se nombran de acuerdo con reglas ligeramente diferentes, pero el sistema de nomenclatura de compuestos de coordinación funciona aquí. Nótese que alguna vez se pensó que este complejo poseía un enlace Fe-Fe, de acuerdo con las predicciones de la regla de 18 electrones. En consecuencia, fuentes más antiguas suelen dar un [Fe-Fe] después del nombre para reflejar la presencia de ese vínculo. Sin embargo, como ya no se cree que el complejo posea un vínculo Fe-Fe, se omite aquí.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College, a quien deben dirigirse los comentarios, correcciones y críticas.
con algunos ejemplos tomados de Naming Transition Metal Complejos de Kathryn Haas.
De acuerdo con la política para obras de arte originales realizadas como parte de este proyecto, todos los dibujos sin etiquetar de estructuras químicas son de Stephen Conakes y están bajo una Licencia Creative Commons Atribución 4.0 Internacional.