9.4: Isomería
- Page ID
- 81550
Los complejos metálicos presentan una química estructural rica, interesante y diversa. Los principales puntos de variación en la química estructural de los complejos metálicos incluyen
- número de coordinación y geometría de coordinación, que implican diferencias en la cantidad de ligandos que rodean un metal central y su disposición geométrica general. Ejemplos de estos últimos incluyen las geometrías tetraédricas y planas cuadradas comúnmente observadas para centros metálicos de cuatro coordenadas. La coordinación tetraédrica, plana cuadrada y octaédrica sirven como telón de fondo para la discusión sobre la isomería en esta página. Los lectores que no estén familiarizados con estas estructuras podrían considerar leer la sección sobre geometrías de coordinación antes de esta.
- el iosmerismo estructural implica diferencias en la forma en que los átomos potenciales del ligando se unen a los metales en un complejo. Las posibilidades de isomería estructural incluyen
- enlace o isomerismo ambidentado
- isomerismo hidrato/solvato
- isomería de ionización
- isomerismo de coordinación.
De estos, el isomerismo de ligamiento siempre debe considerarse cuando se trabaja con ligandos ambidentados. Como clasificaciones, las tres últimas formas de isomería estructural son principalmente de interés académico ya que representan permutaciones de patrones de estructura ordinarios para solvatos, sales y complejos de coordinación, respectivamente.
- estereoquímica, que incluye
- cuya geometría de coordinación se adopta para un metal con un conjunto dado de ligandos en un estado de oxidación particular. Por ejemplo, [Ni II Cl 4] 2- es tetraédrico mientras que [Pt II Cl 4] 2- es plano cuadrado. Dado que esta geometría suele estar fijada por el metal y los ligandos, normalmente no es una fuente de variedad estereoisomérica.
- estereoisomería centrada en el metal que implica posibles variaciones en dónde se localizan los ligandos entre sí alrededor del metal. Las posibilidades dependen del número de coordinación, geometría y número de diferentes tipos de ligandos. Por ejemplo, los complejos planos cuadrados pueden exhibir isomería cis-/trans, mientras que los tetraédricos no pueden. Los complejos tetraédricos con cuatro ligandos diferentes presentan quiralidad R y S pero los complejos de ese tipo son relativamente raros. Los casos más comunes incluyen isomería cis y trans en complejos planos cuadrados y cis & t rans -, mer & fac -, y\(\Lambda\) &\(\Delta\) isomerismo en los octaédricos, aunque algunos multidentados los ligandos presentan posibilidades adicionales para la variación estereoquímica
- Estereoisomería centrada en los ligandos unidos a un centro metálico. Las posibilidades incluyen
- estereoisomería inherente a un ligando. Esto incluiría casos en los que el propio ligando es quiral o, como en el caso de las aminas, existe como una mezcla de isómeros que se interconvierte rápidamente. Así, este tipo de estereoisomería es una extensión del isomerismo que se encuentra en compuestos orgánicos ordinarios y otros compuestos del grupo principal. Las principales novedades introducidas por la unión de dichos ligandos a un centro metálico implican la creación de nuevas posibilidades de diastereoisomería basadas en la estereoquímica del centro metálico y la congelación de la inversión estereocéntrica al unirse a un metal. Esto último es particularmente importante para las aminas, que como aminas libres racemizan rápidamente por inversión de nitrógeno.
- o isomería conformacional que implica anillos de quelato de cinco miembros creados cuando un ligando multidentado se une a un metal. Este isomerismo a menudo se llama torsión del anillo de quelato ya que los anillos individuales pueden exhibir una de dos conformaciones dependiendo de cómo se tuercen en la unión.
Un resumen de estas formas de isomería se da en la Figura\(\sf{\PageIndex{1}}\).
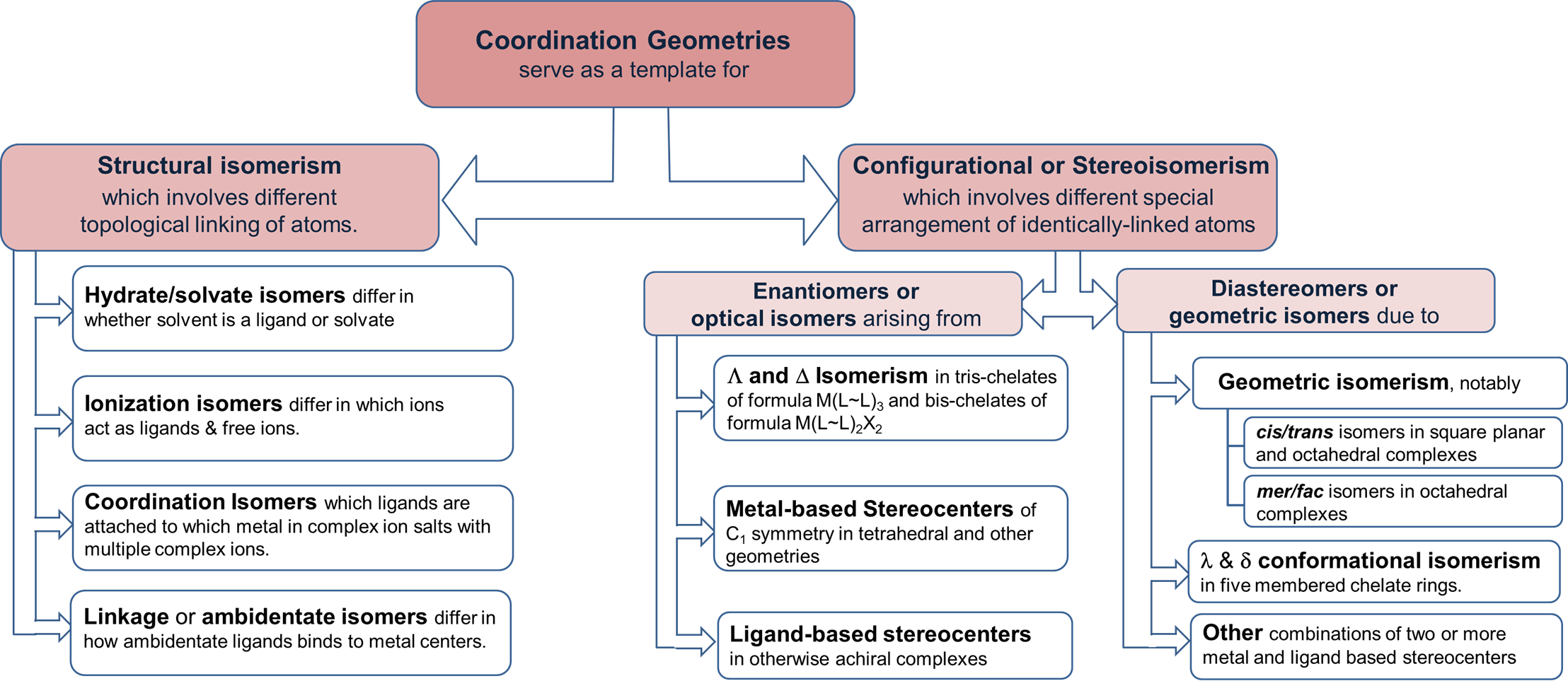
Isómeros estructurales
El isomerismo estructural involucra diferentes enlaces topológicos de átomos. Las diferencias en los enlaces atómicos distintivos de la química de coordinación involucran los enlaces entre metales y ligandos. Las principales variaciones son:
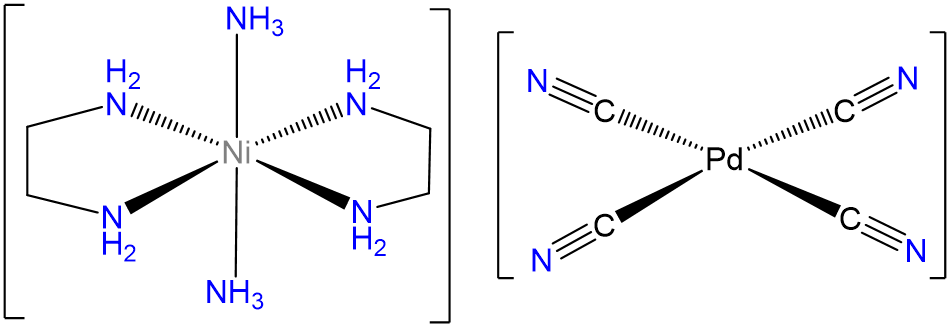
1. Isomería hidrato/solvato
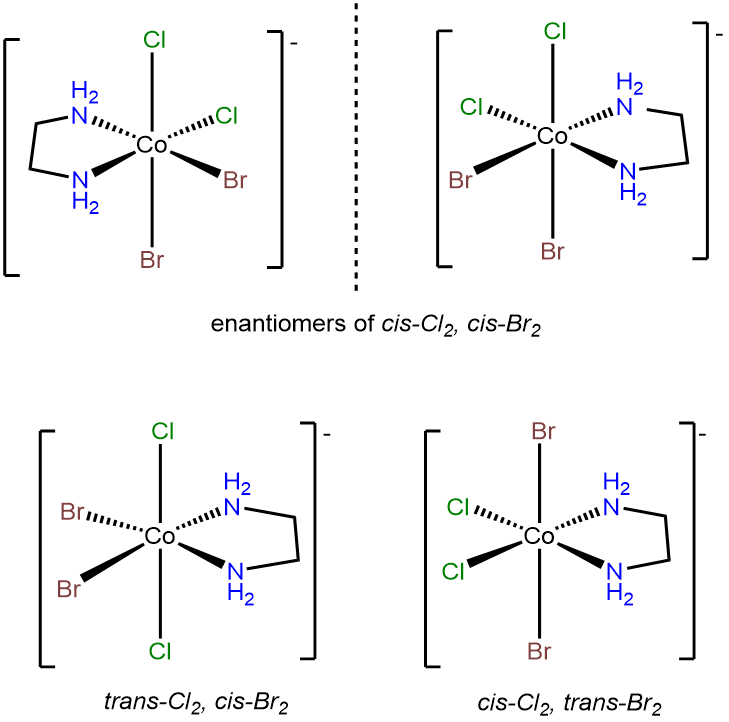
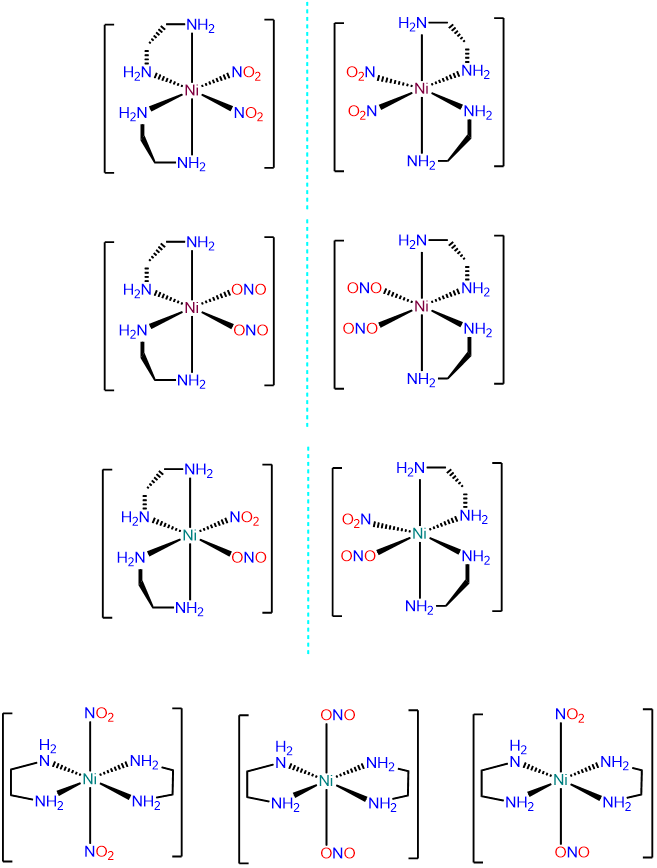
Los isómeros de solvato difieren en términos de si una molécula actúa como ligando o si actúa como un solvato ocupando un sitio reticular en el cristal. Entre los isómeros de solvato, el caso en el que el agua es el ligando o solvato es el más conocido. Los isómeros resultantes se denominan isómeros de hidrato después del término para el agua que actúa como un solvato, hidrato. Un ejemplo bien conocido que ilustra cómo funciona el isomería solvato es la serie [CrCl x (H 2 O) 6-x] Cl 3 - x ·xH 2 O, para la cual x = 0-2. Las estructuras de los iones complejos involucrados en esta serie se muestran en la Figura\(\sf{\PageIndex{2}}\). 1
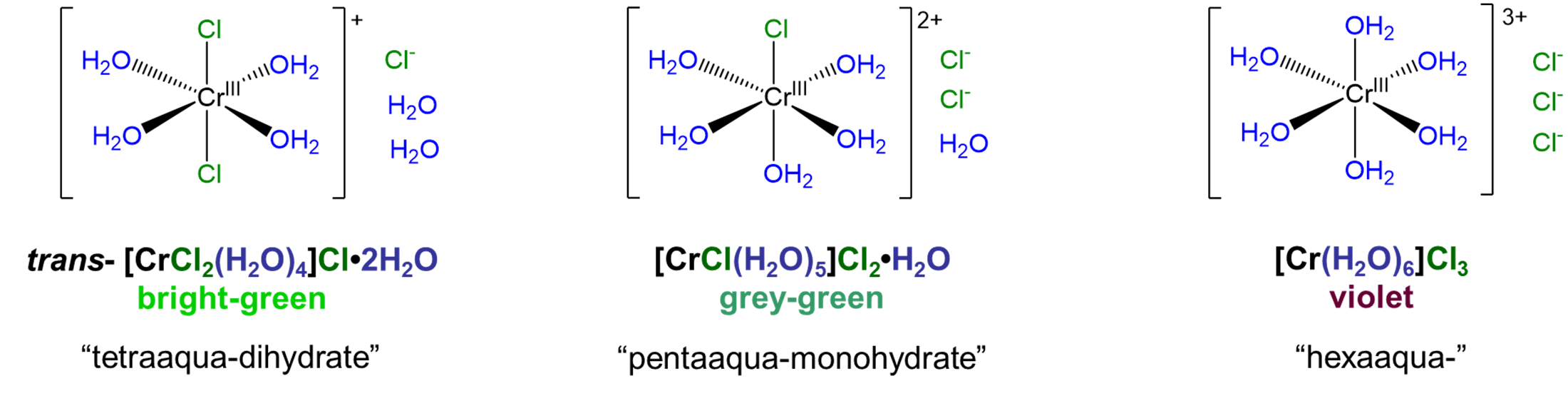
Como puede verse a partir de los compuestos de la Figura\(\sf{\PageIndex{2}}\), los isómeros de hidrato difieren tanto en términos de si el agua actúa como ligando o hidrato como en términos de si un contraión potencial actúa como contraión o ligando. Así, en trans- [CrCl 2 (H 2 O) 4] Cl·2H 2 O dos cloruros actúan como ligandos de cloro y cuatro aguas como ligandos de agua mientras que en [CrCl (H 2 O) 5] Cl 2 ·H 2 O cinco moléculas de agua actúan como ligandos de agua mientras que solo un cloruro actúa como un ligando de cloro. De esta manera, los isómeros de solvato simplemente representan casos en los que dos o más de las posibles permutaciones para la unión de ligandos metálicos entre un conjunto de moléculas de disolvente y contraión son estables.
2. Isomería de ionización
En el isomerismo de ionización hay dos o más iones potenciales que pueden actuar como ligandos. Los isómeros de ionización difieren en términos de cuáles de estos iones actúan como contraiones y que actúan como ligandos. Consideremos, por ejemplo, los complejos mostrados en la Figura\(\sf{\PageIndex{3}}\). Estos complejos difieren en cuanto a si el cloruro o sulfato actúa como ligando, y el otro actúa como contraión.
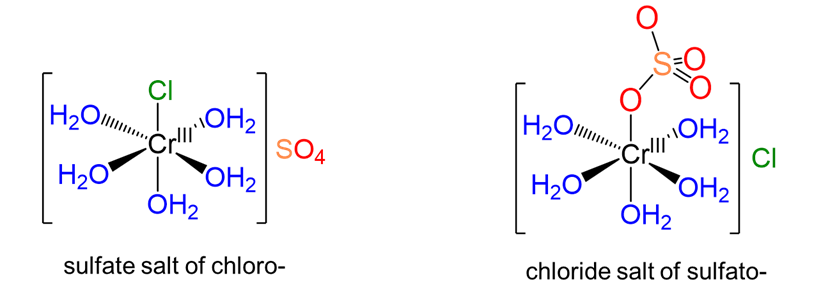
3. Isomería de coordinación
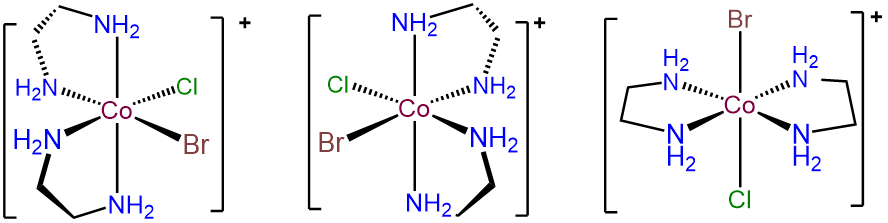
Los isómeros de coordinación existen en compuestos que contienen dos o más complejos, cada uno de los cuales posee un conjunto diferente de ligandos que en principio pueden intercambiarse con un ligando del otro complejo. Un ejemplo involucra [Co III (NH 3) 6] [Cr III (buey) 3], representado en la Figura\(\sf{\PageIndex{4A}}\). 1 Los isómeros de coordinación de este complejo implican el intercambio de ligandos de amina alrededor del centro Co 3 + por ligandos de oxalato que rodean el centro Cr 3 +. Por ejemplo, el intercambio de todos los ligandos de amina y oxalato entre los centros metálicos da el isómero de coordinación [Cr III (NH 3) 6] [Co III (ox) 3] mostrado en la Figura\(\sf{\PageIndex{4B}}\).
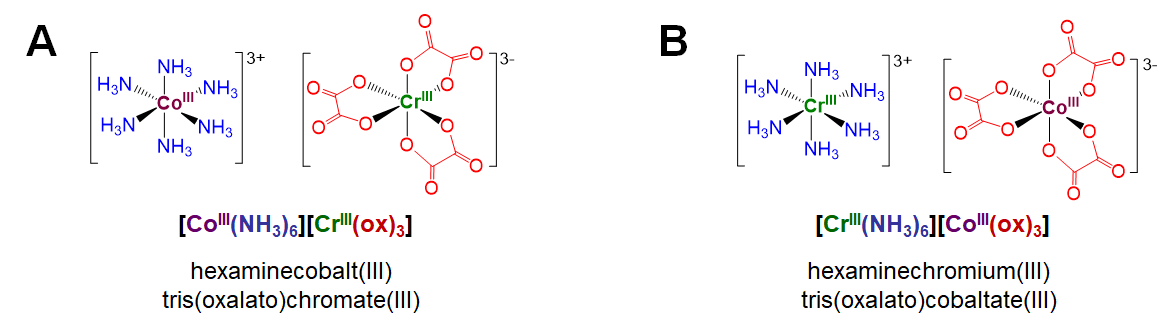
Como clasificaciones, hidrato/solvato, ionización e isomería de coordinación representan permutaciones de patrones de estructura ordinarios para solvatos, sales y complejos de coordinación, respectivamente. Como resultado, estas formas de isomería rara vez se utilizan como marcos conceptuales independientes a la hora de pensar y hablar sobre la estructura de los compuestos de coordinación. No es así el tipo final de isomería estructural, isomerismo de ligamiento. Esto se debe a que el isomerismo de enlace tiene que ver con la capacidad especial de los ligandos ambidentados para unir metales de múltiples maneras.
4. Vinculación o isomerismo ambidentado
Los isómeros de enlace o ambidentados difieren en cómo uno o más ligandos ambidentados se unen a centros metálicos en un complejo. El ejemplo clásico que data de la obra de Jørgensen y Werner se da en Scheme\(\sf{\PageIndex{I}}\).
Así como los alquenos existen como isómeros E y Z, los compuestos que poseen ligandos ambidentados existen como uno de los posibles isómeros de enlace. Como tal, cuando se trabaja con ligandos ambidentados, el isómero de enlace particular formado debe determinarse experimentalmente y considerarse al interpretar el comportamiento químico y físico del complejo.
Los principales ligandos ambidentados que dan lugar al isomerismo de ligamiento son
- cianuro, CN -
- tiocianato, SCN -, y los análogos O y Se, OCN - y SecN -
- nitrito, NO 2 -
- sulfito, SO 3 -
- nitrosil, NO
Aunque los ligandos ambidentados pueden unirse a metales de múltiples maneras, la mayoría exhiben un modo de unión preferido (es decir, prefieren unir centros metálicos de una de las maneras posibles). Por ejemplo, el cianuro casi siempre se une a través de su átomo de carbono y el tiocianato casi siempre se une a través de su nitrógeno (\(\mu\)- N). Sin embargo, el otro modo de unión a veces puede formarse cinéticamente o usando condiciones que favorecen particularmente su formación. Así, el tiocianato forma enlaces M-SCN en presencia de centros metálicos excepcionalmente blandos o en disolventes polares duros (en los que los grupos ácidos de Lewis pueden estabilizar el nitrógeno terminal de un ligando de tiocianato unido).
Los ligandos ambidentados son de gran interés en la investigación porque muchos no solo se unen a centros metálicos de dos maneras; los isómeros de enlace a veces tienen propiedades físicas significativamente diferentes. Además, la posibilidad de dos modos de unión introduce la posibilidad de explotar el isomerismo de ligamiento para aprovechar algunos de estos ligandos:
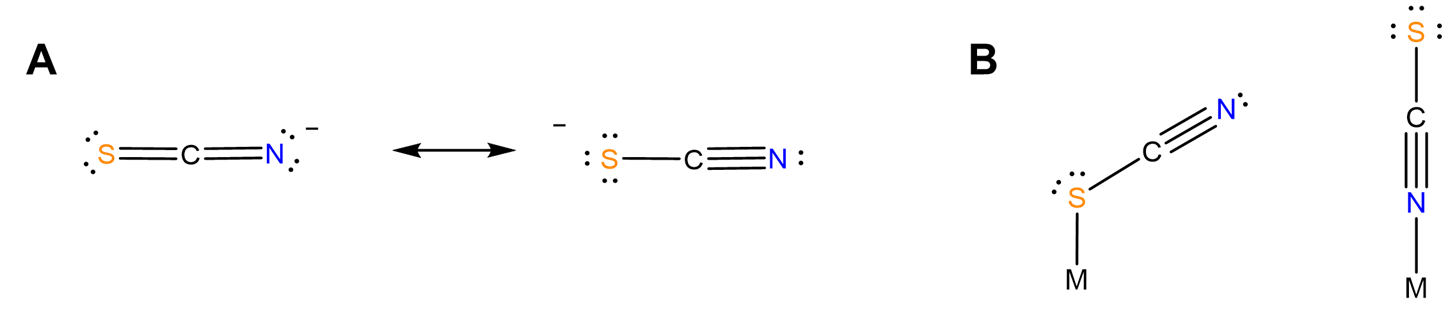
- diferente química estructural en diferentes modos de coordinación. En los complejos mononucleares, el modo de coordinación influye en qué lado del ligando se enfrenta lejos del complejo y podría ser susceptible de estabilización por interacción con el disolvente. Adicionalmente, la orientación del ligando con respecto al centro metálico podría diferir entre un modo de coordinación y otro. Por ejemplo, como se predijo desde el contribuyente menor a su estructura de resonancia, el tiocianato se une de manera no lineal a través de su átomo de S y linealmente a través de su N (Figura\(\sf{\PageIndex{5}}\)). Debido a esto, la aparente masa estérica del ligando alrededor del centro metálico podría diferir entre formas.
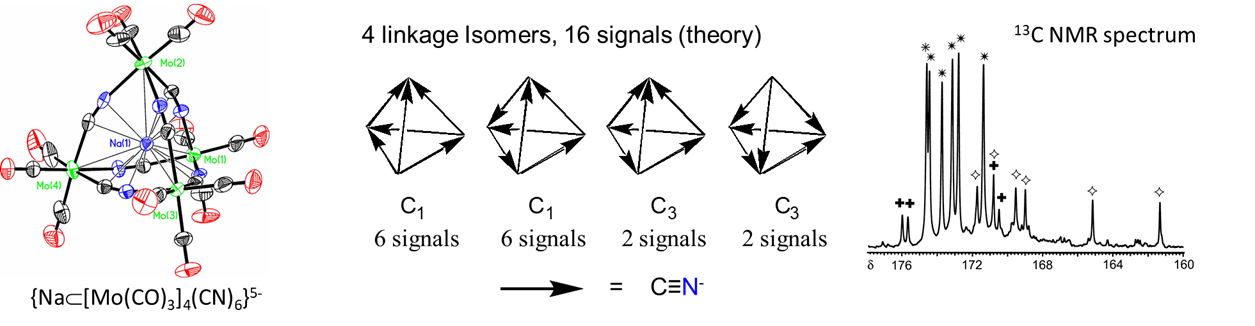
- unir dos centros metálicos diferentes al mismo tiempo, uniéndolos entre sí. Quizás los ejemplos más conocidos involucran tiocianato y cianuro. Este último forma enlaces del tipo M-C=N-M'. En el tinte azul prusiano estos toman la forma Fe II -Cº N-Fe III. Un ejemplo de la investigación de posgrado del autor involucró cúmulos tetraédricos que contenían cuatro átomos metálicos unidos por seis ligandos ciano, como se muestra en la Figura\(\sf{\PageIndex{6}}\).
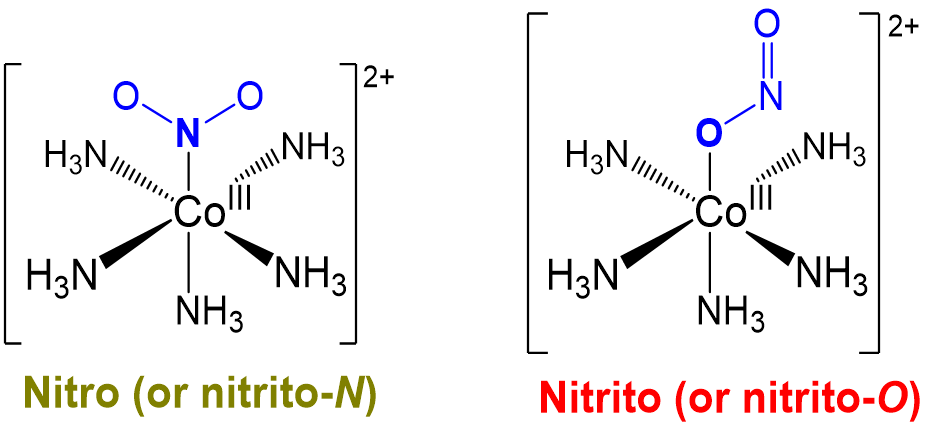
- puede inducirse a cambiar de un modo de unión a otro en respuesta a un estímulo. El ejemplo clásico involucra la transformación por luz del complejo nitro amarillo termodinámicamente más estable de pentaminecobalt (III), [Co (NH 3) 5 NO 2] 2+ al complejo O -nitrito rojo menos estable, [Co (NH 3) 5 ONO] 2+. Redes de coordinación de cianometalatos menos estables como las del rojo K {Fe II [Cr III (CN) 6]} se transforman en la forma K {Fe II [Cr III (NC) 6]} verde más estable al calentarse, como se muestra en la Figura\(\sf{\PageIndex{7}}\). 3
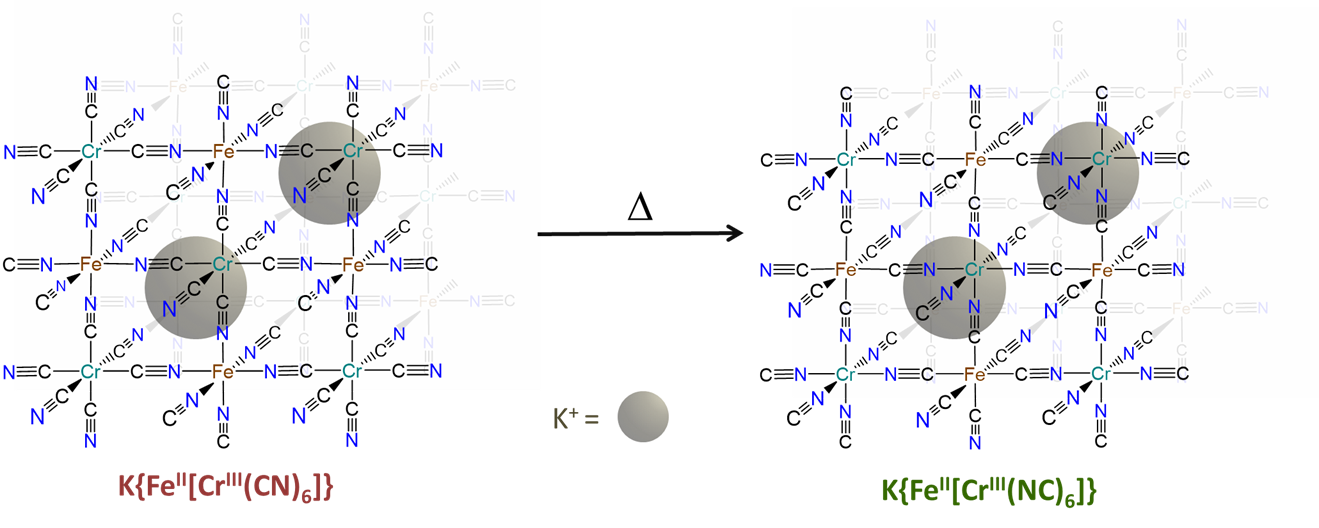
El principio ácido-base blando duro ayuda a explicar la preferencia de unir ligandos ambidentados para modos de unión particulares. ¿Cómo podría explicarse la mayor estabilidad del K {Fe II [Cr III (NC) 6]} sobre el rojo K {Fe II [Cr III (CN) 6]} en términos del concepto ácido-base duro y blando?
- Contestar
-
La mayor estabilidad de K {Fe II [Cr III (NC) 6]} sobre K {Fe II [Cr III (CN) 6]} refleja la mayor estabilidad de los enlaces Fe II -Cn-Cr III en el primero sobre el Fe II -NC- Vínculos Cr III en este último. Esto es consistente con la preferencia por las interacciones ácido-base de Lewis duro-duro y blando blando del principio ácido-base duro y blando.
Los enlaces Fe II -Cn-Cr III son más estables porque poseen enlaces entre
- el ácido de Lewis más blando (Fe II) y la base de Lewis (el extremo C de CN -)
- el ácido de Lewis más duro (Cr III) y la base de Lewis (el extremo N de CN -)
Por el contrario, los enlaces Fe II-Nc-Cr III en el isómero de enlace menos estable implican enlaces entre
- la base más blanda (el extremo C de CN -) y el ácido más duro (Cr III)
- la base más dura (el extremo N de CN -) y el ácido más blando (Fe II)
Estereoisomería
Isomerismo óptico/quiralidad
Las moléculas de simetría D n, Cn o C1 con solo ejes de rotación adecuados (incluyendo E = C1) son quirales y exhiben isomería óptica. Como se describe en la Figura\(\sf{\PageIndex{1}}\), las principales fuentes de tal isomería óptica en la química de coordinación son:
-
Quiralidad inherente a un ligando orgánico o del grupo principal.
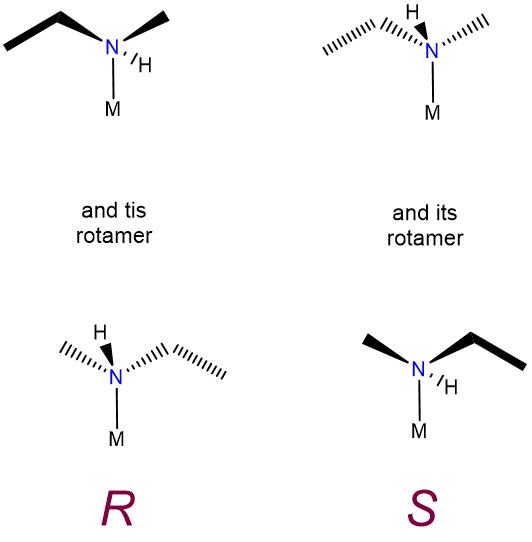
Este tipo de isomería es solo una extensión del tipo descrito en los textos orgánicos de pregrado y, en consecuencia, no merece una discusión separada aquí, aparte de señalar que algunas formas de isomería óptica que son de poca importancia en la química orgánica conducen a la actividad óptica en los compuestos de coordinación. En particular, el proceso de inversión de nitrógeno que sirve para racemizar rápidamente aminas quirales se congela tras la formación de un enlace metal-ligando. Debido a esta amina quiral, los ligandos unidos a un metal forman enantiómeros R y S no interconvertibles, como se muestra en la Figura\(\sf{\PageIndex{8}}\).
-
Quiralidad derivada de la simetría de ligandos alrededor de un centro metálico.
Las dos situaciones comunes a través de las cuales surge tal quiralidad involucran:
-
Quiralidad en un centro metálico tetraédrico rodeado por cuatro puntos diferentes de unión al ligando.
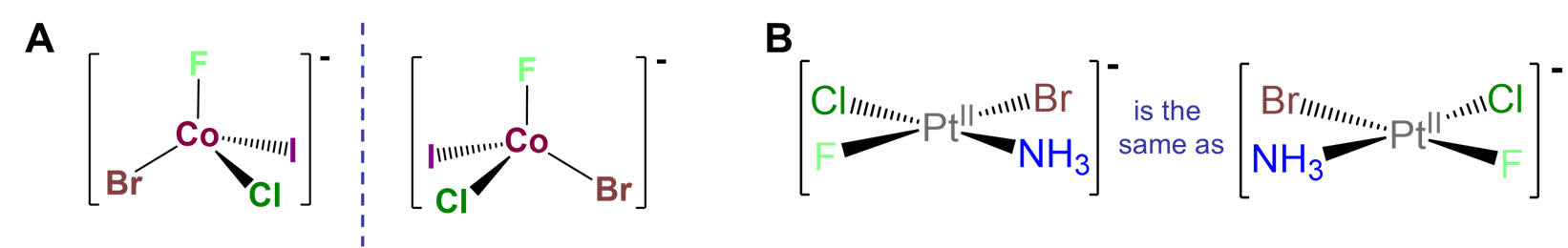
Tales casos se denominan a menudo MABCD o Mabcd donde M representa el metal y a, b, c y d los cuatro puntos diferentes de unión al ligando. Un ejemplo de tal complejo se da en la Figura\(\sf{\PageIndex{9A}}\). La quiralidad de tales complejos es análoga a la quiralidad derivada de un estereocentro de carbono tetraédrico. Sin embargo, hay dos advertencias. En primer lugar, no es suficiente tener un complejo de cuatro coordenadas; el metal debe poseer simetría tetraédrica ya que, como se muestra en la Figura\(\sf{\PageIndex{9B}}\), los complejos M planos cuadrados con cuatro ligandos diferentes son idénticos a sus imágenes especulares. En segundo lugar, dicha quiralidad se realiza más fácilmente usando ligandos macrocíclicos como proteínas. Los enlaces de ligando metálico que involucran complejos monodentados estéricamente sin impedimentos como los del ejemplo de la Figura\(\sf{\PageIndex{9A}}\) son en general más débiles y más flexibles que los enlaces carbono-carbono análogos. En consecuencia, en tales casos es probable que los enantiómeros se interconviertan a través de un proceso fluxional, dificultando su resolución si no imposible.
-
\(\Lambda\)e\(\Delta\) isomería en centros metálicos octaédricos rodeados por dos o tres ligandos quelantes.
Específicamente,
- Los tris-quelatos octaédricos de fórmula M (L~L) 3 presentan simetría D 3.
- Los bis-quelatos cis-octaédricos de fórmula M (L~L) 2 XY presentan simetría C2 o C1: C2 si X = Y y C1 si X\(\neq\) Y.
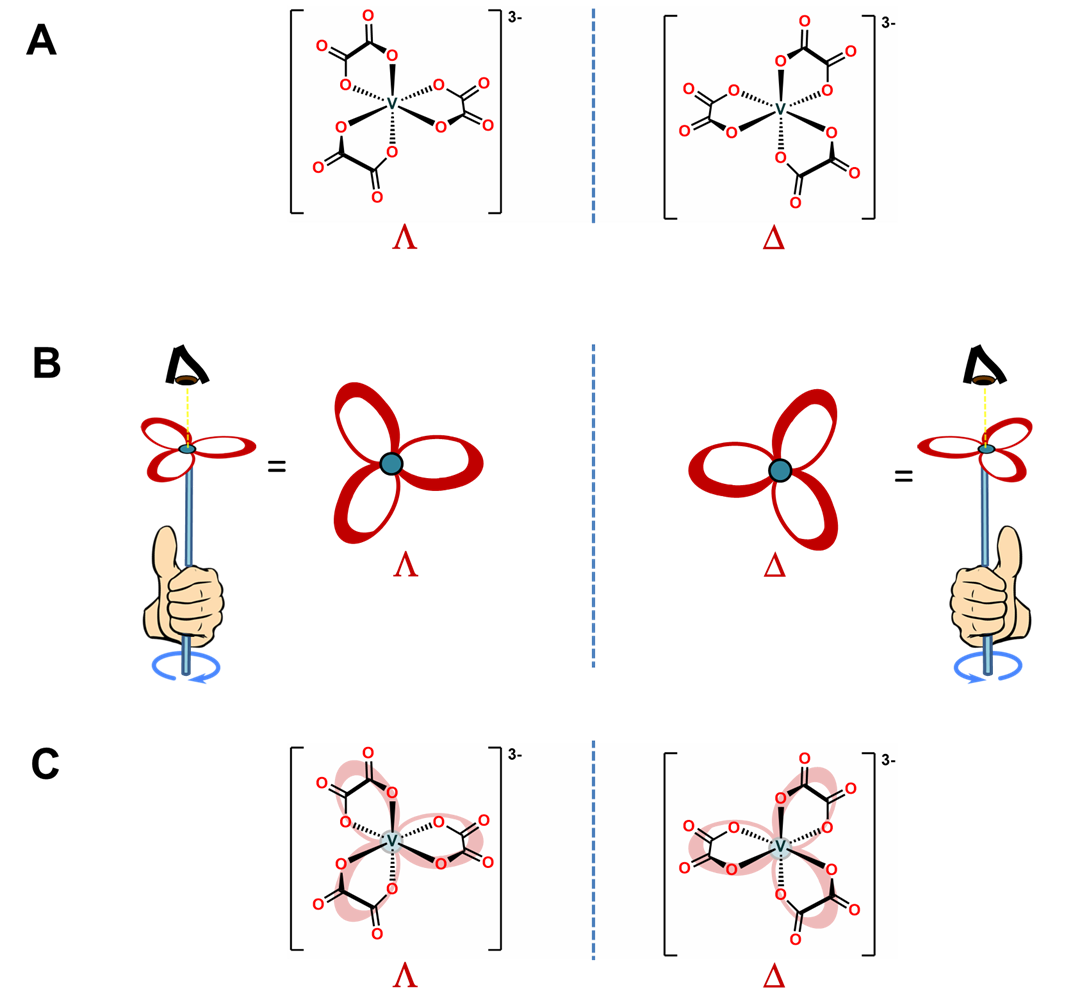
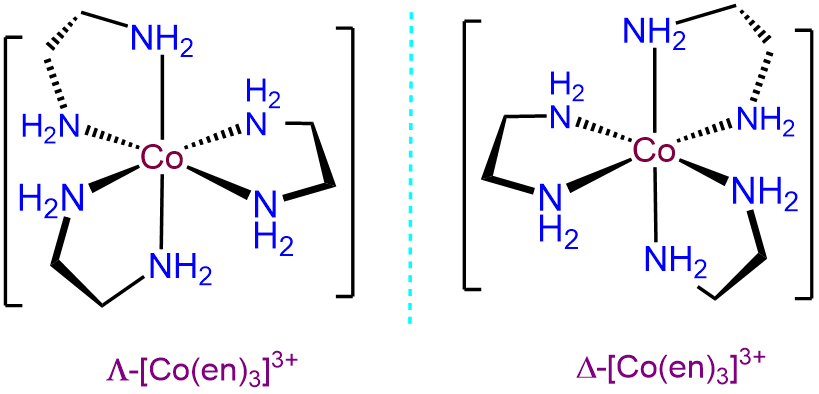
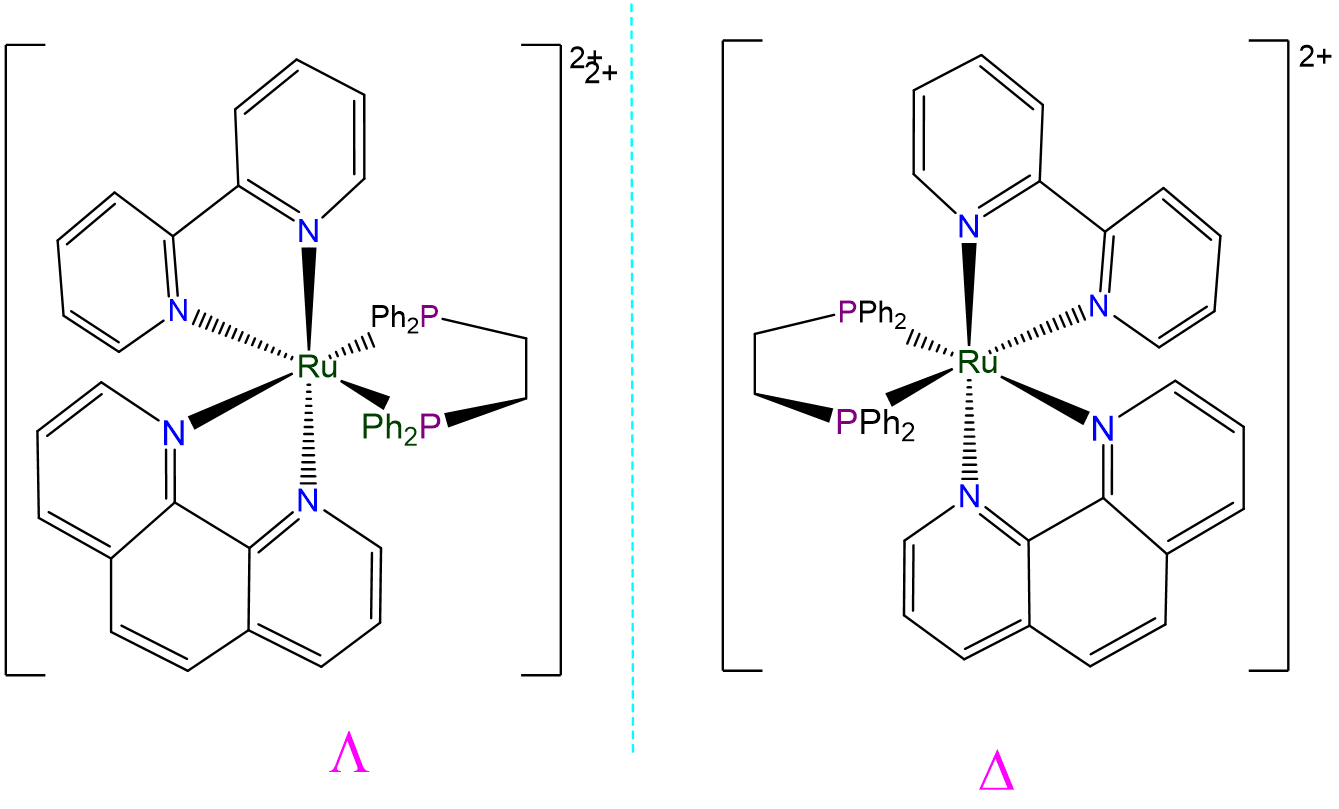
Como se muestra en la Figura\(\sf{\PageIndex{10A}}\), los tris-quelatos octaédricos como [V (ox) 3] 3- son quirales y pueden existir como no superponibles\(\Lambda\) y\(\Delta\) enantiómeros. La quiralidad de estos tris-quelatos es análoga a la de los molinillos. Como se muestra en la Figura\(\sf{\PageIndex{10B}}\), al mirar directamente la cabeza de cualquier molinete individual desde arriba, las cuchillas estarán en ángulo de atrás hacia adelante rodeando el molinete en el sentido de las agujas del reloj o en sentido contrario a las agujas del reloj. Como se muestra en la Figura\(\sf{\PageIndex{10C}}\), el caso para el que las cuchillas están anguladas en el sentido de las agujas del reloj es análogo al\(\Lambda\) enantiómero y el caso cuando están en ángulo en sentido antihorario el\(\Delta\).
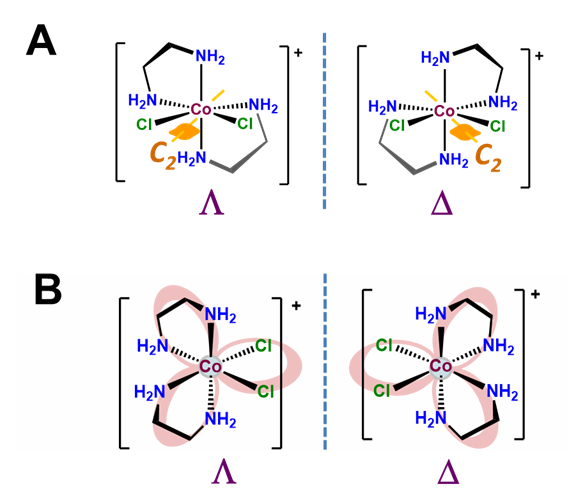
La\(\Lambda\)\(\Delta\) quiralidad en bis-quelatos octaédricos es análoga a la de los tris-quelatos excepto que esta vez el tercer ligando quelante es reemplazado por un par arbitrario de ligandos. Esto disminuye la simetría del complejo a C 2 o C 1, como se muestra para el complejo C 2 [CoCl 2 (en) 2] + en la Figura\(\sf{\PageIndex{11A}}\). En cualquier caso, el resultado es que tales complejos existen como\(\Lambda\)\(\Delta\) enantiómeros análogos a los de los tris-quelatos metálicos, como se muestra en la Figura\(\sf{\PageIndex{11B}}\).
Los complejos octaédricos que contienen ligandos con denticidades de cuatro o más también exhiben\(\Lambda\)\(\Delta\) quiralidad; es solo que en tales casos el ligando unido define múltiples anillos dentro del complejo que pueden definirse como existentes en cualquiera\(\Lambda\) u\(\Delta\) orientaciones relativas a cada uno otro. El procedimiento para realizar estas asignaciones está fuera del alcance de la mayoría de los cursos inorgánicos introductorios pero el resultado es que tales complejos se designan como\(\Lambda\Lambda\)\(\Delta\Delta\)\(\Delta\Lambda\),\(\Delta\Delta\Delta\),,, etc., dependiendo del número de relaciones que involucran los anillos definidos por el ligando unido. Los lectores interesados deben consultar la referencia 4 para más detalles.
Se puede usar dicroísmo circular para caracterizar complejos metálicos ópticamente activos.
En la actualidad, la forma más definitiva de determinar la configuración absoluta de un compuesto de coordinación ópticamente activo es determinar su estructura molecular 3D mediante cristalografía de rayos X monocristalino. 5 Sin embargo, como eso no siempre es posible o conveniente, la actividad óptica de los complejos de coordinación también se estudia comúnmente mediante espectroscopía de dicroísmo circular (CD). La espectroscopia CD se utiliza porque, a diferencia de la mayoría de los compuestos orgánicos quirales, los complejos de coordinación ópticamente activos poseen transiciones electrónicas de baja energía que ocurren en el rango UV lejano y visible. Esto significa que a menudo es conveniente utilizar la capacidad de un complejo para refractar y absorber diferentes polarizaciones circulares de luz para derivar información tanto sobre la configuración de un complejo ópticamente activo como sobre su estructura electrónica. El enfoque de esta sección será explicar cómo funciona la determinación de la configuración absoluta por dicroísmo circular y dispersión rotativa óptica, así como la relación de estas técnicas con el tipo más ordinario de polarimetría utilizada para medir la rotación óptica en sistemas orgánicos. Solo se harán breves notas sobre las aplicaciones de la estructura instrumental y electrónica de estas técnicas ya que los espectros electrónicos de los complejos metálicos serán discutidos en el Capítulo 11: Coordinación Química III - Espectros Electrónicos y los aspectos instrumentales de la CD están bien- tratados en otra parte.
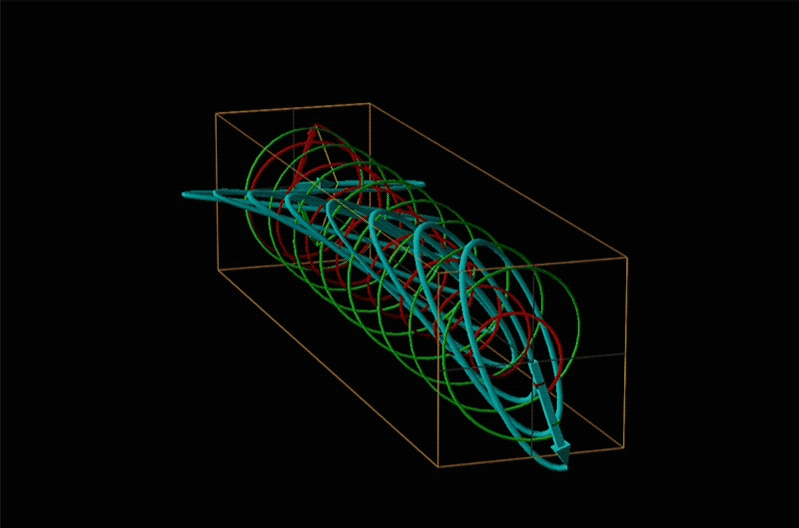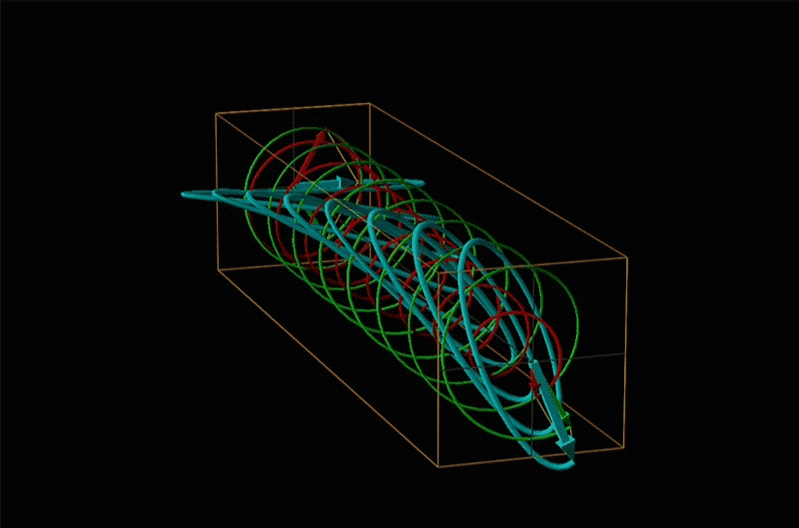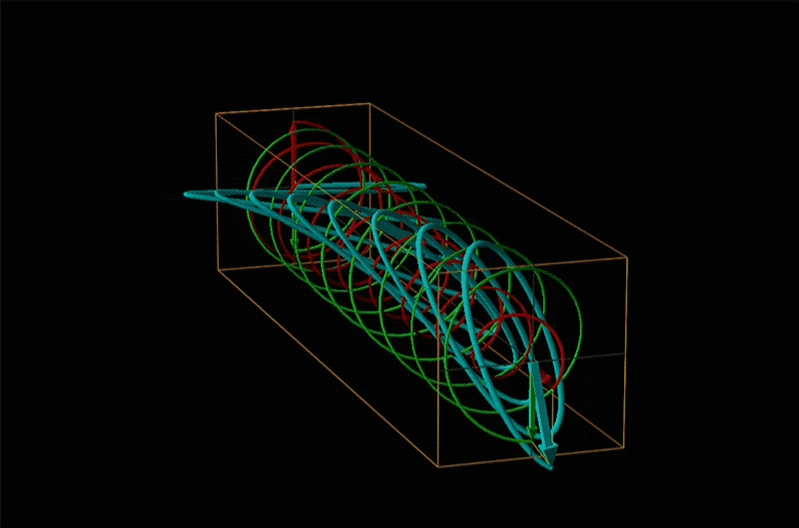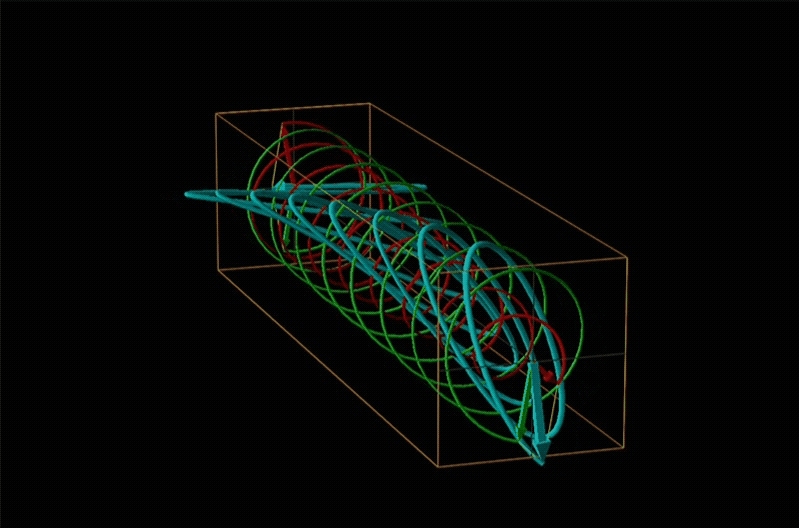
Tanto la polarimetría como la espectroscopía de dicroísmo circular se ponen a tierra en el reconocimiento de que la luz polarizada plana es equivalente a una superposición de luz polarizada circularmente izquierda y derecha, como se muestra en la Figura\(\sf{\PageIndex{12}}\).
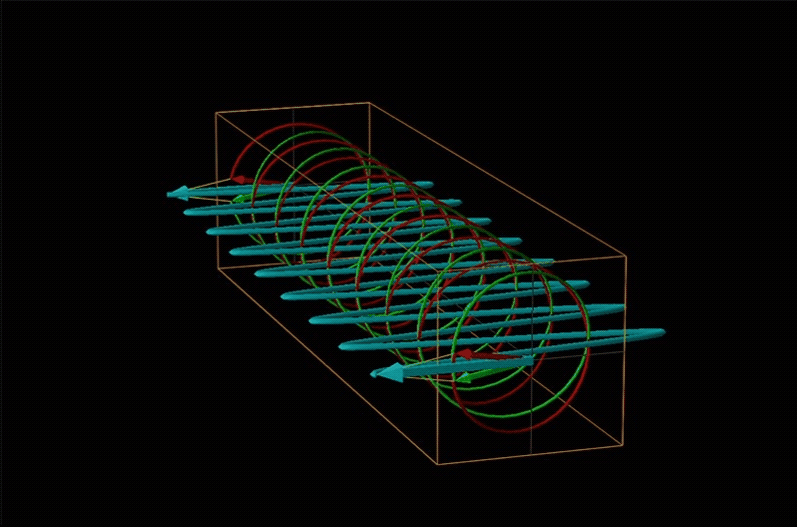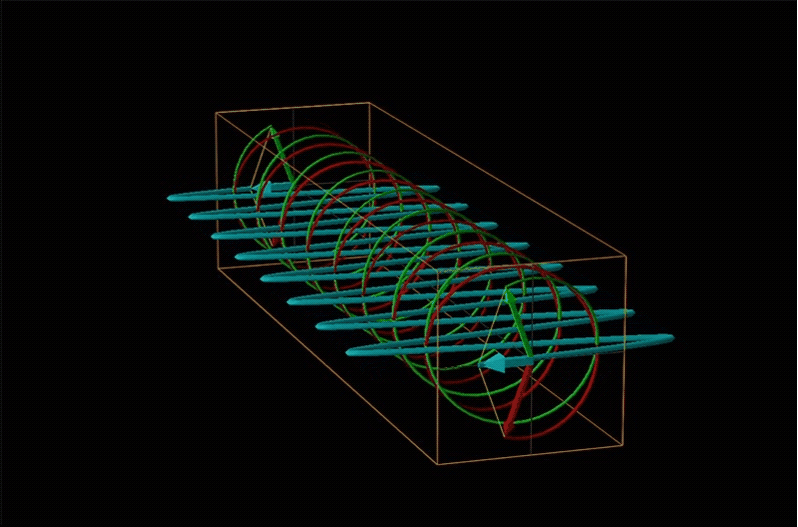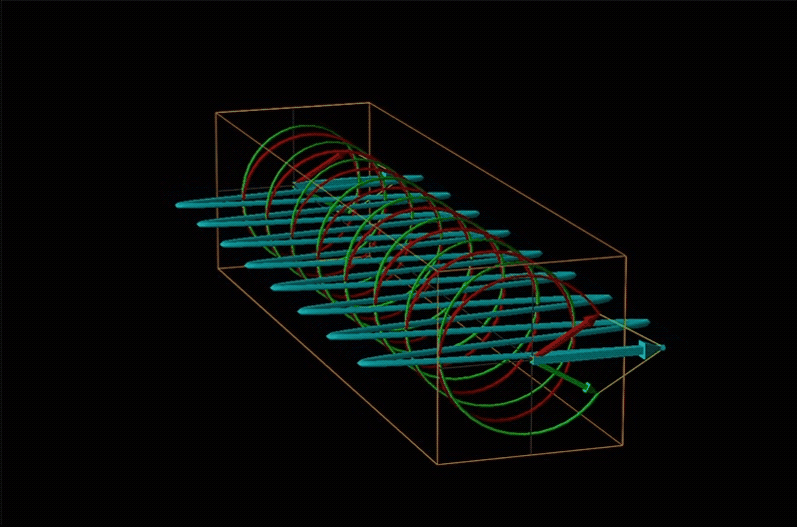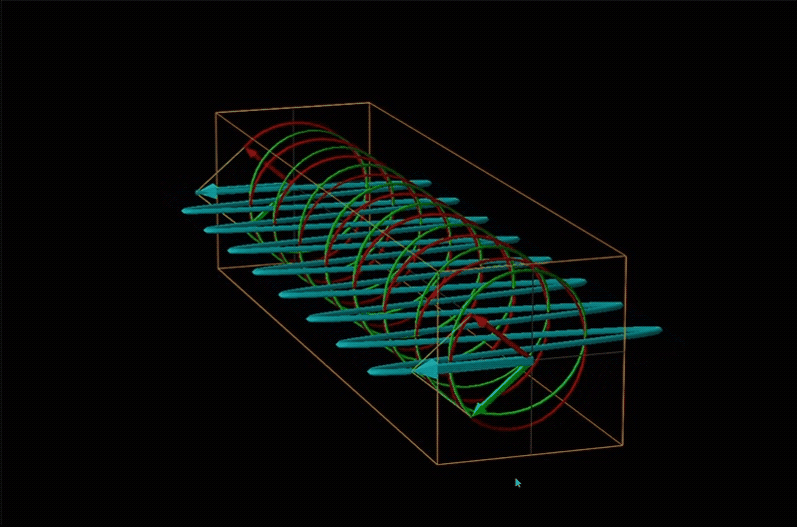

Cuando la luz polarizada plana pasa a través de un medio quiral, sus componentes polarizados circularmente izquierdo y derecho se mueven a diferentes velocidades (es decir, tienen diferentes índices de refracción). Esto hace que el plano de polarización gire en la dirección del componente más rápido de acuerdo con la relación
\[\sf{\alpha ~=~\dfrac{n_l~-~n_r}{\lambda}} \nonumber \]
donde\(\alpha\) está el ángulo de rotación,\(\lambda\) la longitud de onda de la luz, y n l y n r los índices de refracción experimentados por la luz polarizada circularmente izquierda y derecha.
Un ejemplo de tal rotación se muestra en la Figura\(\sf{\PageIndex{13}}\).

Los químicos suelen llamar a esta rotación de luz por una rotación óptica media quiral. En química orgánica es común medir la rotación óptica a la longitud de onda de sodio D de 589.29 nm, una longitud de onda mucho más larga que la mayoría de los orgánicos son capaces de absorber. Debido a esto, las rotaciones ópticas comúnmente medidas por los químicos orgánicos son en gran parte independientes de la absorción y principalmente sirven como una propiedad física característica similar a los puntos de fusión o se utilizan para establecer la pureza de una mezcla de enantiómeros. El tipo de datos espectroscópicos utilizados para caracterizar los compuestos de coordinación quiral más comúnmente hace uso de la relación entre absorción y rotación óptica.
En la química de coordinación se utiliza la dependencia de la longitud de onda de la rotación óptica para discernir información sobre los espectros electrónicos de los compuestos. Esta medición de la dependencia de la longitud de onda de la rotación óptica se denomina dispersión rotatoria óptica (ORD) y las gráficas resultantes se denominan dispersión rotatoria óptica o espectros o curvas ORD. Tales curvas ORD son útiles para caracterizar el ambiente quiral en un complejo de coordinación debido a que las curvas ORD presentan una forma característica. Esta forma característica se debe a que de acuerdo con el Efecto Algodón, la rotación óptica cambia de signo al máximo de absorción de un cromóforo en el compuesto. Para una configuración la rotación pasará de negativa a positiva con el aumento de la longitud de onda y se denomina efecto algodón positivo; para la otra configuración la rotación pasará de positiva a negativa o exhibirá un efecto algodón negativo. Este comportamiento se resume en las dos curvas superiores de la Figura\(\sf{\PageIndex{14}}\).
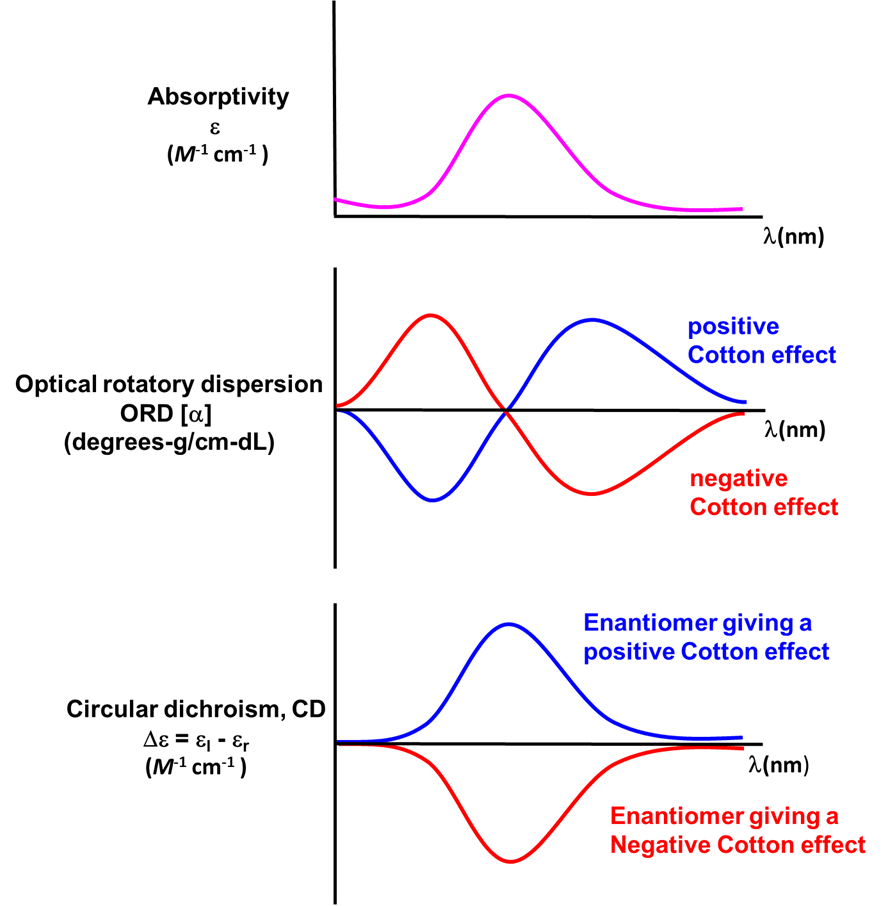
Una técnica utilizada incluso con más frecuencia que la ORD es el dicroísmo circular (CD), representado por el espectro más bajo en la Figura\(\sf{\PageIndex{14}}\). El dicroísmo circular surge de la absorción diferencial de luz polarizada circularmente izquierda y derecha por un compuesto quiral. Esto da luz polarizada elípticamente como se muestra en la Figura\(\sf{\PageIndex{15}}\).

En la espectroscopia de dicroísmo circular (CD) se irradia una muestra con luz polarizada dando como resultado la transmisión de luz polarizada elípticamente debido a la refracción diferencial y absorción de los componentes polarizados circularmente izquierdo y derecho de la luz polarizada. Para las moléculas aquirales, la mano no afecta la absorbancia, pero para las moléculas quirales, que estados quirales terrestres y excitados afecta la mano de una onda EM puede determinar con qué facilidad esa onda puede distorsionar el estado fundamental quiral en el excitado quiral. Por esta razón las moléculas quirales absorben la luz polarizada circularmente izquierda y derecha de manera diferente.
En la espectroscopia CD se miden las magnitudes de los componentes de luz polarizados circularmente izquierdo y derecho que se transmite por la muestra y se utilizan para determinar cuánta luz de cada uno se absorbió (al igual que en la espectroscopia de absorbancia regular). La diferencia de absorción entre la luz polarizada circularmente izquierda y derecha constituye la señal primaria en la espectroscopia CD. Más específicamente, los espectros de dicroísmo circular (espectros CD) muestran la diferencia en los coeficientes de extinción para la luz polarizada circularmente izquierda y derecha\(\Delta \epsilon\), en función de la longitud de onda, donde
\[\sf{\Delta \epsilon\ ~=~ \epsilon_l ~-~\epsilon_r} \nonumber \]
donde\(\epsilon_\sf{l}\) y\(\epsilon_\sf{r}\) son los coeficientes de extinción observados con luz polarizada circularmente izquierda y derecha, respectivamente.
Al igual que con los espectros ORD, los signos de las características en los espectros de CD como el de Δ— [Co (en) 3] Cl 3 dados en la Figura\(\sf{\PageIndex{16}}\) son dependientes de enantiómeros. Como se ilustra en el espectro inferior en la Figura\(\sf{\PageIndex{14}}\), los espectros CD de enantiómeros se reflejan entre sí. Debido a esta diferencia de comportamiento es posible en principio determinar la configuración absoluta de un complejo a partir de su espectro CD.
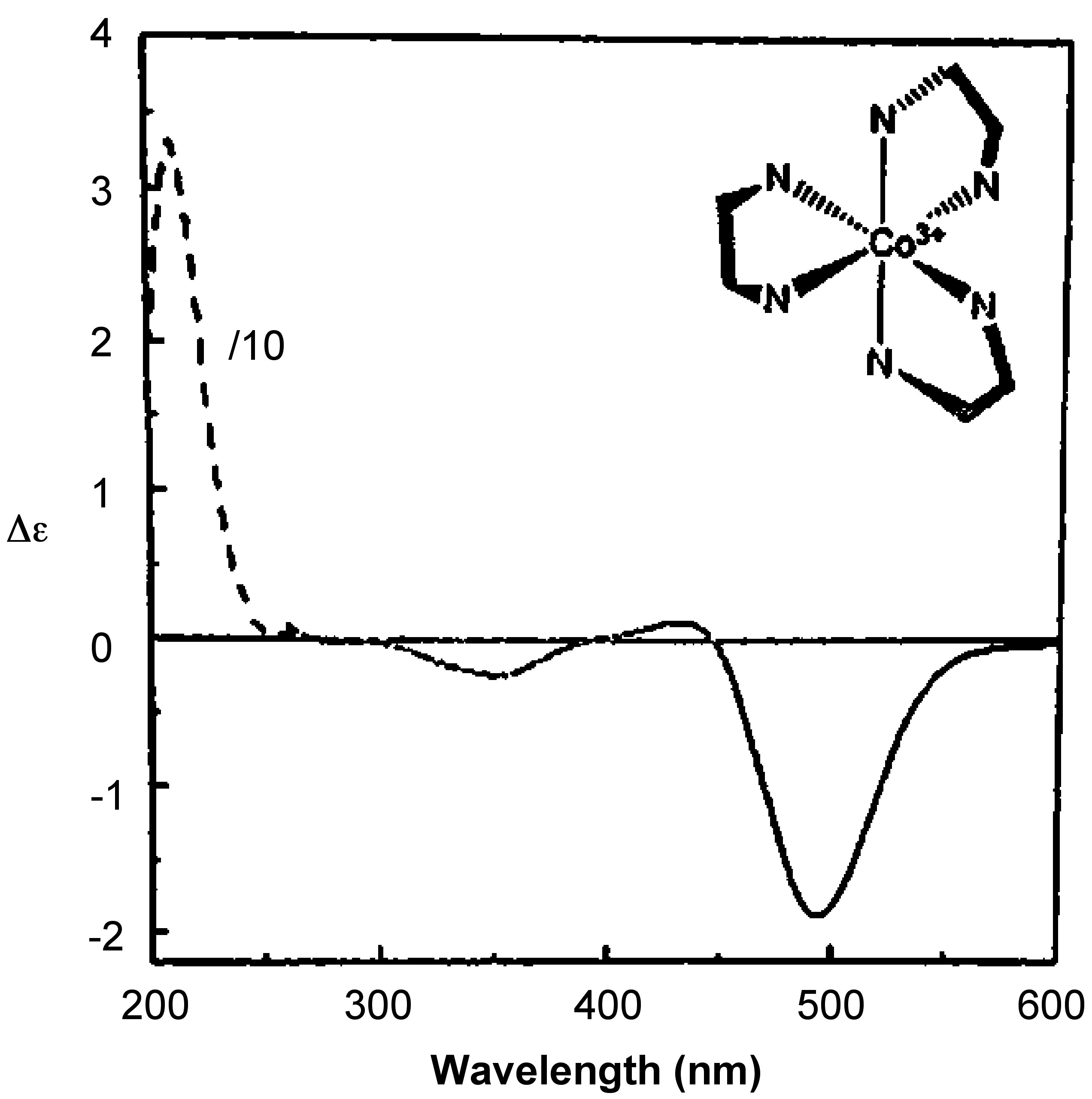
Hay varias maneras en que los espectros ORD y CD pueden ser útiles para determinar la configuración absoluta de un complejo quiral.
- Primero, el signo del efecto Cotton y los picos en los espectros de CD exhibidos por una configuración absoluta dada a menudo es consistente en una serie de compuestos. Así, si se aísla un nuevo miembro de la serie, su configuración se puede determinar en base a qué enantiómero tiene el mismo efecto Cotton. Por ejemplo, si tanto el\(\Lambda\) isómero de un complejo de diimina metálica como [Ru (bpy) 3] 2+ exhiben un efecto Cotton positivo y una diimina metálica recién resuelta exhibe un efecto Cotton negativo, se podría inferir razonablemente que el complejo recién resuelto está en lo contrario o \(\Delta\)configuración.
- Segundo, para algunos sistemas el signo esperado del efecto Cotton y los picos de CD para cada enantiómero pueden predecirse semiempíricamente con base en las ubicaciones espaciales de los sustituyentes relativos al cromóforo (la parte de la molécula que cambia la estructura electrónica durante la transición), aunque los detalles son más allá del alcance de la presente discusión.
- La consideración de las interacciones entre múltiples cromóforos en un compuesto puede usarse para inferir la configuración absoluta. Nuevamente, los detalles están más allá del alcance de la presente discusión. Se remite a los lectores interesados a la referencia 7 para más detalles.
Patrones comunes de Diastereomerismo
Isomería geométrica
El isomerismo geométrico implica diferencias en la colocación geométrica de los átomos en un compuesto. En la química de coordinación, el isomerismo geométrico implica diferencias en la colocación relativa de un conjunto de ligandos alrededor de un centro metálico. Hay dos tipos principales:
isomería cis y trans
Este tipo de isomería tiene que ver con cómo se orientan dos ligandos uno respecto al otro en un complejo cuadrado plano u octaédrico. Como se muestra en la Figura\(\sf{\PageIndex{17}}\), se dice que los ligandos que están uno al lado del otro con un ángulo de enlace L-M-L de 90\(^{\circ}\) son cis; aquellos en lados opuestos del metal con un ángulo de enlace L-M-L de 180\(^{\circ}\) están en la disposición trans.
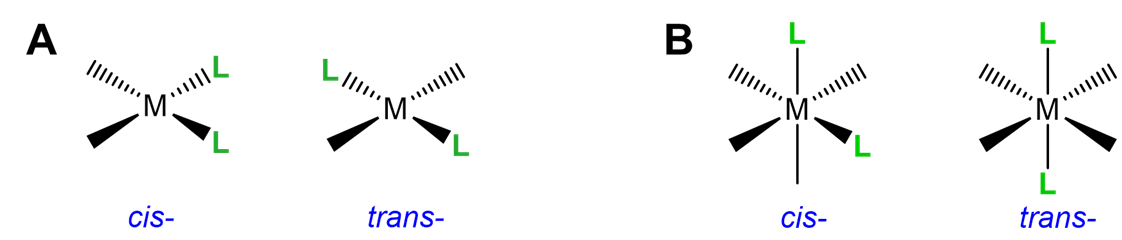
Los isómeros geométricos cis y trans simples se pueden identificar cuando hay dos ligandos idénticos (A) o ligandos quelantes con puntos de unión distinguibles (A~B) orientados alrededor de un centro plano cuadrado o octaédrico. Los ejemplos se dan en la Figura\(\sf{\PageIndex{18}}\). Observe del ejemplo dado en la Figura\(\sf{\PageIndex{18C}}\) que los ligandos multidentados tienen el potencial de constreñir complejos para adoptar una geometría particular.
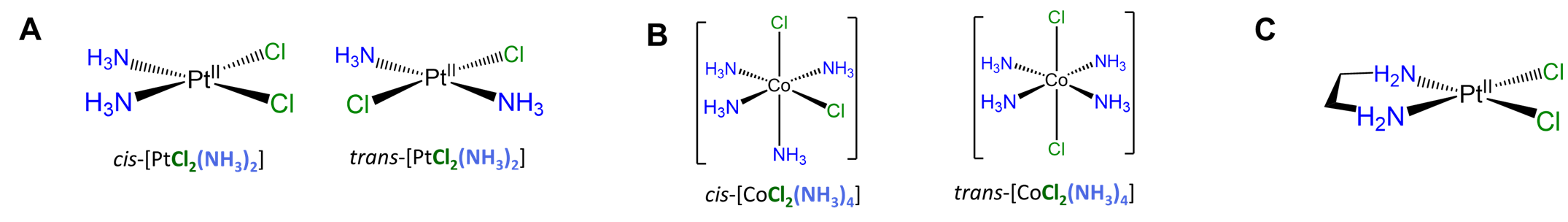
Los ejemplos ligeramente más involucrados involucran perturbaciones de los casos simples anteriores en los que existen múltiples relaciones cis y/o trans distinguibles. Dos ejemplos planos cuadrados se dan en la Figura\(\sf{\PageIndex{19}}\).
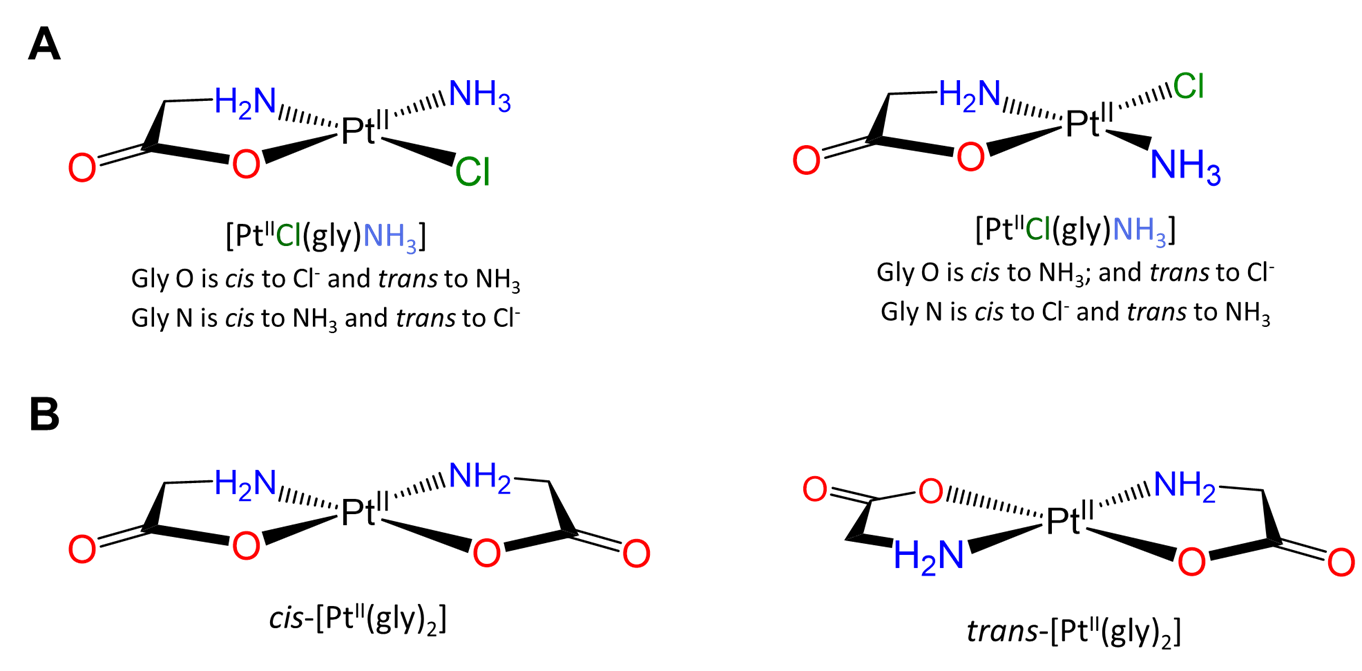
Ejemplos más complejos de relaciones cis y trans entre ligandos en complejos octaédricos se dan en los ejercicios que concluyen esta página, lo que también demuestra cómo se puede utilizar un enfoque sistemático para identificar isómeros.
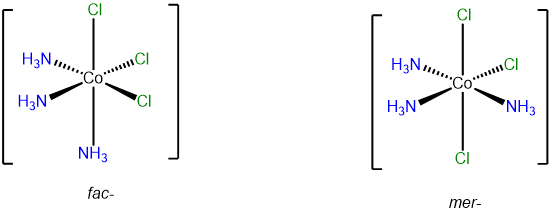
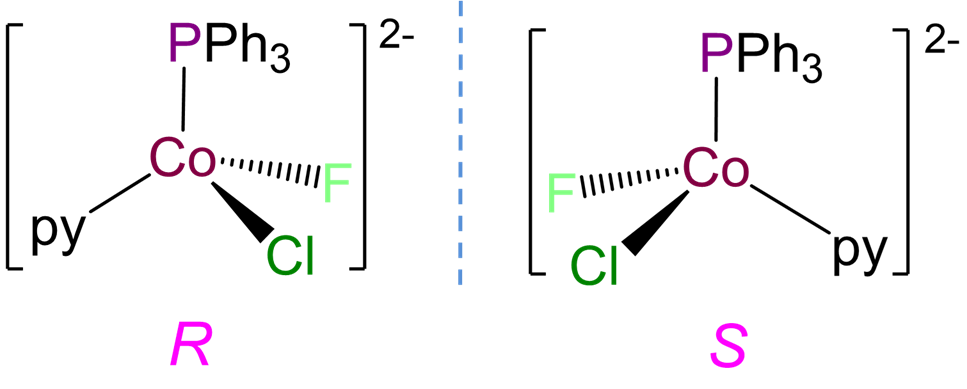
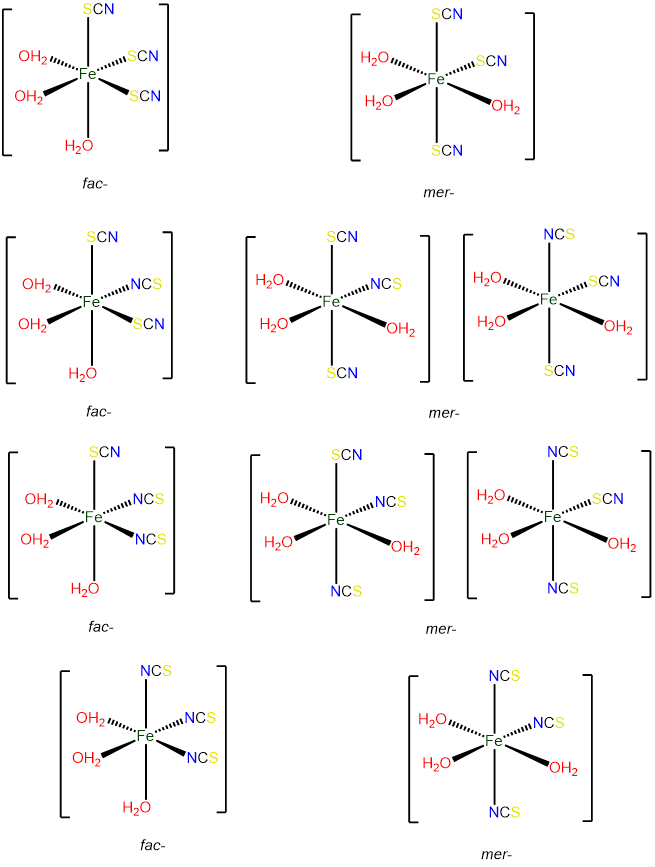
isomería mer y fac
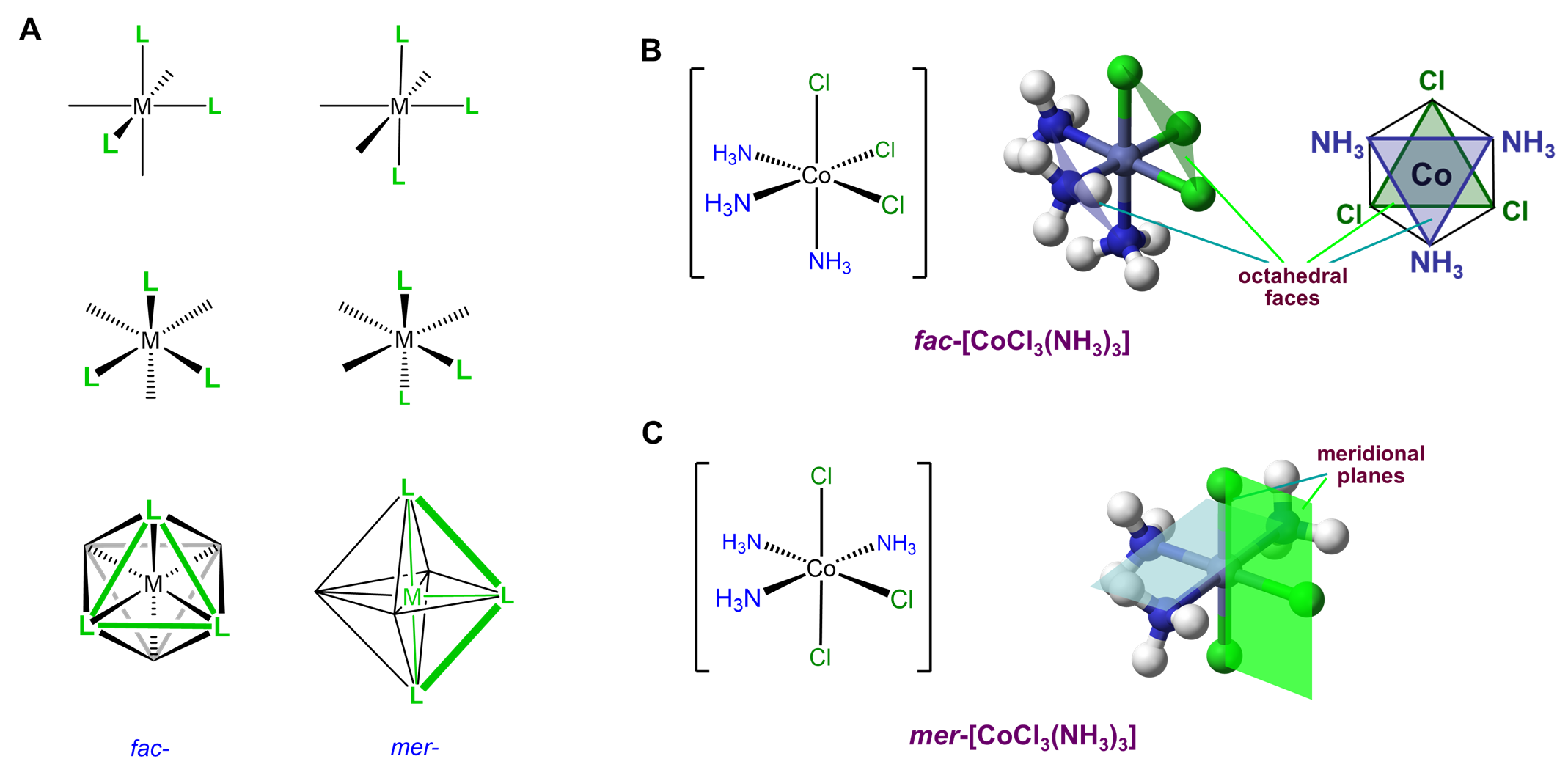
Este tipo de isomería tiene que ver con cómo se orientan tres ligandos uno respecto al otro en un complejo octaédrico. Los arreglos se representan en la Figura\(\sf{\PageIndex{20}}\).
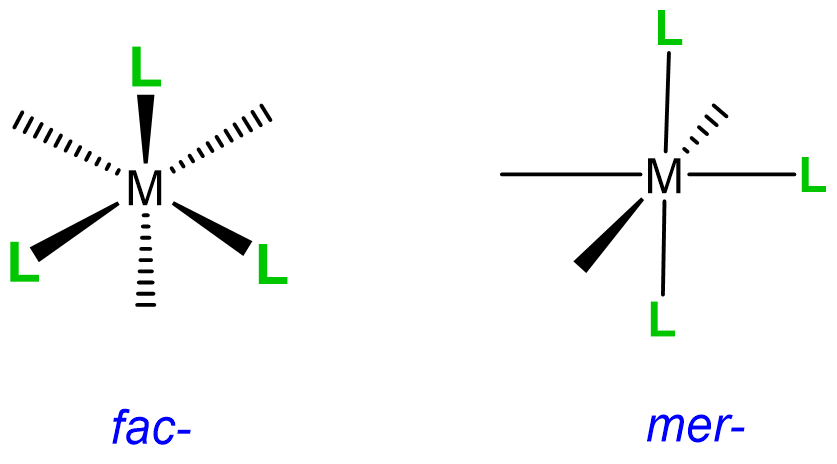
Dado que puede ayudar a visualizar la geometría mer y fac desde múltiples puntos de vista, se dan varias representaciones en la Figura\(\sf{\PageIndex{21}}\). Como se muestra en la Figura\(\sf{\PageIndex{21}}\), en arreglos fac o faciales, los ligandos ocupan la misma “cara” de la esfera de coordinación octaédrica, mientras que en la geometría mer o meridional los ligandos forman una forma de T en el mismo plano o su “meridiano”. 8
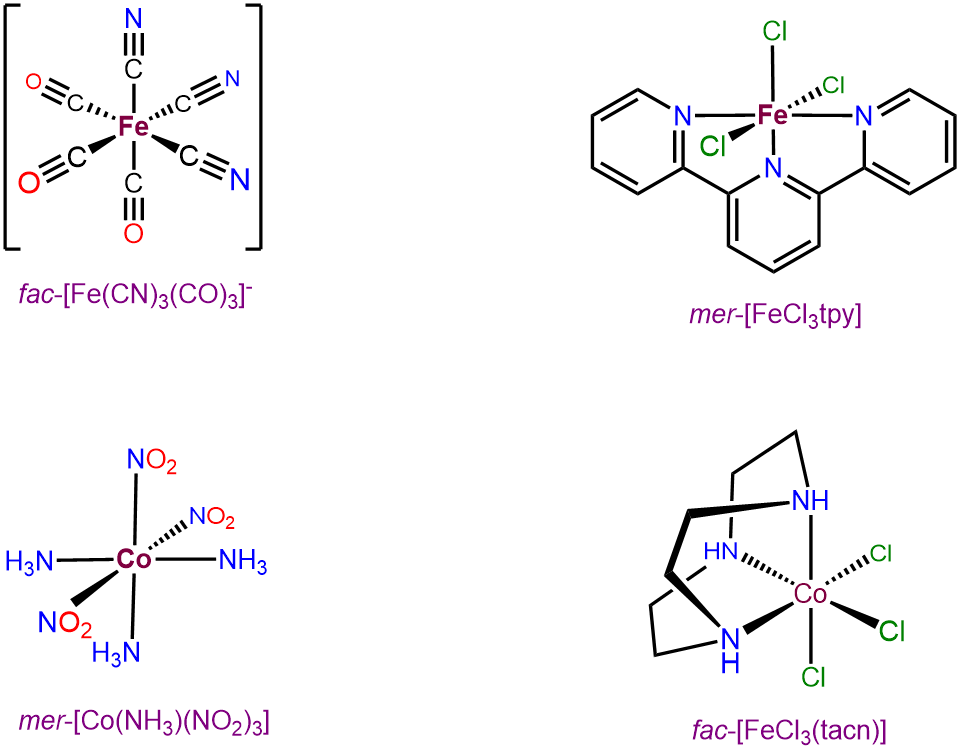
Los complejos octaédricos con tres ligandos idénticos orientados alrededor de un centro octaédrico solo pueden existir en arreglos mer y fac. En consecuencia, tales complejos pueden designarse como isómeros mer y fac. Los ejemplos se dan en la Figura\(\sf{\PageIndex{22}}\).
Diastereomerismo derivado de múltiples centros quirales asociados a ligandos
El diastereomerismo también puede surgir cuando dos o más ligandos quirales se unen a un centro metálico. Tales casos suelen dar lugar a una mezcla compleja de isómeros, como se muestra en el ejemplo de la Figura\(\sf{\PageIndex{23}}\). Como puede verse a partir de la Figura\(\sf{\PageIndex{23}}\), las diferencias entre estos isómeros pueden surgir tanto de cambios en la configuración estereoquímica del ligando como de la relación de centros de ligando particulares entre sí. Por ejemplo, las dos estructuras más a la izquierda de la Figura\(\sf{\PageIndex{23}}\) poseen un centro de nitrógeno R y S cada una, pero difieren en si los centros están orientados de manera que los centros R y S en los dos ligandos son trans o cis entre sí .
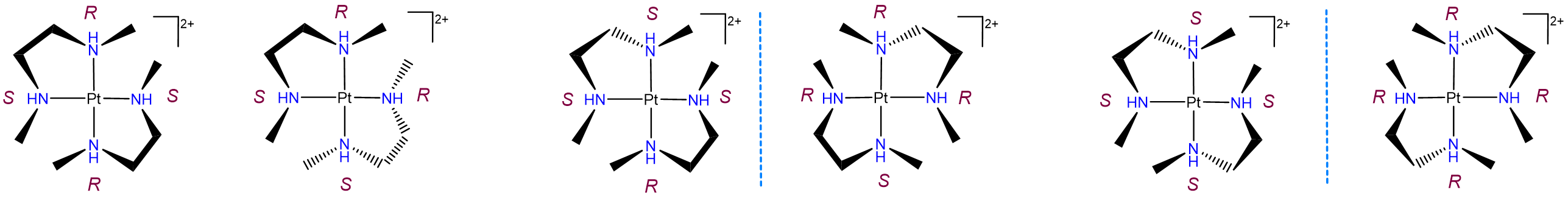
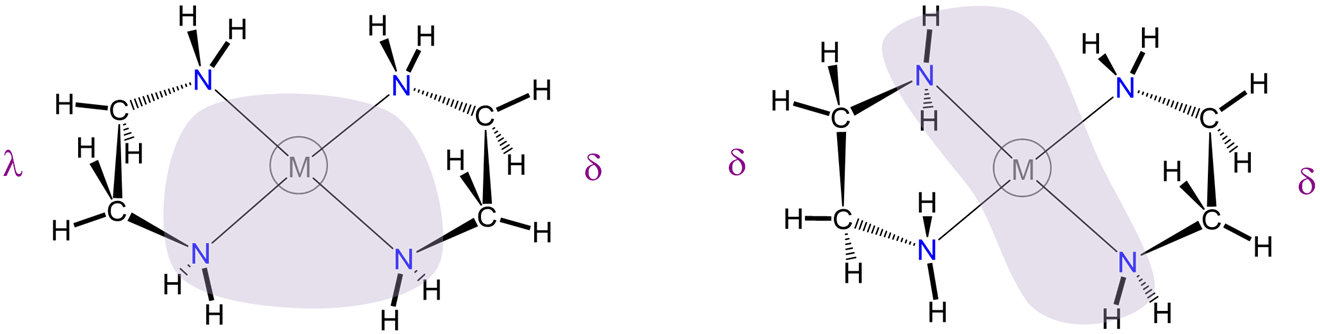
Diastereomerismo derivado de\(\lambda\) e isomerismo de conformación de\(\delta\) anillos.
Los anillos de quelato se forman cuando un ligando quelante se une a un metal
Como también puede verse a partir de las estructuras de la Figura\(\sf{\PageIndex{23}}\), cuando un ligando multidentado coordina un metal, el ligando y el centro metálico comprenden uno o más anillos de quelato. Ejemplos de tales anillos de quelato se muestran en la Figura\(\sf{\PageIndex{24}}\).
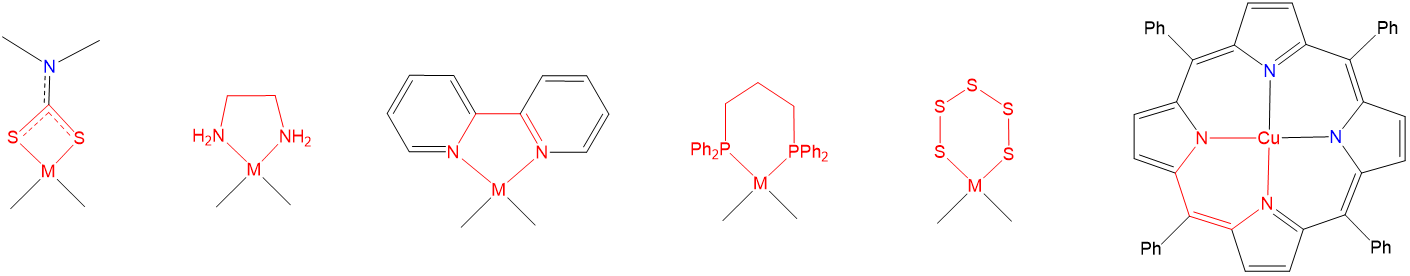
Como puede deducirse de los ejemplos de la Figura\(\sf{\PageIndex{24}}\), los anillos de quelato pueden ser de diferentes tamaños, aunque son particularmente comunes los anillos de cuatro, seis y especialmente cinco miembros. Exactamente qué tamaños de anillo serán más estables para un sistema dado depende de la geometría de coordinación y, debido a las diferencias en las longitudes de unión M-L, en menor grado del metal. Como resultado, para los complejos octaédricos y planos cuadrados con 90 ángulos de enlace\(^{\circ}\) L-M-L entre ligandos cis, los anillos de cinco miembros tienden a ser especialmente estables (Figura\(\sf{\PageIndex{25}}\)).
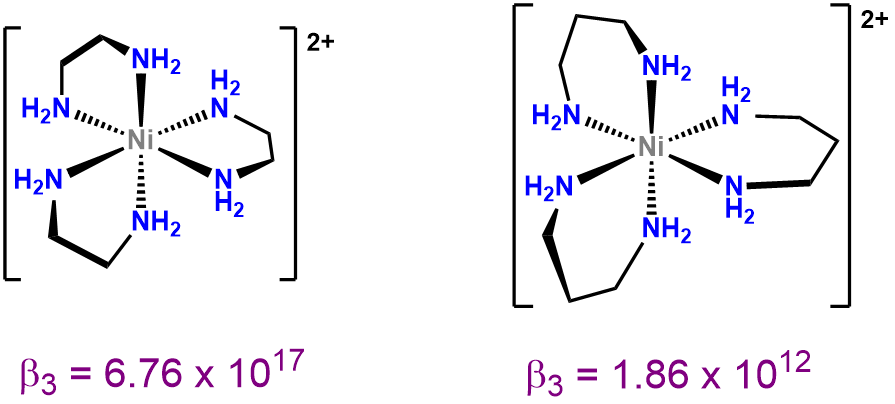
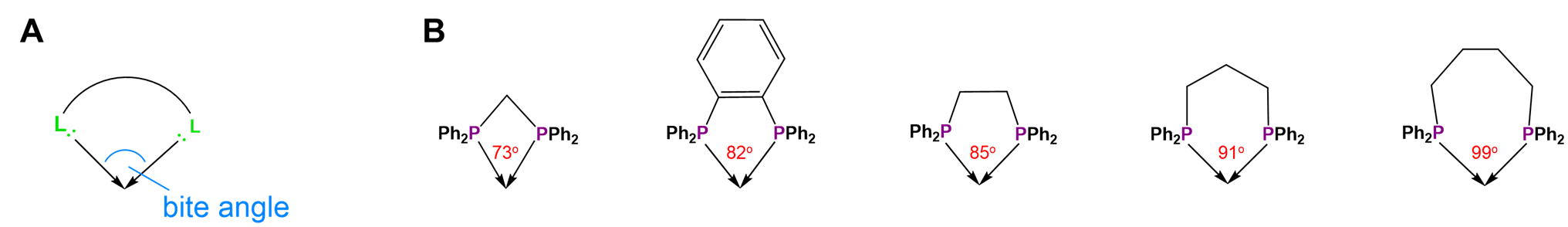
No todos los quelatos metálicos prefieren formar anillos de cinco miembros. Los requisitos estéricos de los anillos de quelato dependen tanto de la geometría de coordinación preferida del centro metálico como de la estereoquímica del ligando. Ambos efectos se consideran típicamente en términos de ángulos de enlace L-M-L preferidos. Desde la perspectiva del centro metálico, el ángulo de unión preferido está determinado por la geometría de coordinación. Los metales planos octaédricos y cuadrados prefieren 90 amgles de enlace\(^{\circ}\) L-M-L, sistemas bipiramidales trigonales 90 y 120 ángulos de enlace\(^{\circ}\) L-M-L y complejos tetraédricos 109.5 ángulos\(^{\circ}\) L-M-L. Los ángulos de enlace preferidos más grandes en los sistemas bipiramidales tetraédricos y trigonales a menudo requieren la formación de anillos de quelato de seis o siete miembros más grandes para una estabilidad máxima. El tamaño del anillo quelato realmente formado entre un metal y un ligando está determinado por la estructura del ligando. Como contribuyente de todos los átomos en el anillo quelato excepto uno, el ligando determina directamente el tamaño del anillo del quelato. Más sutilmente, los ligandos prefieren naturalmente coordinar los metales en un ángulo particular L-M-L, llamado ángulo de mordida, como se muestra en la Figura\(\sf{\PageIndex{26A}}\). Los ligandos con ángulos de mordida correspondientes al ángulo L-M-L ideal para la geometría preferida de un metal tienden a formar complejos más estables, aunque a su vez los ángulos de mordida del ligando pueden provocar que los metales con una geometría de coordinación débil prefieran adoptar la geometría preferida del ligando. 10 Como puede verse a partir de los valores de la Figura\(\sf{\PageIndex{26B}}\), los ángulos de mordida aumentan aproximadamente con el tamaño del anillo quelato formado, pero también están influenciados por los tipos de estructuras utilizadas para conectar los sitios base de Lewis del ligando. Esto facilita el uso de ligandos de difosfina para adaptar la estructura y reactividad de catalizadores organometálicos que contienen fosfina.
\(\lambda\)y el\(\delta\) isomerismo implica diferencias en la conformación de anillos de quelato de cinco miembros no planares
Como se muestra en la Figura\(\sf{\PageIndex{27}}\), algunos sistemas de anillos quelatos son planos mientras que otros no lo son.
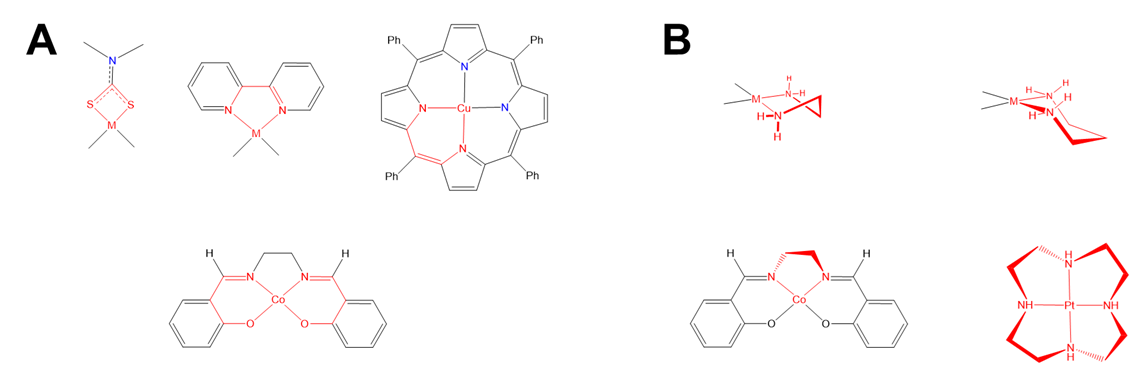
Entre los sistemas de anillos de quelato no planares se encuentran ligandos como en y dppe, que contienen átomos tetraédricos de C, N, O, P y S. Debido a que estos átomos crean torceduras en el anillo de quelato, introducen oportunidades adicionales para el diastereomerismo debido a las diferencias en la conformación del anillo de quelato, llamada torsión del anillo. La torsión del anillo en sistemas no planares se ha explorado más extensamente para quelatos de cinco miembros como los formados por dppe y por en y otras aminas quelantes. A diferencia de los anillos quelatos de cuatro miembros más rígidos, los quelatos de cinco miembros tienden a ser conformacionalmente flexibles, pero no tan conformacionalmente flexibles que sus conformadores se interconvierten rápidamente a temperatura ambiente (al menos no cuando los anillos se sustituyen para introducir tensión estérica adicional). Este equilibrio entre flexibilidad y rigidez permite que algunos anillos de quelato de cinco miembros existan como mezclas de isómeros conformacionales distinguibles a temperatura ambiente.
Para entender los dos conformadores más estables que tienden a formar los anillos de quelatos de cinco miembros, es útil pensar que los anillos de quelato de cinco miembros involucran dos componentes (Figura\(\sf{\PageIndex{28}}\)):
- un grupo plano L-M-L, donde L son los átomos directamente unidos al metal, M, y
- los dos átomos restantes del anillo, E, que forman una barra E-E rígida a través de la parte posterior del anillo de quelato.
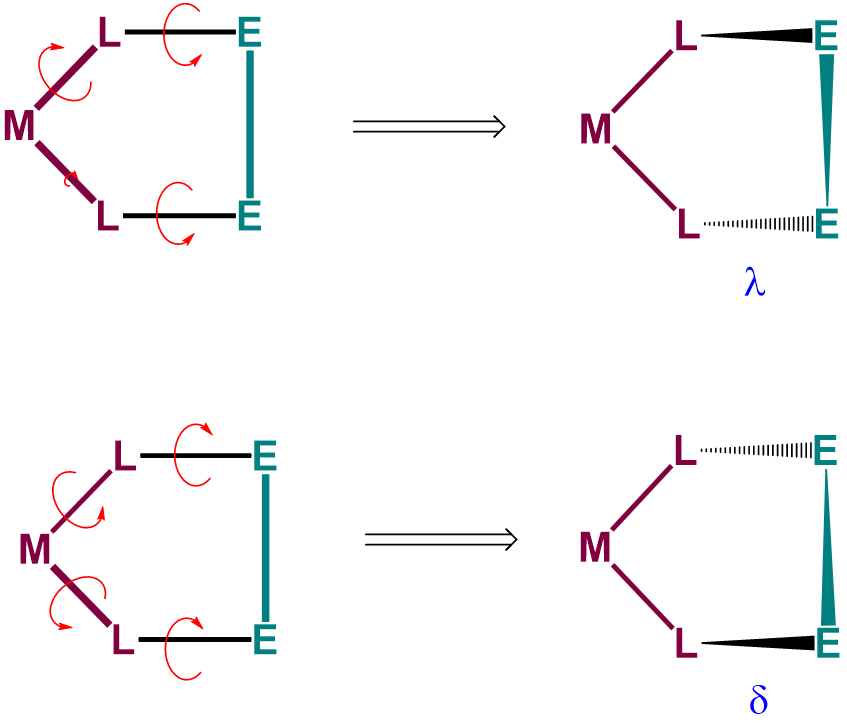
Como se puede ver en la Figura\(\sf{\PageIndex{28}}\), la rotación alrededor de las uniones M-L y L-E provoca la torsión de la barra E-E con relación al plano L-M-L. Los dos conformadores más estables producidos por estos movimientos son las conformaciones\(\lambda\) o\(\delta\) conformaciones como se muestra en las Figuras\(\sf{\PageIndex{29}}\) y\(\sf{\PageIndex{29}}\).
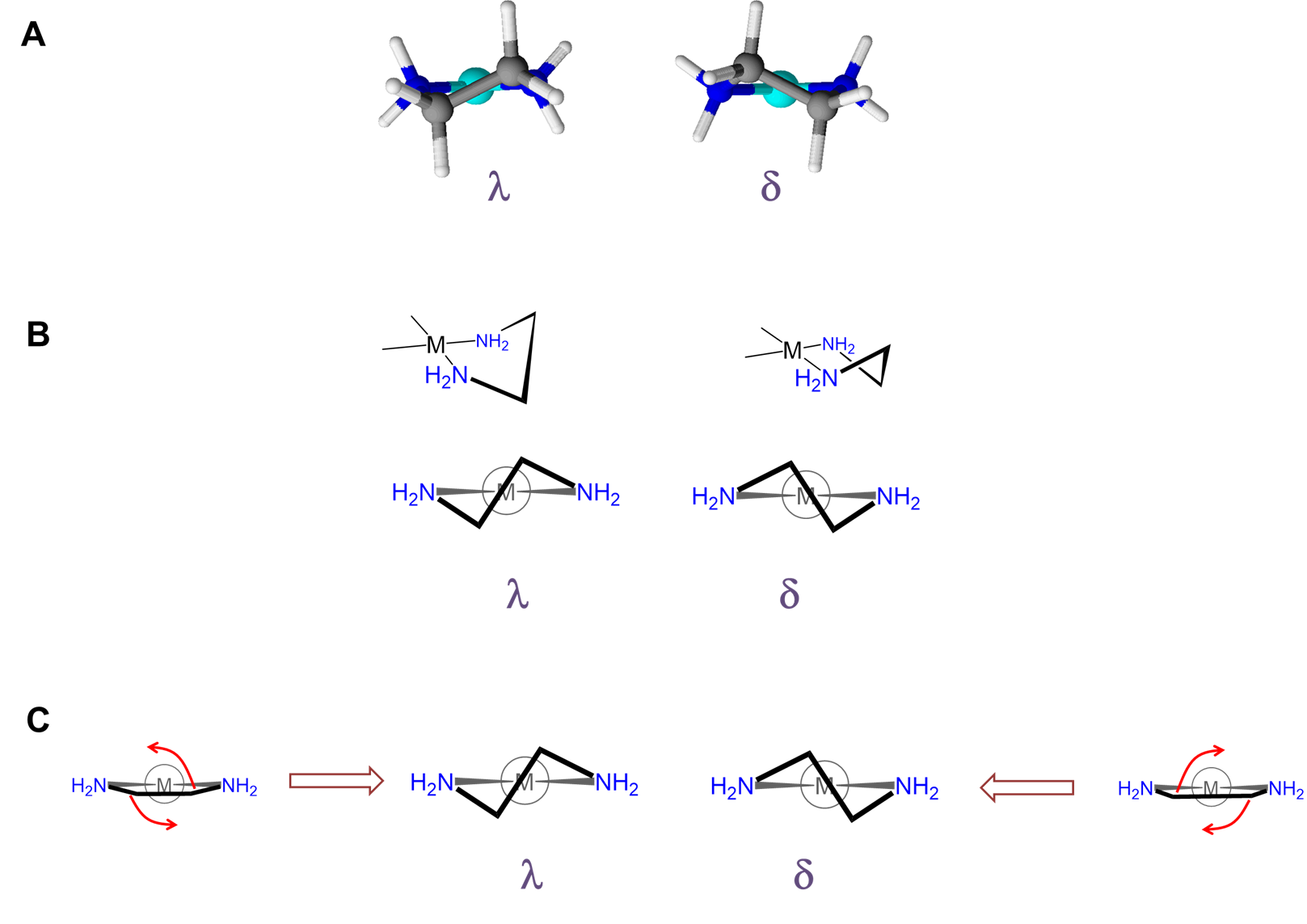
La estabilidad relativa de los\(\delta\) conformadores\(\lambda\) y dependerá de la configuración de cualquier estereocentros presentes y factores estéricos. Al igual que con los sistemas de anillos orgánicos, los efectos estéricos tienden a favorecer confórmeros en los que los grupos voluminosos se colocan en las posiciones ecuatoriales menos tensas estéricamente mientras que la configuración de los estereocentros presentes puede servir para restringir las conformaciones de torsión de anillo permisibles, como se ilustra en la Figura\(\sf{\PageIndex{30}}\). Un tratamiento detallado de dichos sistemas está fuera del alcance de esta página. Se remite a los lectores interesados a la referencia 12 para más detalles.
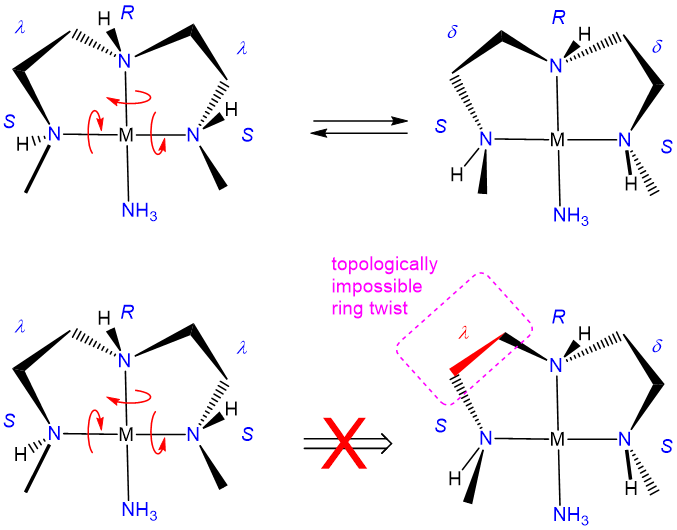
Para concluir, cabe señalar que podría parecer estar produciendo muchos efectos pequeños al señalar que una fuente de diastereomerismo en los complejos metálicos implica la congelación de las conformaciones del anillo de quelato. Sin embargo, eso sería confundir los impactos que las conformaciones de anillos pueden tener en la accesibilidad estérica de un sitio de coordinación y dar forma al curso de los procesos que pueden ocurrir allí. Como se ilustra en la Figura\(\sf{\PageIndex{31}}\), un desplazamiento simple en la conformación de un anillo en un complejo plano cuadrado, piramidal u octaédrico que contiene ligandos coplanares de etilendiamina puede ejercer un efecto significativo sobre el perfil estérico del complejo perpendicular al cuadrado MN 4. avión. Debido a efectos como estos, el isomerismo de conformación de anillos juega un papel en el diseño de catalizadores de metales de transición estereoselectivos.
Ejercicios
Qué tipo de isómeros son
- [CoCl (NH 3) 5] (NO 3) y [Co (NH 3) 5 (N- NO 2)] Cl?
- [Co (NH 3) 5 -Cn-Ru (NH 3) 5] 4+ y [Co (NH 3) 5 -NC-ru (NH 3) 5] 4+
- [Cr (CN) 5 -Cn-Co (NH 3) 5] y [Co (CN) 5-Cn-Cr (NH 3) 5]
- cis - [Mn (en) 2 (CN) 2] y trans - [Mn (es) 2 (CN) 2]
- Contesta a.
-
Isómeros de ionización.
- Respuesta b.
-
Isómeros de enlace.
- Respuesta c.
-
Isómeros de coordinación.
- Respuesta d.
-
Isómeros geométricos, específicamente isómeros cis/trans.
Muchas propiedades de los complejos de metales de transición dependen del estado de oxidación del metal. Por ejemplo,
- Los complejos octaédricos de Co II pierden y ganan ligandos rápidamente
- Los complejos octaédricos de Co III pierden y ganan ligandos muy lentamente
- complejos de cuatro coordenadas son generalmente tetraédricos
- EXCEPTO complejos de cuatro coordenadas de metales como Pt II, Pd II, Rh I e Ir I, entre otros, son planos cuadrados
Por esta razón es importante poder estimar el estado formal de oxidación de un metal en un complejo. Afortunadamente, esto es fácil de hacer si recuerdas
- La suma de todos los estados de oxidación de los átomos será igual a la carga general en el complejo
- Al determinar el estado de oxidación del metal, los ligandos pueden tratarse como que tienen un estado de oxidación igual a su carga -es decir, la carga que poseen en la forma en que coordinan el metal- por lo que si necesitan perder un protón para unirse, no olvide dar cuenta de eso.
Dado lo anterior, estimar el estado de oxidación del metal en los siguientes complejos reales e hipotéticos.
- Na 4 [Fe (CN) 6]
- [Cu (phen) 2] BF 4
- [PtF 4 (NH 3) 2]
- [Ni (es) 2] SO 4
- Co (acac) 3
- [MnCl (O) (salen)]
- Respuesta para Na 4 [Fe (CN) 6].
-
Este contiene [Fe (CN) 6] 4-; así O.S. Fe + 6 x (-1) (para CN -) = -4 (la carga del complejo) así que O.S. Fe = +2 o Fe 2 +.
- Respuesta para [Cu (phen) 2] BF 4.
-
Dado que el tetrafluoroborato es un monoanión, el complejo es [Cu (phen) 2] + así O.S. Cu + 0 x 2 (para phen) = +1 (la carga del complejo) por lo que O.S. Cu = +1 o Cu +.
- Respuesta para [PtF 4 (NH 3) 2].
-
O.S. Pt + 4 x (-1) (para F -) + 0 x 2 (para NH 3) = +0 (la carga del complejo) así que O.S. Pt = +4 o Pt 4 +.
- Responder [Ni (en) 2] SO 4.
-
El complejo es [Ni (en) 2] + así O.S. Ni + 0 x 2 (para en) = +2 (la carga del complejo) así que O.S. Ni = +2 o Ni 2 +.
- Responder Co (acac) 3.
-
O.S. Co + 3 x (-1) (para acac; ver cuadro 9.2.2) = +0 (la carga del complejo) así que O.S. Co = +3 o Co 3 +.
- Contestar [MnCl (O) (salen)].
-
O.S. Mn + 1 x (-1) (para Cl -) + 1 x (-2) (para oxo) + 1 x (-2) (para salen; ver tabla 9.2.2) = +0 (la carga del complejo) así que O.S. Mn = +5 o Mn 5 +.
Dibuja estructuras que coincidan con las descripciones dadas, asumiendo que
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tenga un número de coordinación de cuatro serán tetraédricos
- mer -triaminaaqua- trans- diclorocobalto ion (III)
- \(\Delta\)-diaminebis (oxalato) manganato (III)
- [COCl 4] 2-
- trans-diamminobis (etilendiamina) Tetracyanopaladato de níquel (2+) (2-)
- \(\Lambda\)-bis (etilendiamina) cobalto (III) - μ-amido\(\Delta\) μ-hidroxi-bis (etilendiamina) cobalto (III)
- Contesta a. mer -triaminaaqua- trans- diclorocobalto ion (III).
-
- Respuesta b.\(\Delta\) -diaminebis (oxalato) manganato (III).
-
- Respuesta c. [CoCl 4] 2-.
-
- Respuesta d. trans -diamminebis (etilendiamina) Níquel (2+) tetracyanopaladato (2-).
-
Tenga en cuenta que como el Pd en [Pd (CN) 4] 2- es Pd 2 + será plano cuadrado.
- Respuesta e.\(\Lambda\) -bis (etilendiamina) cobalto (III) - μ-amido μ-hidroxo-\(\Delta\) -bis (etilendiamina) cobalto (III).
-
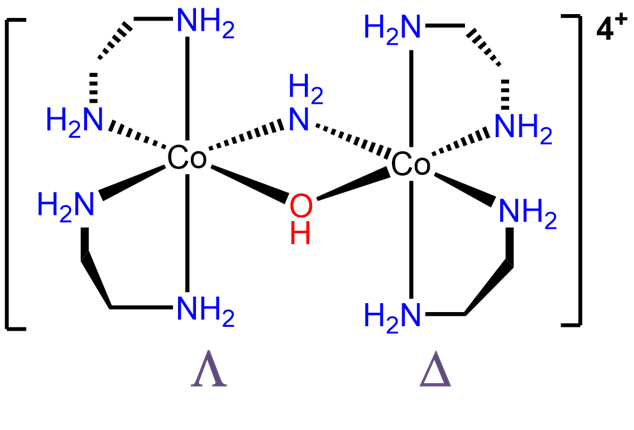 .
.
Dibujar todos los estereoisómeros de los siguientes complejos reales e hipotéticos. Usted puede asumir que
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tenga un número de coordinación de cuatro serán tetraédricos
- [IrCl (CO) (PPh 3) 2]
- [CoCl 3 (NH 3) 3]
- [CoCl 2 (H 2 O) 2 (NH 3) 2] +
- [CobrCl (H 2 O) 2 (NH 3) 2] +
- [CobrCLI (NH 3) 3]
- Contesta a. [IrCl (CO) (PPh 3) 2]
-
Se trata de un complejo Ir I de 4 coordenadas y, como tal, será plano cuadrado. Dado que dos de los ligandos son idénticos, tendrá isómeros cis y trans. El isómero trans es famoso por su capacidad para formar aductos y se llama complejo de Vaska.
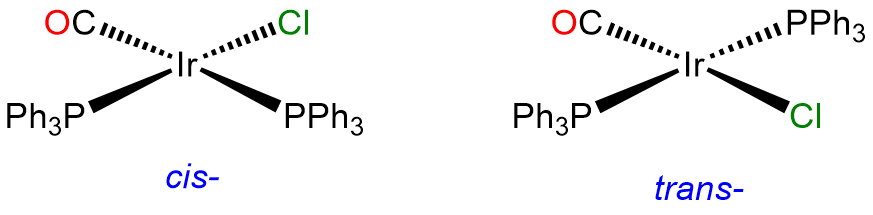
- Respuesta b. [CoCl 3 (NH 3) 3]
-
Este complejo contiene tres ligandos ammina y tres cloro y así tendrá isómeros fac y mer.
- Respuesta c. [CoCl 2 (H 2 O) 2 (NH 3) 2] +
-
Este es el caso de un sistema MA 2 B 2 C 2 (A = Cl -, B = H 2 O, C = NH 3) que involucra múltiples relaciones cis y trans. A continuación se muestran los seis estereoisómeros.
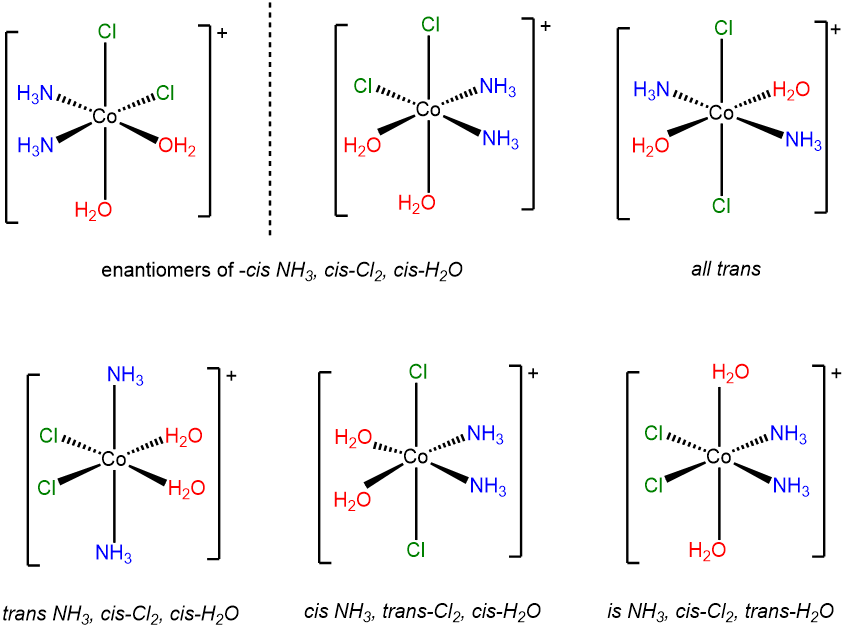
-
Dado que puede no ser obvio cómo llegar a un conjunto de isómeros como los anteriores, vale la pena considerar cómo se podría trabajar a través de las posibilidades de un sistema de ligandos como este. Se pueden utilizar varios sistemas para identificar sistemáticamente los isómeros. Una vez abordado es el sistema Macbdef descrito\(\sf{\PageIndex{1}}\) en Nota al final de estos ejercicios. Las soluciones aquí presentadas y en problemas posteriores emplean una variante de ese enfoque.
- Comience fijando un conjunto de ligandos. En este caso los ligandos de cloro se fijaron primero como cis entre sí. Entonces los ligandos restantes podrían ser cis o trans entre sí, aunque como los ligandos cloro ya son cis, los ligandos amina y aqua no pueden ser ambos trans al mismo tiempo. Así, para los ligandos cis cloro las posibilidades para los demás son:
- cis -H 2 O, cis -NH 3,
- cis- -H 2 O, trans -NH 3
- trans -H 2 O, cis- NH 3
- Intercambien la configuración del conjunto de ligandos con el que comenzaste. En este caso significa colocar los ligandos de cloro trans entre sí. A partir de esa configuración, las posibilidades para los ligandos amina y aqua son
- cis -H 2 O, cis -NH 3,
- trans -H 2 O, trans -NH 3
- Comprueba si hay enantiómeros y crea imágenes especulares de cualquier complejo quiral que dibujaste. La forma más fácil de hacerlo es asignando grupos de puntos. Sin embargo, resulta que el caso octaédrico all- cis es D 3 y formalmente equivalente a la simetría de un quelato tris, como se muestra a continuación.
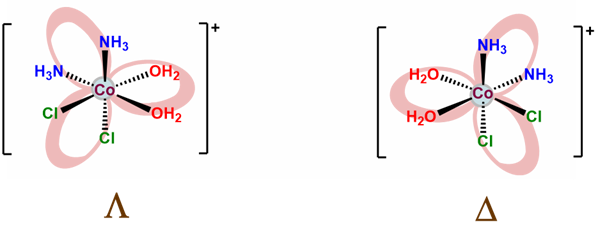
- finalmente, verifique para asegurarse de que no incluyó el mismo complejo dos veces. Los humanos cometen errores después de todo.
- Comience fijando un conjunto de ligandos. En este caso los ligandos de cloro se fijaron primero como cis entre sí. Entonces los ligandos restantes podrían ser cis o trans entre sí, aunque como los ligandos cloro ya son cis, los ligandos amina y aqua no pueden ser ambos trans al mismo tiempo. Así, para los ligandos cis cloro las posibilidades para los demás son:
- Respuesta d. [CobrCl (H 2 O) 2 (NH 3) 2] +
-
Este problema es análogo al anterior excepto que este complejo contiene un ligando bromo y cloro en lugar de los dos ligandos cloro en [COCl 2 (H 2 O) 2 (NH 3) 2] +. En consecuencia, cuando los ligandos bromo y cloro son cis entre sí, surgen posibilidades adicionales de isómeros en función de si los ligandos amina o aqua son trans al cloro y bromo. El resultado son ocho isómeros.
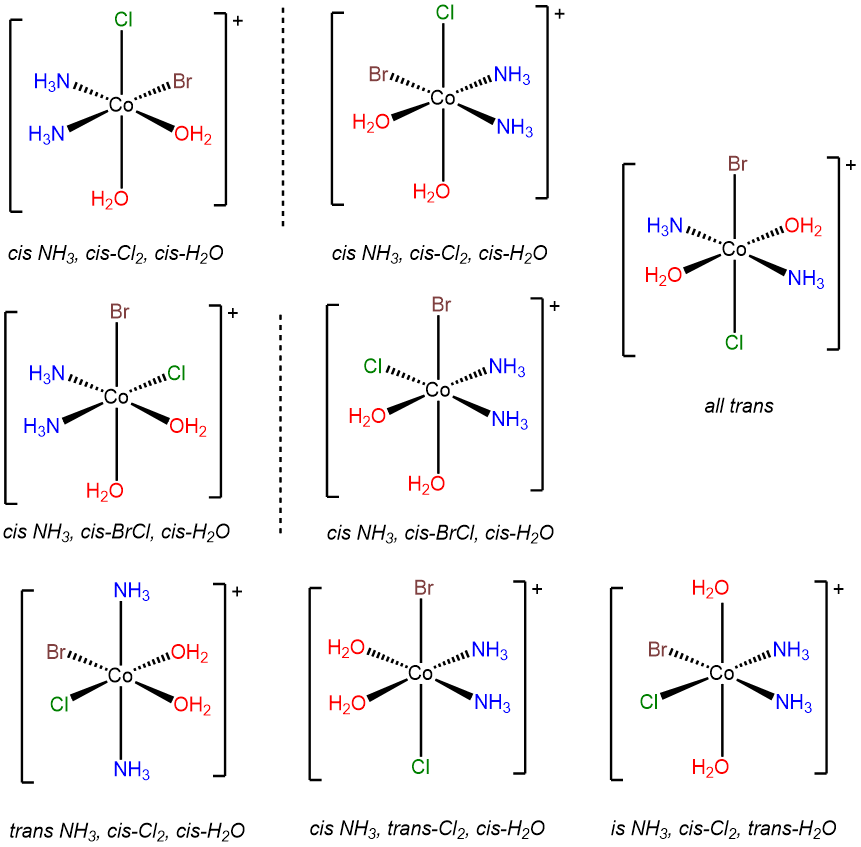
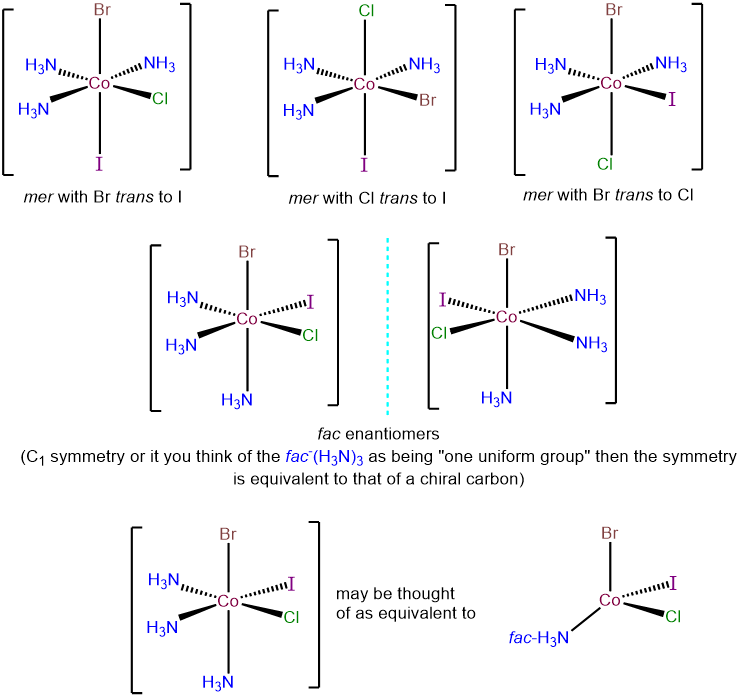
- Respuesta e. [CobrCLI (NH 3) 3]
-
Hay dos posibilidades para este complejo - un fac - (NH 3) 3 y un arreglo mer- (NH 3) 3. Estos pueden tomarse como puntos de partida para examinar las posibles permutaciones para los ligandos Cl -, Br - e I -. La fila superior presenta las tres posibilidades dentro del arreglo mer- (NH 3) 3; cada una corresponde a un ligando diferente trans a un ligando amina. La fila inferior presenta los dos posibles isómeros con arreglo fac - (NH 3) 3. En cada uno, los ligandos Cl -, Br - e I - son ligandos trans a aminos. Sin embargo, los complejos poseen simetría C1 y así son quirales y existen como enantiómeros.
Ignorando la torsión del anillo, dibuje todos los estereoisómeros de los siguientes complejos octaédricos reales e hipotéticos.
- [CobR 2 Cl 2 (es)] -
- [CobrCl (es) 2] +
- [CobrCl (gly) 2] -
- [Co (es) 3] 3+
- [Co (gly) 3]
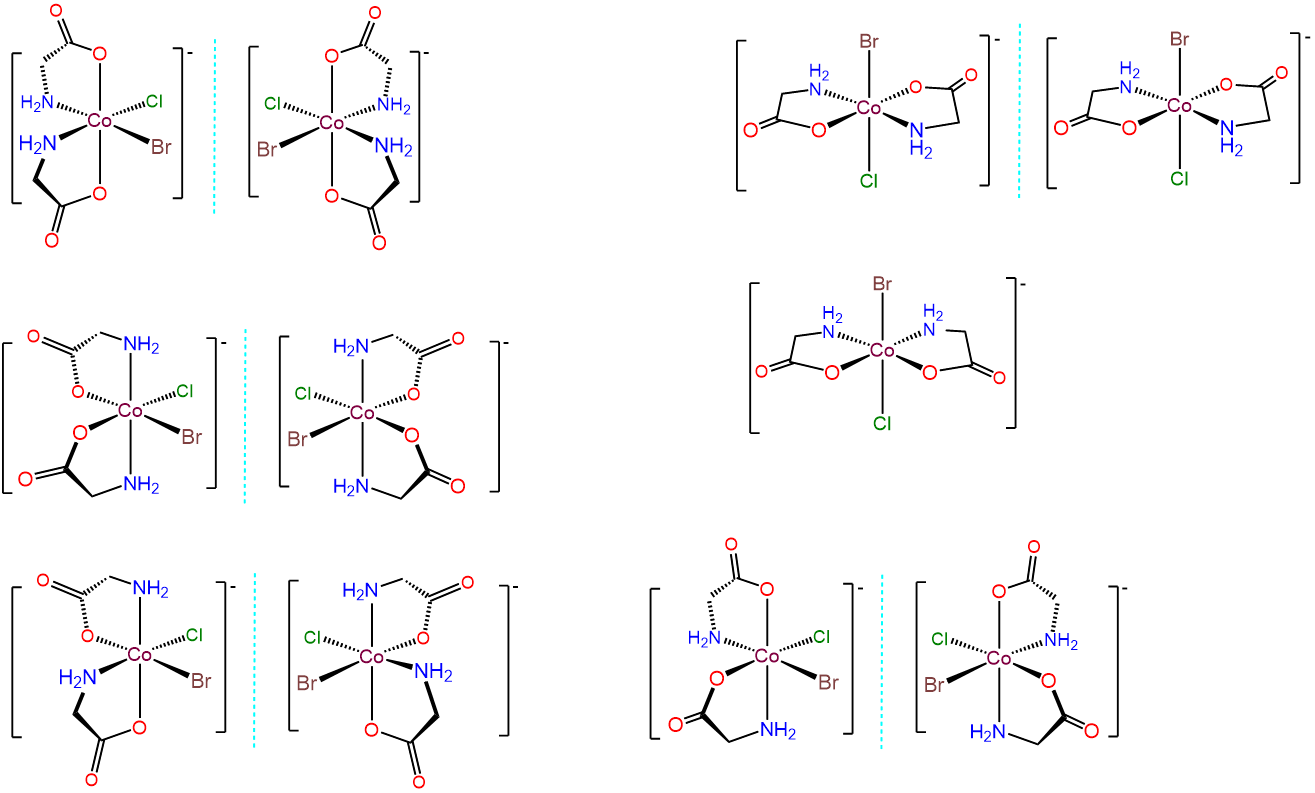
- Contestar a. [CobR 2 Cl 2 (es)] -
-
Este complejo es análogo a [CoCl 2 (H 2 O) 2 (NH 3) 2] + en poseer pares de grupos ligantes idénticos. La principal diferencia es que en [CobR 2 Cl 2 (en)] - los dos grupos ligantes de amina del ligando en están restringidos a una disposición cis. Bajo el sistema MABCDEF explicado en Note\(\PageIndex{1}\), [CoCl 2 (H 2 O) 2 (NH 3) 2] + puede ser MA 2 B 2 C 2, pero este complejo, [CobR 2 Cl 2 (en)] -, es M (AA) B 2 C 2. Los isómeros son:
- Respuesta b. [CobrCl (en) 2] +
-
La clave de problemas como este es enfocarse en los ligandos únicos, en este caso Br - y Cl -. Estos pueden existir ya sea en un arreglo cis o trans. La forma trans es aquiral, pero en el caso donde Br - y Cl - son cis,\(\Lambda\) y\(\Delta\) los enantiómeros son posibles. El resultado son tres isómeros.
- Respuesta c. [CobrCl (gly) 2] -
-
Este caso es análogo al anterior, pero esta vez el ligando bidentado, gly, posee sitios de unión distinguibles. Por lo tanto, hay permutaciones adicionales que implican cómo se unen los ligandos gly entre sí y/o si el extremo O o N del gly está unido trans a Br o Cl. El resultado son 11 isómeros diferentes, los cuales se dan a continuación.
- Respuesta d. [Co (en) 3] 3+
-
Como tris-quelato de ligandos bidentados simétricos, ignorando la torsión del anillo, [Co (en) 3] 3+ solo exhibirá\(\Lambda\) e\(\Delta\) isomería.
- Respuesta e. [Co (gly) 3]
-
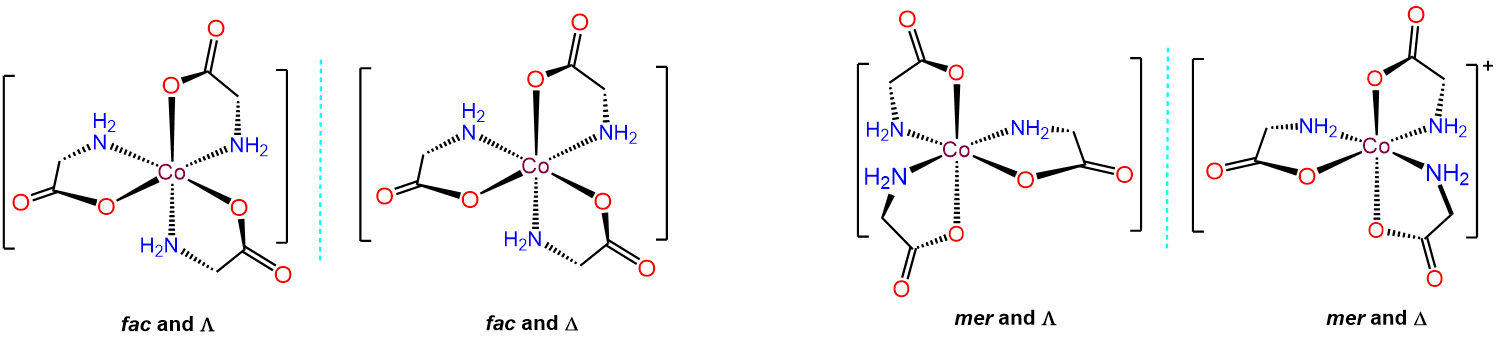
Dado que hay tres ligandos gly, cada uno de los cuales tiene extremos carboxi y amina, las disposiciones permisibles implican si los tres extremos carboxi y tres amina resultantes están orientados en una disposición mer o fac. Esto da dos posibilidades, cada una de las cuales puede existir ya sea como el\(\Lambda\)\(\Delta\) enantiómero, para un total de cuatro isómeros, que se dan a continuación.
Ignorando la torsión del anillo, dibuje todos los estereoisómeros químicamente razonables para los siguientes complejos reales e hipotéticos. Usted puede asumir que
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tenga un número de coordinación de cuatro serán tetraédricos
- [Pt (en) (SCN) 2]
- [Pt (NH 3) 2 (SCN) 2]
- [Co (es) 2 (SCN) 2] +
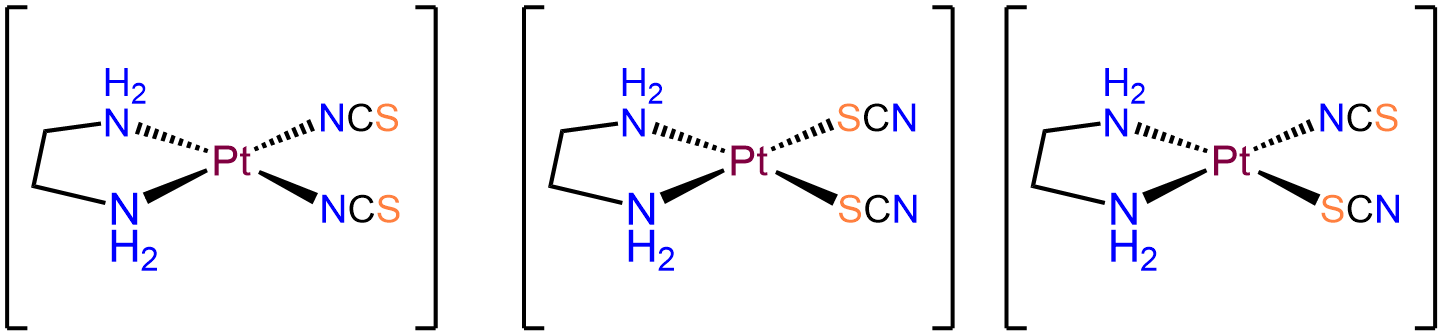
- Responder a. [Pt (en) (SCN) 2]
-
El Pt en este complejo neutro debe ser Pt 2 + para equilibrar las cargas negativas de los dos ligandos SCN. Los complejos de Pt 2 + son planos cuadrados y cuatro coordenados, consistentes con los ligandos bidentados en y dos tiocianato. De los ligandos, el ligando en debe unirse en una disposición cis. En consecuencia, los dos ligandos SCN también estarán en una disposición cis. Por lo tanto, los isómeros solo diferirán en si los dos SCN - se unen a\(\kappa\) N o\(\kappa\) S. Las posibilidades son:
- Respuesta b. [Pt (NH 3) 2 (SCN) 2]
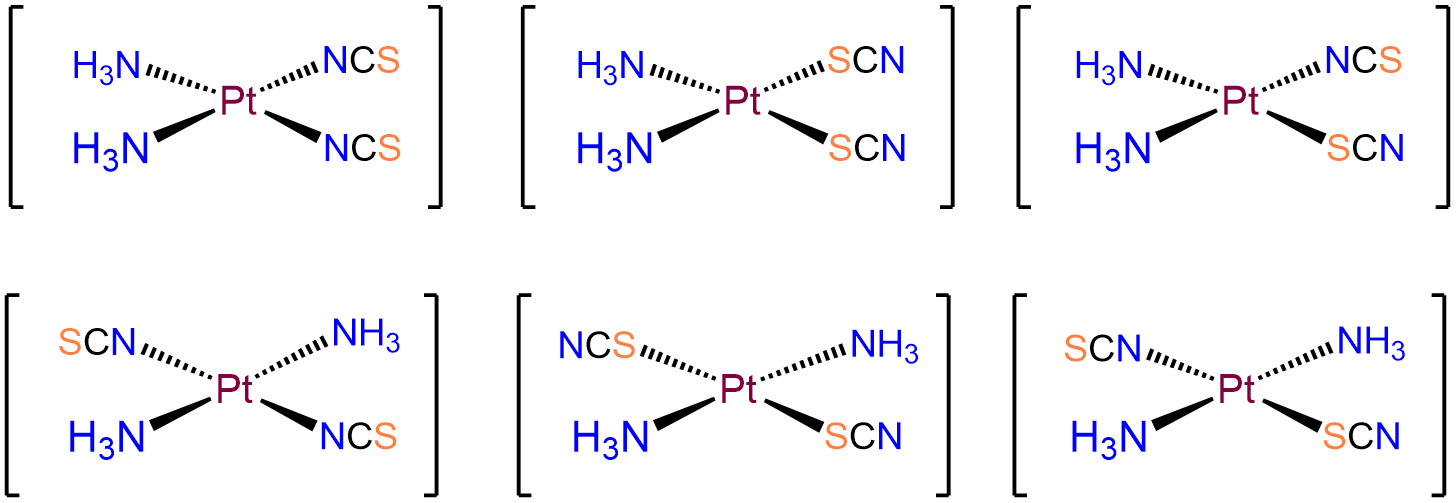
-
Al igual que con el ejemplo anterior, este será un complejo Pt 2 + plano cuadrado. La principal diferencia es que esta vez los nitrógenos coordinados no están obligados a adoptar un arreglo cis por lo que habrá isómeros tanto cis como trans.
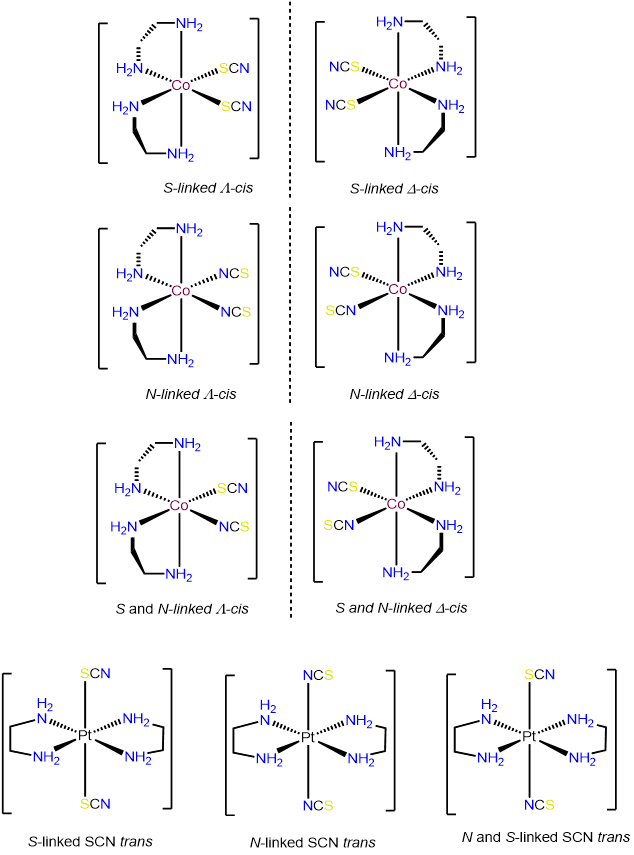
- Respuesta c. [Co (en) 2 (SCN) 2] +
-
Ignorando la torsión del anillo, dibuje todos los estereoisómeros químicamente razonables para los siguientes complejos reales e hipotéticos. Usted puede asumir que
- complejos en los que el metal tiene un número de coordinación de seis son octaédricos
- complejos en los que el metal tiene un número de coordinación de cinco son trigonales bipiramidales
- los complejos en los que Pt II, Pd II, o Rh I, o Ir I tienen un número de coordinación de cuatro son planos cuadrados
- otros complejos en los que el metal tenga un número de coordinación de cuatro serán tetraédricos
- [Ru (bpy) (phen) (dppe)] 2+
- [CoCLF (PPh 3) (py)] -
- [Ni (es) 2 (NO 2) 2]
- [Fe (H 2 O) 3 (SCN) 3]
- [PtClF (PPh 3) (py)]
- [CobR 2 Cl (NH 3) 3]
- Responde a. [Ru (bpy) (phen) (dppe)] 2+
-
Este complejo es un tris-quelato octaédrico que contiene ligandos simétricos. Como tal exhibirá\(\Lambda\) e\(\Delta\) isómeros:
- Respuesta b. [CoCLF (PPh 3) (py)] -
-
Este complejo tiene un número de coordinación de 4 y contiene un ion Co 2 + con una configuración de electrones d 7, por lo que se espera una geometría tetraédrica. Los complejos tetraédricos como este con cuatro ligandos diferentes son quirales y pueden formar enantiómeros R y S.
- Respuesta c. [Ni (en) 2 (NO 2) 2]
-
Este es un bis-quelato octaédrico y existirá en\(\Lambda\) y\(\Delta\) configuraciones. Dentro de cada configuración los ligandos NO 2 pueden existir como\(\kappa\) N y\(\kappa\) O, dando lugar a las siguientes posibilidades:
- Respuesta d. [Fe (H 2 O) 3 (SCN) 3]
-
Como complejo octaédrico con tres ligandos idénticos, puede existir en configuraciones mer y fac, proporcionando el ligando SCN ambidentado posibilidades adicionales de isomería.
- Respuesta e. [PtClF (PPh 3) (py)]
-
Como un complejo plano cuadrado con cuatro ligandos no idénticos, este complejo existe como un solo isómero.
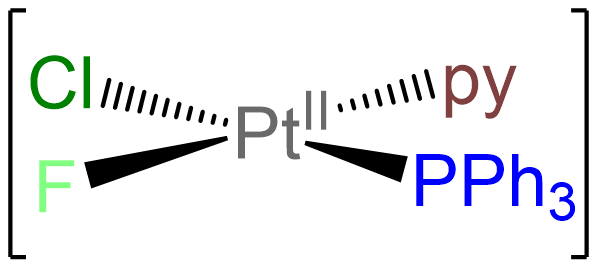
- Respuesta f. [CobR 2 Cl (NH 3) 3]
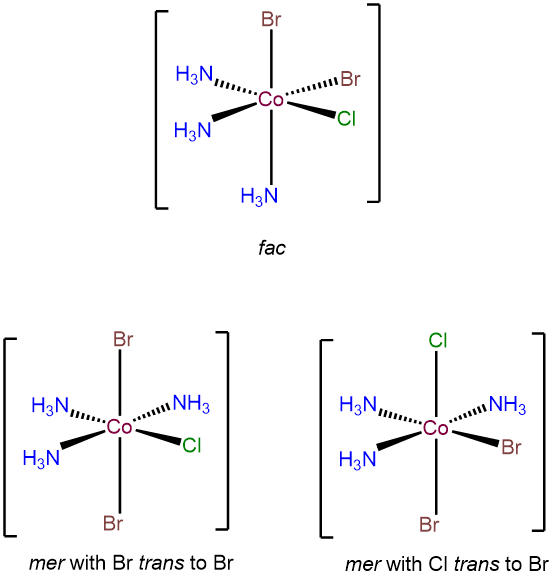
-
Como complejo octaédrico con tres ligandos idénticos, exhibirá isomería mer y fac. Además, tendrá dos configuraciones mer que difieren en términos de las relaciones cis y trans entre los ligandos bromo y cloro.
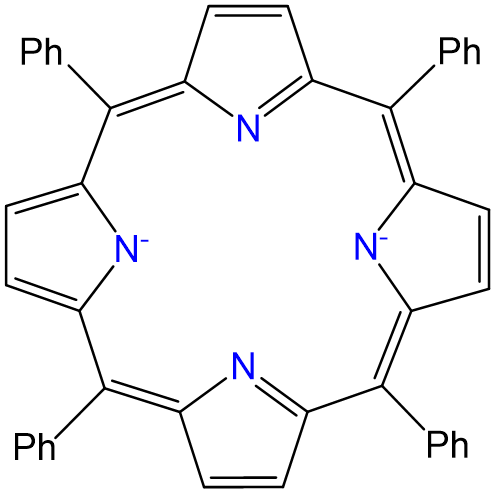
Se han preparado complejos de fórmula Ru (TPP) py 2, en los que TPP es tetrafenilporfirina, la cual une metales en la forma que se indica a continuación. Dibujar todos los isómeros de Ru (TPP) py 2.
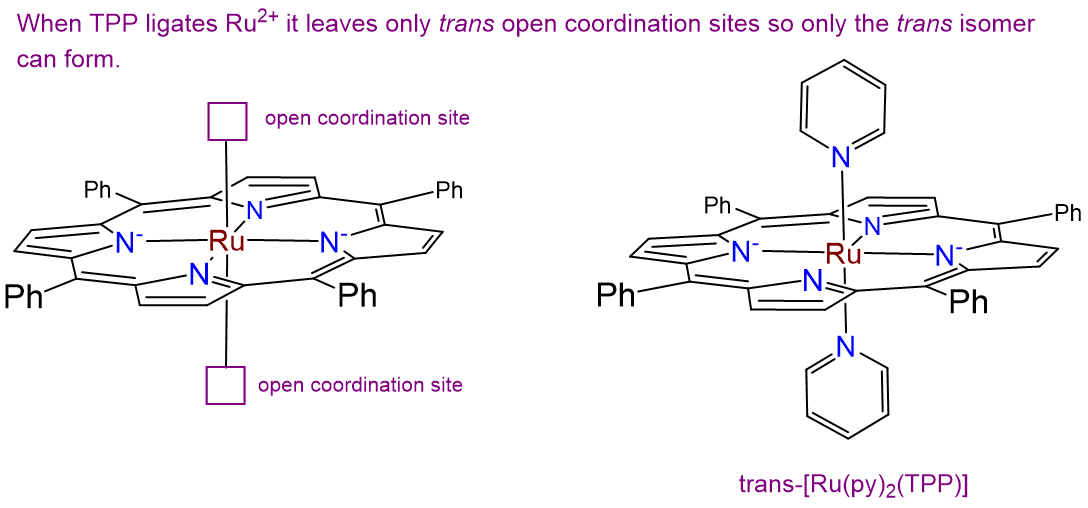
- Contestar
-
Sólo hay un isómero. Si bien normalmente los complejos que contienen dos ligandos idénticos (en este caso py) pueden exhibir isomería cis y trans, en este caso el anillo plano de tetrafenilporfirina liga el ion Ru 2 + en una disposición plana cuadrada, como se muestra a la izquierda en la imagen de abajo. Esto deja solo un par de sitios de coordinación trans para que los ligandos de cloro ocupen, dando el isómero que se muestra a la derecha abajo.
Dibujar los diastereómeros formados debido a la quiralidad de los átomos de nitrógeno de amina en [PtCl 2 (N, N'-dimetiletano-1,2-diamina)] que tiene la conectividad atómica representada a continuación
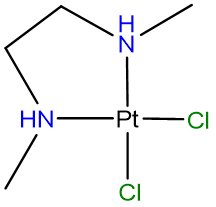
- Contestar
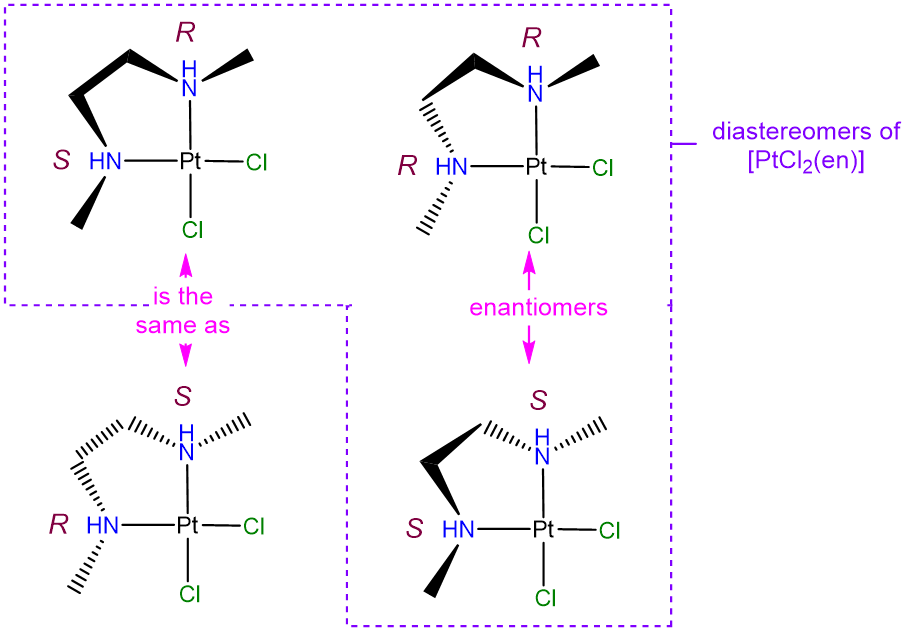
-
Los diastereómeros diferirán en si los átomos de N adoptan una configuración R o S en los átomos de nitrógeno. Las posibles permutaciones son (R, R), (S, S), (R, S) y (S, R). Sin embargo, como puede verse en la imagen de abajo, las configuraciones (R, S) y (S, R) son idénticas (las dos proyecciones mostradas pueden ser interconvertidas a través de una rotación C2 a lo largo de un eje que biseca la unidad Cl-Pt-Cl). Como resultado solo hay tres isómeros únicos. De estos, las configuraciones (R, R) y (S, S) son enantiómeros (son imágenes especulares por reflexión en el plano PtcL 2 N 2). Tenga en cuenta que para resolver problemas como este puede ser útil realizar un seguimiento de los posibles isómeros asignando la estereoquímica en cada centro quiral como R o S usando la convención CAHN-Inold Prelog, aunque no es estrictamente necesario hacerlo.
Marque las conformaciones de todos los anillos de quelato en la estructura a continuación.
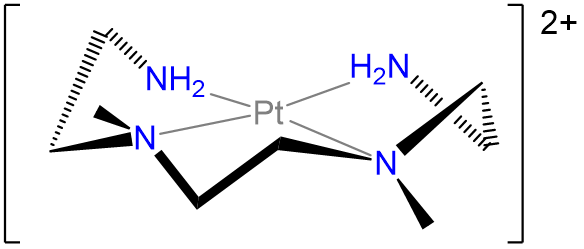
- Contestar
-
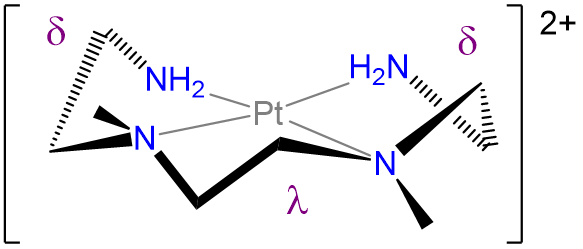 .
.
Apéndice: El sistema de contabilidad MABCDEF para identificar isómeros
El sistema Mabcdef o MABCDEF es un método para identificar el número de isómeros en un complejo octaédrico, aunque como en realidad es solo un sistema de contabilidad y organización, también se puede extender fácilmente a otras geometrías. La M en Mabcdef significa metal y las otras letras se utilizan para representar ligandos. El enfoque básico implica
- clasificar los ligandos como A, B, C, D, E o F en orden de multiplicidad. Por lo tanto para
[Cr (NH 3) 6] 3+ A = NH 3; no hay ligandos B, C, D, E o F; y el complejo se clasifica como MA 6
[CoCl (NH 3) 5] 2+ A = NH 3, B = Cl -, y el complejo es MA 5 B
[CrCl 2 (H 2 O) 2 (NH 3) 2] + A = Cl -, B = H 2 O, C = NH 3, y el complejo es MA 2 B 2 C 2
- en la clasificación anterior, los ligandos multidentados se clasifican típicamente antes que los monodentados y se designan AA, AB, ABC, ABA, etc. basándose en la simetría de los puntos de unión. Por lo tanto
en tiene puntos de amina de unión idénticos y es AA
gly tiene puntos de unión de carboxi y amina y es AB
trien es ABA
CoCl 2 (es) 2 + es M (AA) 2 B 2
CoCl 2 (gly) 2 - es M (AB) 2 C 2
CoCl 2 (en) (gly) es M (AA) (AB) C 2
- Enumerar sistemáticamente las posibles disposiciones trans de los ligandos mediante
- asignar un par de ligandos para que sean trans entre sí.
- Luego, enumere sistemáticamente los otros posibles pares trans permutando los arreglos trans restantes. Puede ayudar a organizar las permutaciones en una tabla, como la que se muestra a continuación para un complejo MABCDEF donde A y B se asignan trans. Al mirar la mesa, observe cómo se varía sistemáticamente el segundo conjunto de permutaciones trans. Esto ayuda a garantizar que no se omita ninguna posibilidad.
- Atraviesa la lista de isómeros y elimina los duplicados que hayas generado hasta ahora. Por ejemplo, observe en la siguiente tabla que los tres últimos estereoisómeros son idénticos a los tres primeros (por ejemplo, el estereoisómero 4 es idéntico al estereoisómero 3, 5 con 2 y 6 con 1).
| Estereoisómero 1 | Estereoisómero 2 | Estereoisómero 3 |
Estereoisómero 4 (igual que el isómero 3) |
Estereoisómero 5 (igual que el isómero 2) |
Estereoisómero 6 (igual que el isómero 1) |
| trans AB (fijo) | trans AB (fijo) | trans AB (fijo) | trans AB (fijo) | trans AB (fijo) | trans AB (fijo) |
| trans | trans CE | trans CF | trans | trans DF | trans EF |
| trans EF | trans DF | trans | trans CF | trans CE | trans |
- Si el complejo posee ligandos multidentados que exigen que existan ciertos grupos y pares cis, entonces también elimina cualquier configuración que no esté de acuerdo con la capacidad de unión conocida del ligando (por ejemplo, los dos grupos amina de etilendiamina no pueden ser trans a uno. otro, así que si tienes un ligando en, elimina configuraciones como esa de la lista).
- A continuación, intercambia o permuta el par trans original y repite el proceso que acabas de seguir. En el caso de Mabcdef esto da los siguientes resultados:
| Isómero | Trans par “fijo” | Pares trans adicionales | |
| 1 | AB | CD | EF |
| 2 | AB | CE | DF |
| 3 | AB | CF | DE |
| 4 | AC | BD | EF |
| 5 | AC | SER | BF |
| 6 | AC | BF | DE |
| 7 | ANUNCIO | BC | EF |
| 8 | ANUNCIO | SER | CF |
| 9 | ANUNCIO | BF | CE |
| 10 | AE | BC | DF |
| 11 | AE | BD | CF |
| 12 | AE | BF | CD |
| 13 | AF | BC | DE |
| 14 | AF | BD | CE |
| 15 | AF | SER | CD |
- Dado que el procedimiento explicado anteriormente solo identifica isómeros basados en emparejamientos trans únicos, no identifica cuándo una configuración es quiral y corresponde a un par de enantiómeros. Cualquier enantiómero se puede identificar dibujando los complejos y bien clasificando sus grupos puntuales o dibujando sus imágenes especulares y comprobando si son superponibles. En el caso MABCDEF -es decir, donde todos los ligandos son diferentes- todos los isómeros identificados tienen simetría C1 por lo que son quirales. Esto significa que habrá un par de enantiómeros para cada uno, dando 15 x 2 = 30 estereoisómeros diferentes.
Referencias
1. Estos ejemplos están tomados de http://wwwchem.uwimona.edu.jm/courses/inorgnom.html
2. Conakes S. M.; Rauchfuss, T.B. Chem. Commun. 2001, 553-554.
3. Shriver, D. F.; Shriver, S. A.; Anderson, S. E., Inorg. Chem. 1965, 4 (5), 725-730.
4. Zelewsky, A. v., Estereoquímica de los compuestos de coordinación Wiley, 1996.
5. En el pasado era difícil determinar configuraciones absolutas solo a partir de datos de rayos X, pero los recientes avances han facilitado hacerlo.
6. Pavan M. V. Raja & Andrew R. Barron “Espectroscopia de Dicroísmo Circular y su Aplicación para la Determinación de la Estructura Secundaria de Especies Ópticamente Activas” en Métodos Físicos en Química y Nano Ciencia https://chem.libretexts.org/Bookshelves/Analytical_Chemistry/Book%3A_Physical _Métodos_en_química_y_nano_ciencia_ (Barron)/07% 3A_molecular_y_estado_solid_estructura/ 7.07% 3a_circular_dicroism_espectroscopy_and_su_aplication_for_determination_of_secondary_structure_of_optically_active_species
7. Berova, N.; Bari, L. D.; Pescitelli, G., Chemical Society Reviews 2007, 36 (6), 914-931.
8. Por supuesto, si un conjunto de ligandos ocupa un plano meridional, entonces los otros tres ligandos se orientarán en uno ecuatorial. La razón por la que ambos pueden ser considerados meridionales es porque si se rotara el complejo, el plano ecuatorial sería meridional y viceversa. Desde ese punto de vista ambos podrían considerarse planos meridionales -aunque no al mismo tiempo-.
9. Los ángulos de mordida se toman de Mansell, S. M., Aplicaciones catalíticas de ligandos difósforo de ángulo de mordida pequeños con conectores de un solo átomo. Dalton Transacciones 2017, 46 (44), 15157-15174.
10. Hancock, R. D., The pyridyl group in ligand design for selective metal ion complexation and sensing. Chemical Society Opiniones 2013, 42 (4), 1500-1524.
11. Sasi, D.; Ramkumar, V.; Murthy, N. N., Geometrías de coordinación reguladas por ángulo de mordida: Tetraédrico y Trigonal Bipiramidal en Ni (II) con Ligandos N, N'-Bidentados de Bifenil-Anexos (2-Piridil) alquilamina. ACS Omega 2017, 2 (6), 2474-2481.
12. Ehnbom, A.; Ghosh, S. K.; Lewis, K. G.; Gladysz, J. A., Octahedral Werner complejos con ligandos de etilendiamina sustituidos: un cebador estereoquímico para una serie histórica de compuestos que ahora emergen como una familia moderna de catalizadores. Opiniones sobre Chemical Society 2016, 45 (24), 6799-6811.

