9.5: Números y estructuras de coordinación
- Page ID
- 81557
¿Por qué los complejos de coordinación forman las estructuras que hacen?
Al igual que con todas las estructuras químicas, los complejos de coordinación forman las estructuras que hacen para estabilizar mejor el centro metálico y los ligandos a través de la formación de enlaces metal-ligando evitando interacciones desestabilizadoras como repulsiones estéricas. El problema entonces es cuántos enlaces metal-ligando deben formarse y cómo esos enlaces deben organizarse espacialmente para dar la mayor estabilización neta posible. Esta pregunta eventualmente será considerada en detalle en relación con la naturaleza de la unión en los compuestos de coordinación. Por ahora, será útil pensarlo en términos de siete factores:
El efecto estabilizador de la formación de enlaces metal-ligando.
La fuerza impulsora para la formación de complejos es la estabilización de electrones en enlaces químicos covalentes. En la gran mayoría de los casos, esto implica en gran medida la estabilización del par solitario del ligando ya que experimenta la carga nuclear efectiva del metal, aunque algunos casos implican la estabilización de electrones metálicos por núcleos de ligando (campos de ligando inversos). Independientemente, la formación de enlaces metal-ligando se estabiliza y se clasifica por la forma en que prefiere la adición de ligandos al complejo.
Efectos estéricos, específicamente repulsiones estéricas entre ligandos.
Una razón por la que los números de coordinación no aumentan indefinidamente es que solo tantos ligandos pueden caber alrededor de un metal. Exactamente cuántos depende de
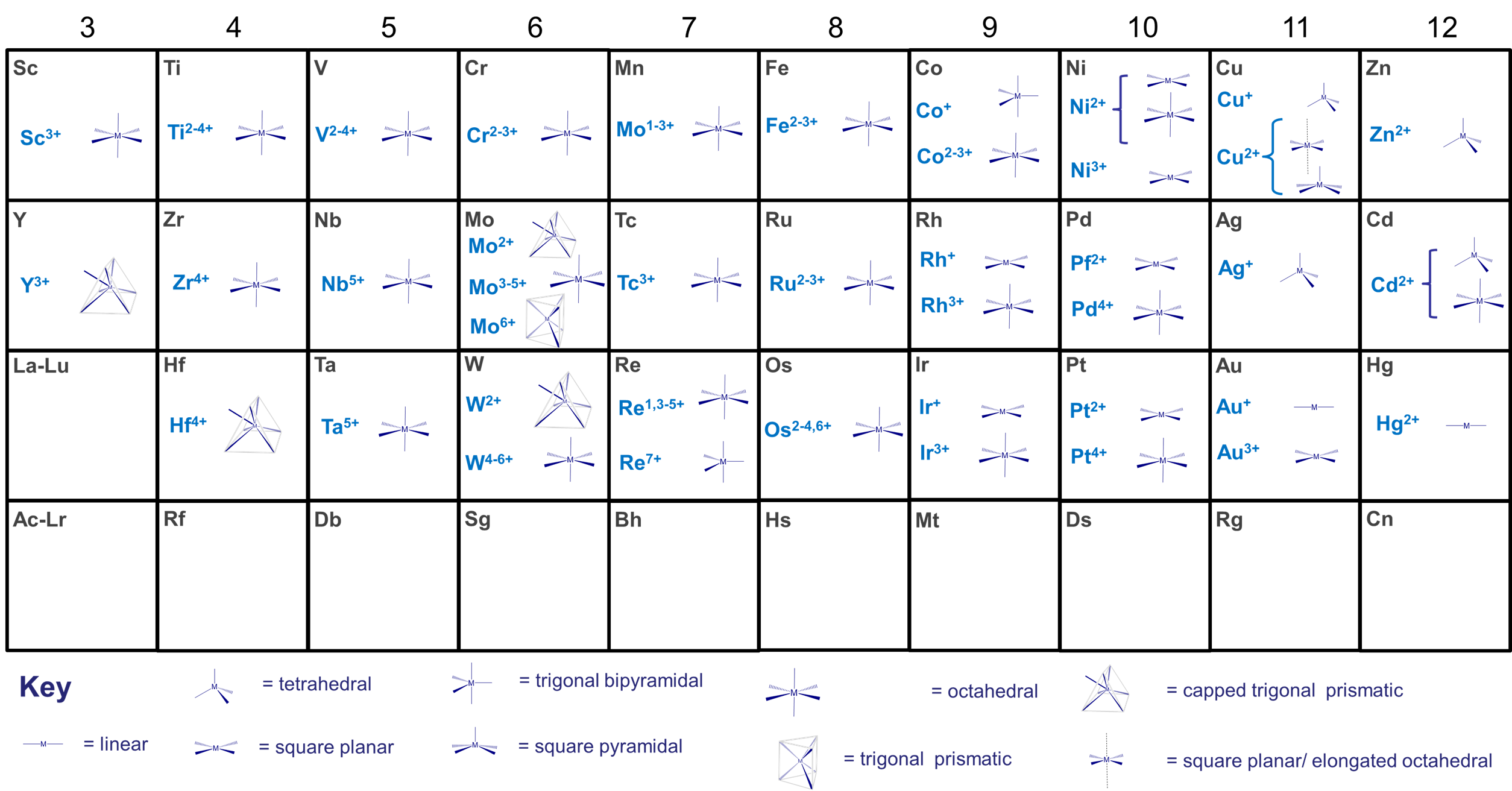
- el tamaño del centro metálico. Este es uno de los factores más importantes. Muchos metales tienden a exhibir números de coordinación preferidos, los cuales dependen de su estado de oxidación y tamaño como se muestra en la Figura\(\sf{\PageIndex{1}}\). Los metales de transición internos más grandes como los lantánidos y actínidos pueden acomodar 9-12 ligandos estéricamente poco exigentes, mientras que los metales de transición más pequeños tienden a acomodar hasta seis, aunque los números de coordinación más grandes son más comunes para los metales de baja valencia y a medida que aumenta el tamaño al moverse de derecha a izquierda a través del bloque de metal de transición de la tabla periódica. Así, el molibdeno de metal de transición temprano forma siete y ocho coordenadas [Mo III (CN) 7] 4- y [Mo IV (CN) 8] 4- con el ligando ciano estéricamente poco exigente.
- el tamaño de los ligandos. Mientras los ligandos no sean excesivamente rígidos y voluminosos, su tamaño es menos importante que el tamaño del metal para determinar el número de ligandos que coordinan. La capacidad de los ligandos para donar electrones al centro metálico también tiende a influir en el número de coordinación más que en el tamaño del ligando. Sin embargo, siendo todas las demás cosas iguales para un metal dado y una capacidad donante de ligando, los ligandos pequeños permiten números de coordinación más altos mientras que menos ligandos voluminosos encajarán alrededor del centro del metal.
- cómo el ligando se une al metal. Nuevamente, siendo iguales todas las demás cosas, los ligandos que son más estéricamente exigentes en las proximidades del centro metálico tienden a limitar la capacidad de otros ligandos para unirse más que aquellos que se unen a través de un pequeño grupo extendido. Por ejemplo, un isocianuro voluminoso como t-BuCN amontonará estéricamente el metal menos de lo que lo haría una fosfina voluminosa como t-BuH 2 P. Por esta razón, el tamaño efectivo de un ligando a veces se clasifica en términos de un ángulo de cono del espacio que se estima que ocupan alrededor del metal (llamado ángulo de cono Tolman, se usa comúnmente para evaluar el volumen estérico de las fosfinas) o en términos del porcentaje de la esfera de coordinación del metal el ligando ocupa (llamado el porcentaje de volumen enterrado, se utiliza para estimar el impacto estérico de N -heterocíclicos carbenos).
Repulsión entre electrones de unión M-L en diferentes ligandos.
Para muchos complejos, los efectos estéricos no son ni los únicos efectos ni los más importantes. Entre los factores adicionales que se deben considerar están las repulsiones que ocurren entre los electrones que diferentes ligandos donan al enlace metal-ligando. Estas repulsiones electrón-electrón afectan a la
- Número de coordinación. Cuando un ligando dona sus electrones a un centro metálico para formar un nuevo enlace metal-ligando, la densidad de electrones alrededor del metal aumenta, elevando la energía general de los otros electrones de enlace M-L. Esta mayor repulsión a menudo limita el número de ligandos coordinados. A medida que se agregan más ligandos, las repulsiones electrón-electrón siguen aumentando hasta que la disminución de la energía de los electrones ligandos en el nuevo enlace es insuficiente para compensar el aumento de energía de los electrones de enlace M-L existentes. Con base únicamente en este efecto,
- los metales más grandes tienden a lograr números de coordinación más altos que los más pequeños porque las repulsiones electrón-electrón se extienden a través de una esfera de coordinación más grande.
- Con un metal dado, los ligandos que son más donadores de electrones tienen una mayor tendencia a formar complejos con menores números de coordinación con un metal dado que los neutros similares. Esta es la razón por la que los ligandos aniónicos (que tienden a ser mejores donantes de electrones) tienden a dar números de coordinación más bajos que los ligandos neutros comparables (que tienden a ser donantes más débiles). Así, Co 2 + forma CoCl 4 2 - con ligandos de cloro pero [Co (H 2 O) 6] 2+ con ligandos aqua.
- Geometría de coordinación. En el modelo Kepert para las formas de los complejos de coordinación, esta repulsión intraliganda determina la geometría de coordinación más estable al hacer que los ligandos se alejen lo más posible entre sí en la esfera de coordinación del metal.
Formalmente, según el modelo Kepert
- cualquiera de los electrones de valencia del metal no involucrados en los enlaces metal-ligando ocupan orbitales (n-1) d y funcionan como electrones centrales. Como electrones centrales no influyen en la forma molecular.
- los electrones involucrados en la unión a un ligando dado constituyen un grupo de electrones que repele a todos los demás grupos de electrones alrededor del metal.
- siendo iguales todas las demás cosas, el complejo formará la geometría que maximiza las repulsiones del grupo intra-electrón.
Observe las similitudes de estos postulados con los de la teoría VSEPR. Al predecir geometrías de coordinación en términos de repulsiones electrón-electrón, el modelo Kepert es solo una extensión de la teoría VSEPR a los compuestos de coordinación. La diferencia entre la teoría VSEPR y el modelo de Kepert es que en el modelo Kepert, solo cuentan los electrones involucrados en los enlaces metal-ligando.
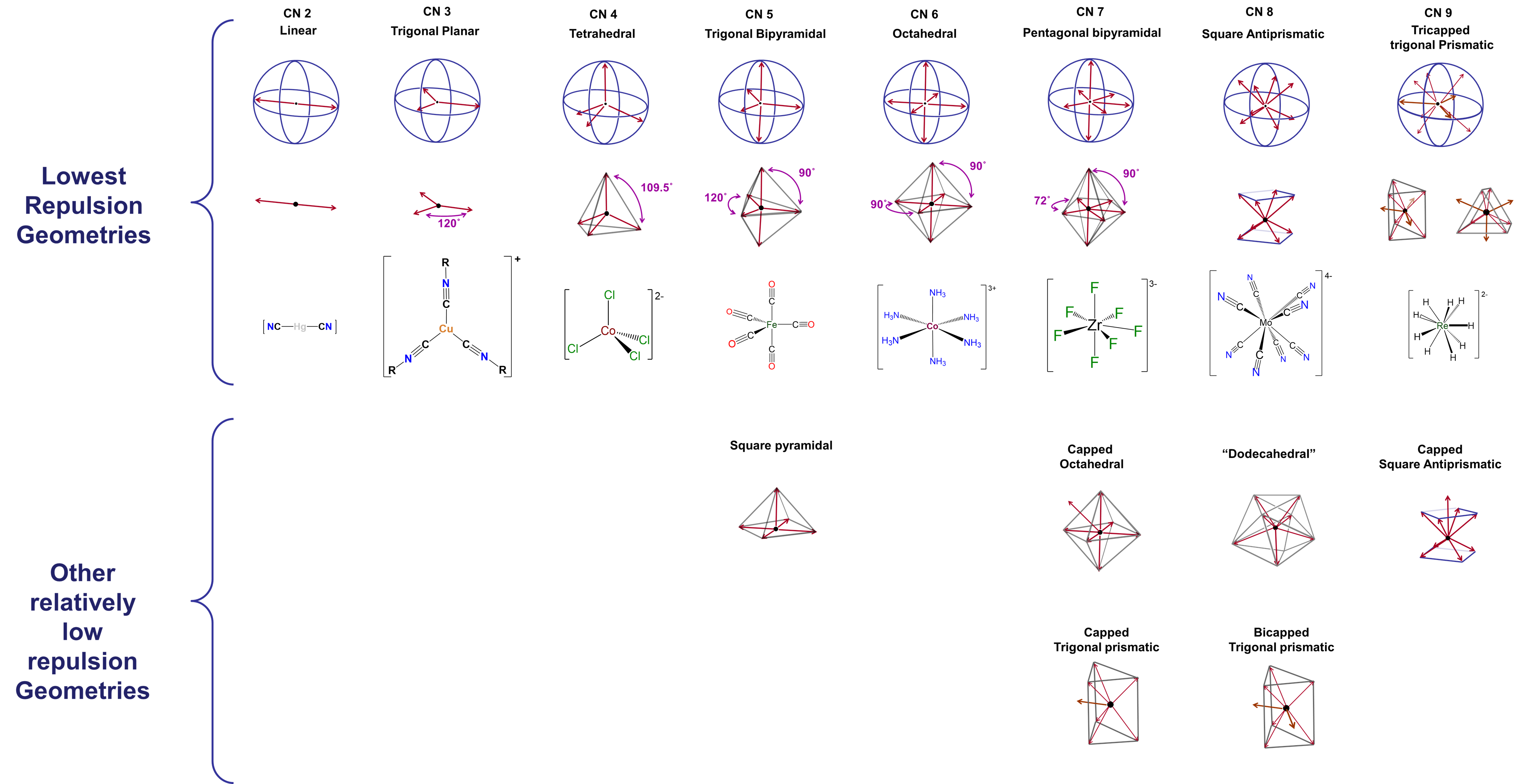
Las geometrías de coordinación predichas por el modelo Kepert para los números de coordinación del dos al nueve se dan en la Figura\(\sf{\PageIndex{2}}\). Como puede verse a partir de las geometrías listadas en la Figura\(\sf{\PageIndex{2}}\), éstas son apenas equivalentes a geometrías VSEPR para casos en los que el número de grupos de electrones es igual al número de coordinación.
La diferencia entre las geometrías de coordinación óptima y subóptima es mayor con pocos ligandos, y se vuelve más pequeña a medida que los ligandos se dispersan cada vez más en la esfera de coordinación del metal. En los complejos que contienen cinco, siete, ocho o metales de coordenadas superiores, hay una serie de geometrías que son similares en energía a la geometría preferida. Estas geometrías, que deben considerarse accesibles, también se enumeran en la Figura\(\sf{\PageIndex{2}}\).
efectos d-electrón
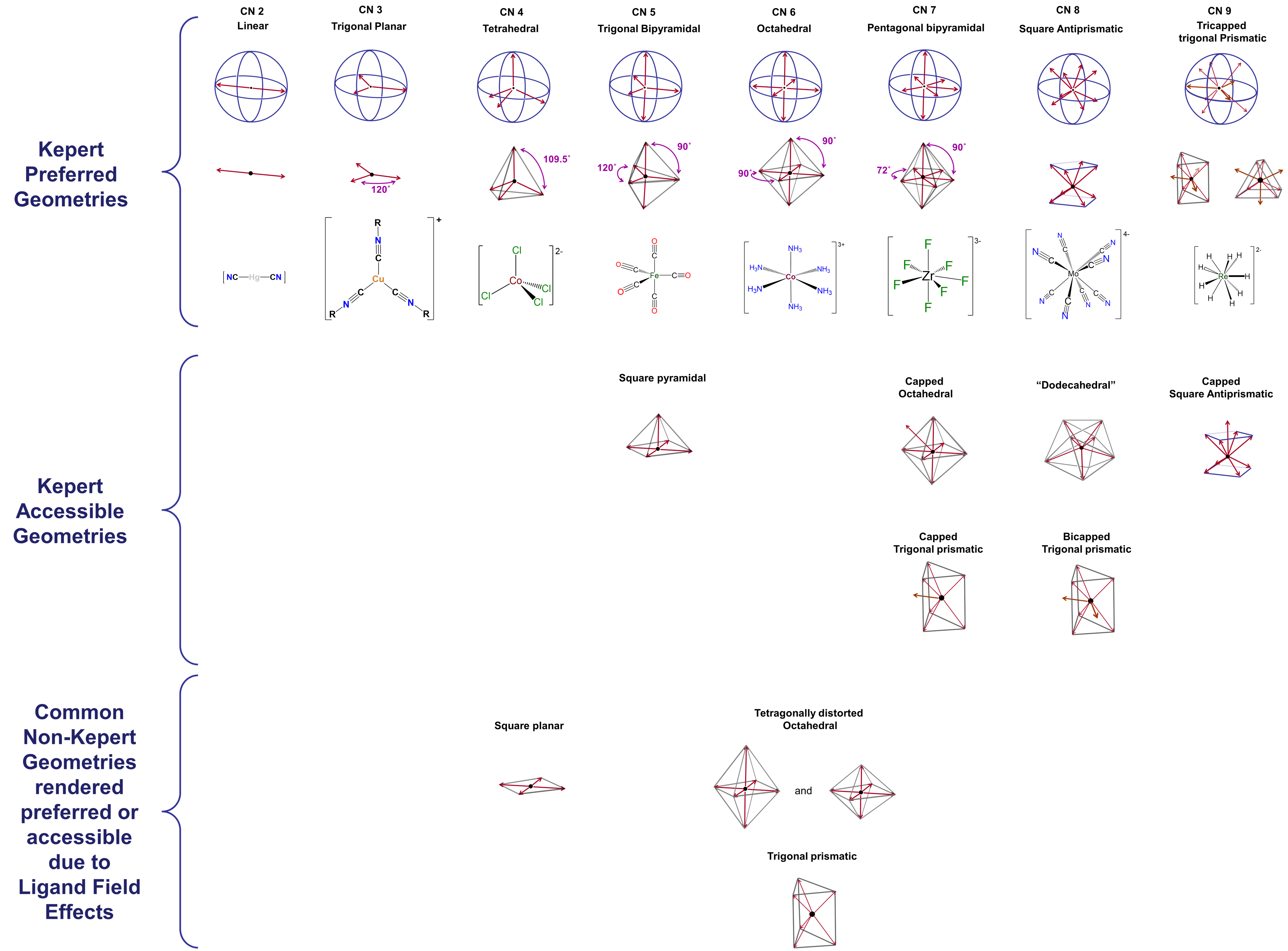
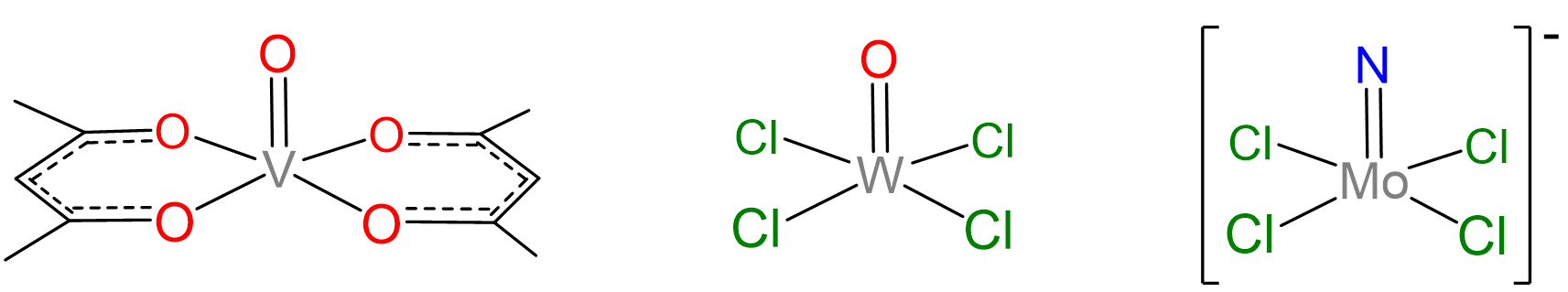
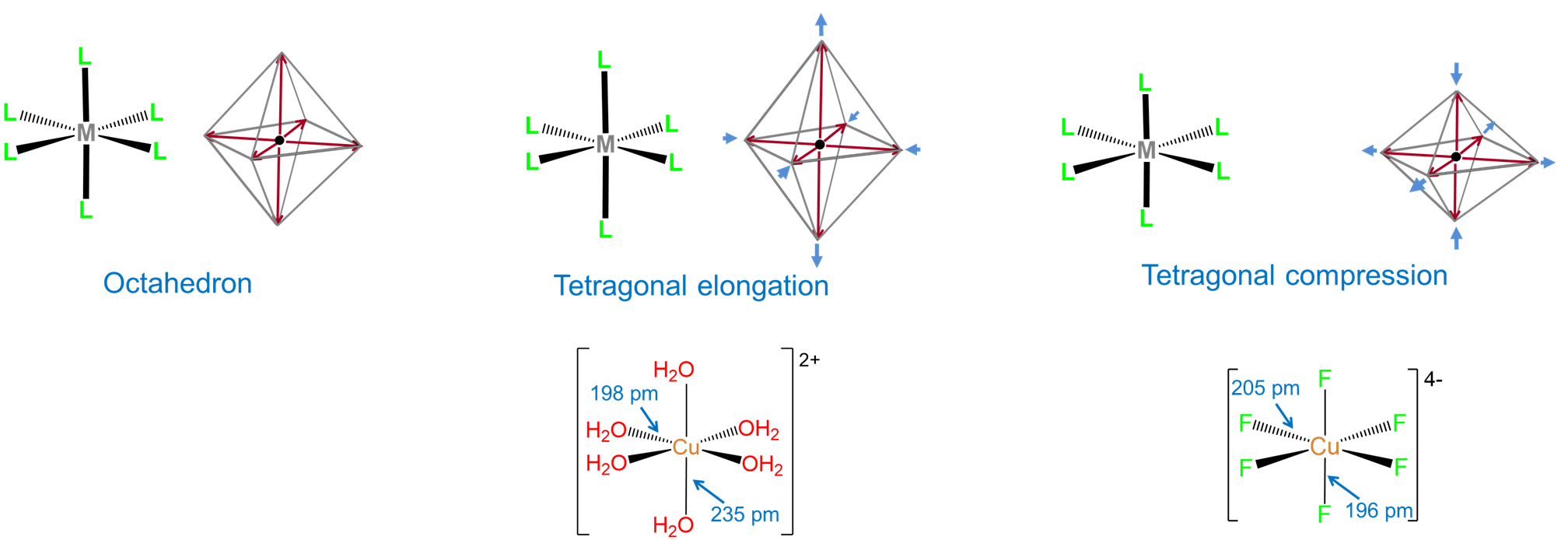
Algunas geometrías de coordinación están notablemente ausentes de las geometrías preferidas por Kepert y accesibles a Kepert en la Figura\(\sf{\PageIndex{1}}\). Estas incluyen las geometrías prismáticas trigonales formadas por compuestos como W (CH 3) 6 y la geometría plana cuadrada muy común ilustrada por complejos como [PtcL 4] 2- y [IRClH (PPh 3) 2]. Una de las razones por las que el modelo Kepert no logra predecir la existencia de tales estructuras es su descuido de las interacciones direccionales que involucran d electrones en el centro metálico. Los electrones de metal d ejercen una profunda influencia en casi todas las propiedades de los complejos de metales de transición, incluidas sus estructuras. La forma en que esto ocurre se explorará extensamente en el próximo capítulo. Por ahora, basta señalar que tanto los electrones donados por ligando que rodean un centro metálico como los electrones que ocupan determinados orbitales d sobre ese metal están orientados en direcciones específicas entre sí. Debido a esto, la fuerza de las interacciones entre el ligando y los electrones d metálicos depende del número de electrones d presentes, cuán fuertemente la unión metal-ligando afecta su energía y cómo los ligandos están dispuestos alrededor del centro metálico. El impacto de estos efectos, aquí denominados efectos de campo de ligandos, difiere de un caso a otro y puede incluir
- distorsiones de la geometría del complejo. Por ejemplo, una geoemtría de coordinación octaédrica ideal podría distorsionarse tetragonalmente al aplanarla o alargarla.
- impartiendo una fuerte preferencia por geometrías de coordinación no Kepert. Es por ello que, por ejemplo, los complejos de 2ª y 3ª fila en los que el metal tiene una configuración de electrones d 8 son casi siempre planos cuadrados.
- estabilizar geometrías no Kepert lo suficiente como para permitir que los complejos las adopten en presencia de un ligando rígido o semirrígido que prefiera coordinar el metal en esa geometría. 3
Debido a estos efectos, también se observan geometrías prismáticas planas cuadradas y trigonales, y la lista de geometrías de coordinación dada en la Figura\(\sf{\PageIndex{2}}\) puede extenderse a la mostrada en la Figura\(\sf{\PageIndex{3}}\).
Restricciones de ligando impuestas por ligandos rígidos o semirrígidos
Los ligandos rígidos o semirrígidos influyen en la geometría de coordinación de complejos metálicos de dos maneras principales:
- Ligandos rígidos voluminosos que abarrotan el centro metálico evitan que otros ligandos se unan. Por lo tanto, tales ligandos son útiles para preparar complejos de coordenadas bajas.
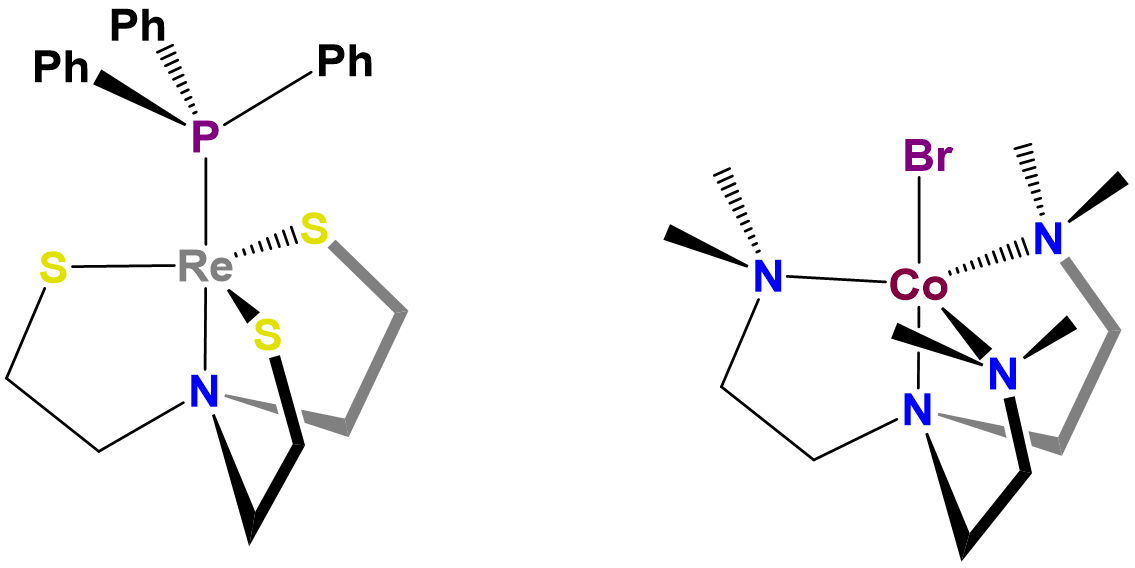
- Los ligandos rígidos y semirrígidos pueden imponer su geometría de coordinación preferida en un centro metálico. Esto se debe a que estos ligandos prefieren energéticamente adoptar una conformación particular cuando se unen a un centro metálico. Al hacerlo, desplazan el paisaje energético de la geometría de coordinación hacia esa geometría preferida. Si el desplazamiento es lo suficientemente grande en relación con la preferencia nativa debido a la repulsión del ligando y los efectos del campo del ligando, el complejo adoptará la geometría preferida por ligando o se distorsionará en la dirección de la geometría preferida por ligando. Se dan ejemplos en la Figura\(\sf{\PageIndex{4}}\).
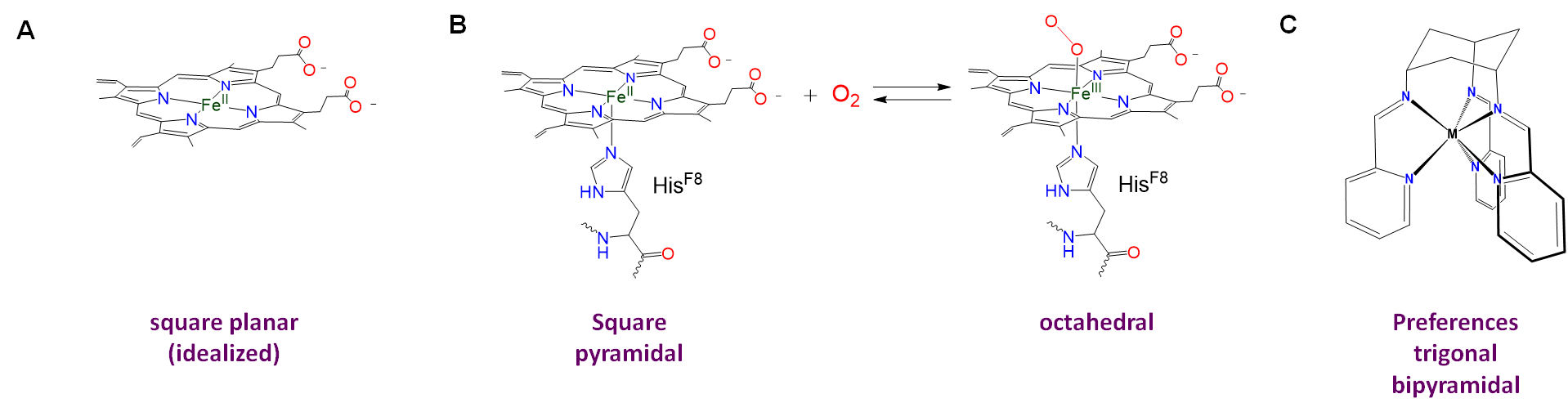
La influencia de los ligandos en la geometría de coordinación es importante en los sistemas vivos, en los que las proteínas y los ácidos nucleicos pueden actuar como ligandos rígidos o semirrígidos. La capacidad de estos ligandos para distorsionar las geometrías de coordinación de los átomos metálicos de manera que les permitan realizar funciones específicas es tan común que las geometrías distorsionadas resultantes se denominan estados entácticos. Un caso particularmente espectacular de un estado entáctico involucra a las proteínas de cobre azul azurina y plastocianina, cuya estructura se da en la Figura\(\sf{\PageIndex{5}}\).
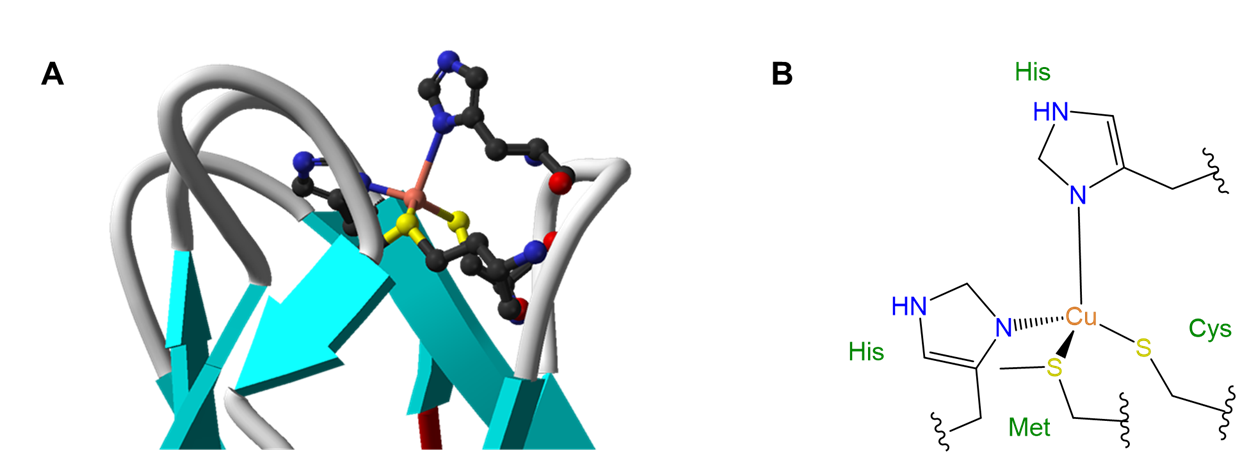
Como puede verse a partir de la estructura de la Figura\(\sf{\PageIndex{5}}\), el cobre en plastocianina presenta una geometría de coordinación tetraédrica distorsionada. Se dice que la proteína actúa como un dispositivo de tortura medieval llamado rack al estirar el metal en su geometría distorsionada. Esta distorsión facilita que el centro de cobre sufra reacciones redox fáciles, lo que le permite funcionar mejor como portador de electrones.
Efectos de empaquetamiento de cristales, en los que el empaquetamiento que reduce la energía de moléculas e iones en un cristal aleja la distorsión de la estructura de un complejo de lo que adoptaría en la fase gaseosa o solución
Este efecto es similar al de las restricciones del ligando excepto que en este caso surge no de la estructura interna a un ligando sino de las fuerzas que implica maximizar la energía de estabilización de un cristal. Con complejos de menor número de coordinación, los efectos de empaquetamiento pueden cambiar las conformaciones de los ligandos flexibles pero solo dar lugar a distorsiones muy pequeñas de la geometría de coordinación general. Los efectos de empaque pueden impulsar un cambio en la geometría de coordinación general de los complejos de mayor número de coordinación, para lo cual los efectos de empaque son significativos en relación con la pequeña diferencia de energía entre geometrías. Así, mientras que [Mo (CN) 8] 4- tiene una geometría de coordinación antiprismática cuadrada, en solución exhibe una geometría de coordinación dodecaédrica en los cristales de muchas de sus sales.
Efectos relativistas sobre las energías orbitales
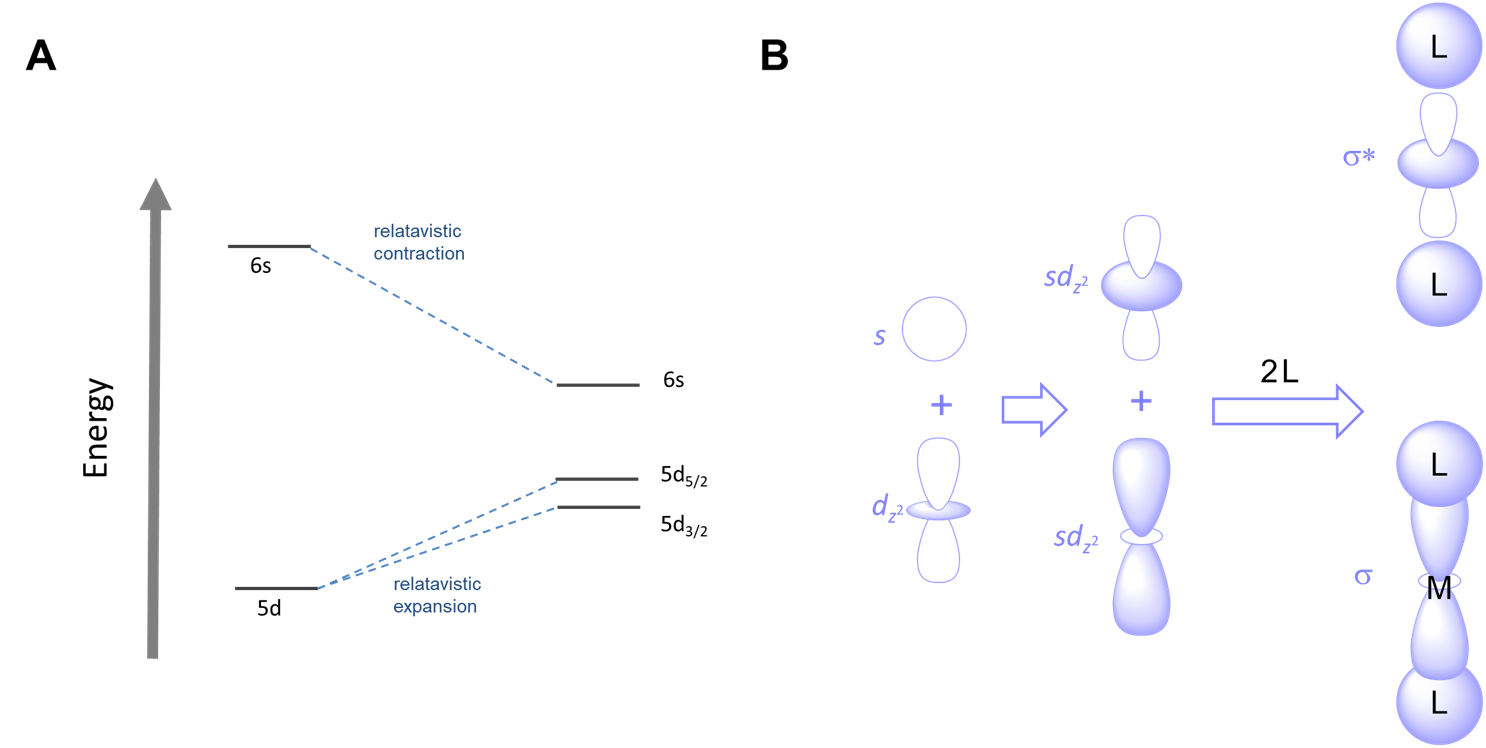
La proximidad de electrones de movimiento rápido a núcleos masivos en los elementos de transición más pesados da como resultado la expansión relativista y contracción de orbitales. Los resultados netos son que
- los elementos más pesados tienden a ser más pequeños de lo esperado. Este efecto las preferencias disminuyen los números de coordinación.
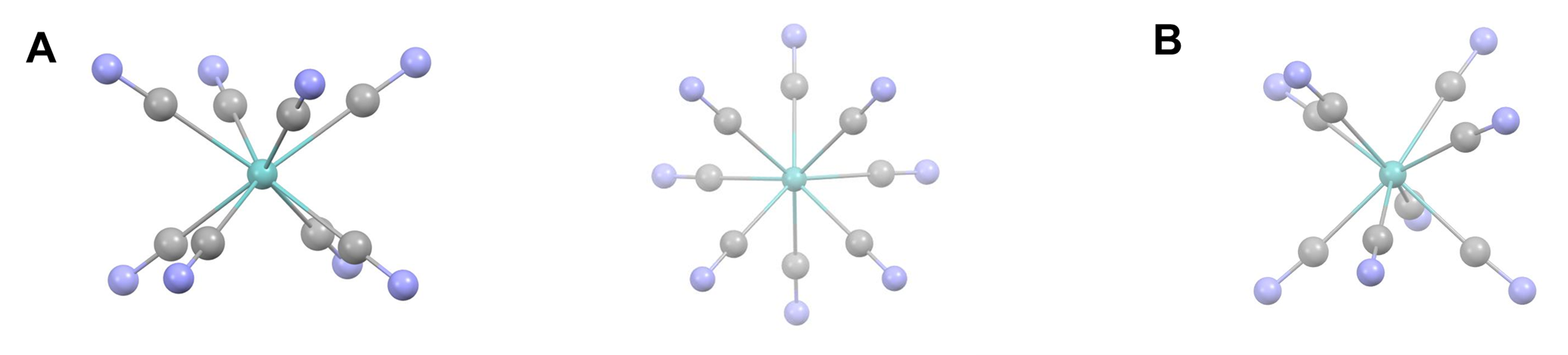
- las energías relativas de los orbitales cambian. Los orbitales que se contraen se reducen en energía mientras que los que se expanden aumentan de energía, como se muestra para el caso del oro en la Figura\(\sf{\PageIndex{6A}}\).
La combinación de tamaños más pequeños y energías orbitales alteradas afecta las preferencias de coordinación. Los efectos relativistas contribuyen a la mayor tendencia del Au I en relación con otros metales del grupo 11 a formar complejos lineales de dos coordenadas. Como se muestra en la Figura\(\sf{\PageIndex{6B}}\), la relativa cercanía en energía de los orbitales de 6 s y 5 d de oro hace que la mezcla de estos orbitales sea más favorable, facilitando la capacidad del oro para formar complejos de dos coordenadas con fuertes enlaces sigma orientados 180/ (^ {\ circ}\) entre sí.
¿Qué estructuras forman los complejos de coordinación?
Se conocen complejos metálicos con números de coordinación que van de uno a 16, aunque los valores mayores a siete son raros para los metales de transición. En esta sección se presentarán ejemplos de geometrías comunes de coordinación en orden de número de coordinación.
Coordinación Número 1.
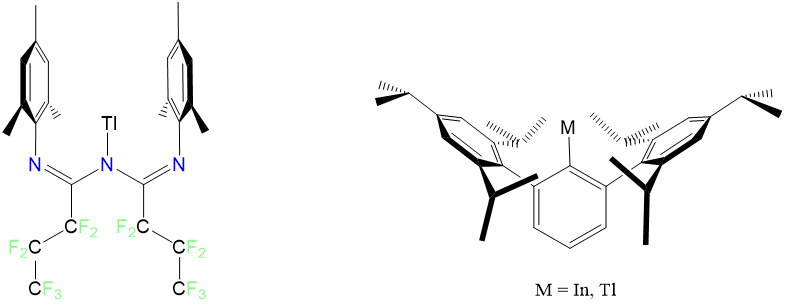
Los complejos monocoordinados de fase condensada son desconocidos para los metales de transición, aunque los metales post-transición Tl y In forman complejos monocoordinados con los ligandos voluminosos triazapentadienil y 2,6-tris (2,4,6-triisopropilfenil) benceno como se muestra en la Figura\(\sf{\PageIndex{7}}\).
Coordinación Número 2.
Un número de coordinación de 2 es raro fuera de los complejos d 10 del grupo 11 metales y mercurio, específicamente, Cu +, Ag +, Au + y Hg 2 +. De acuerdo con las predicciones del modelo Kepert estas dan complejos lineales.
Entre ellos,
- Cu + más comúnmente da complejos tetraédricos pero puede ser coaxed para dar complejos lineales. El ejemplo más destacado es [CuCl 2] -, que se forma cuando el CuCl se trata con HCl concentrado en condiciones aneróbicas.
- Ag + también forma comúnmente complejos planos tetraédricos o trigonales pero puede dar complejos lineales. El ejemplo más destacado es [Ag (NH 3) 2] +, que se puede formar tratando listones de plata con amoníaco concentrado acuoso o líquido.
- Au + casi siempre forma complejos lineales, pero muchos de estos complejos formalmente de dos coordenadas se asocian como se representa en la Figura\(\sf{\PageIndex{8}}\). La capacidad de Au + para formar complejos lineales con cianuro se usa incluso para extraer selectivamente oro metálico de minerales de baja calidad. La estabilidad de [Au (CN) 2] - significa que la disolución del oro metálico en cianuro acuoso es termodinámicamente favorable en condiciones aeróbicas.
\[\sf{4~Au~~+~~8~CN^-~~+~~O_2~~+~~2~H_2O~~\longrightarrow~~4~[Au(CN)_2]^-~~+~~4~OH^-} \nonumber \]
- Hg 2 +, como Au +, se beneficia de los efectos relativistas y más comúnmente forma complejos de dos coordenadas con una geometría lineal. Entre estos se encuentra [Hg (CN) 2]. Sin embargo, su preferencia por la linealidad no es tan rígida como por Au +, por lo que se conocen complejos con una variedad de geometrías de coordinación.
Y por medio de mención honorífica, el ion mercurio (I), Hg 2 2 +, forma complejos lineales del tipo L-Hg-Hg-L, aunque dado que Hg 2 2 + a menudo se considera como una sola unidad, estos no siempre se consideran complejos de dos coordenadas.

También se pueden formar complejos de dos coordenadas mediante el uso de ligandos voluminosos que solo permiten la unión de dos al centro metálico. Los ejemplos clásicos se dan en la Figura\(\sf{\PageIndex{9}}\).
Coordinación Número 3
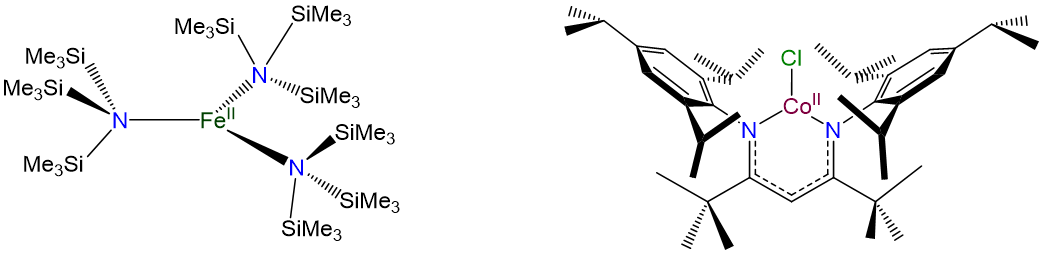
Los complejos de tres coordenadas son similares a los de dos coordenadas en que son raros y, aparte de la influencia limitante de los ligandos, generalmente se limitan a d 10 iones metálicos como Cu +, Ag +, Au +, Hg 2 + y Pt (0). Como se esperaba del modelo de Kepert, en ausencia de ligandos limitantes, los complejos de tres coordenadas son planos trigonales.
Coordinación Número 4
Las dos geometrías comunes de cuatro coordenadas son tetraédricas y planas cuadradas.

Los complejos tetraédricos están formados comúnmente por metales que poseen una configuración de electrones d 0 o d 10. Los ejemplos monometálicos de configuraciones d 0 incluyen TiCl 4, VO 4 3 -, WS 4 2 -, MnO 4 -, CrO 4 2 - y OSO 4, mientras que d 10 ejemplos son [Ni (CO) 4], [HGbR 4] 2-, [ZnCl 4] 2-, y [CDi 4] 2-. Para otras configuraciones de electrones, se conocen complejos tetraédricos pero mucho menos comunes. Los ejemplos suelen involucrar buenos ligandos donantes e incluyen [FeCl 4] - (d 5), [CoCl 4 2 -] (d 6) y [NiCl 4] 2- (d 7).
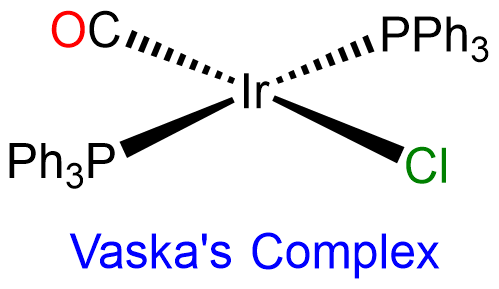
Los centros de metales de transición de segunda y tercera fila con configuraciones de d 8 electrones como Rh +, Ir +, Pd 2 +, Pt 2 + y Au 3 + exhiben casi exclusivamente geometrías planas cuadradas. Más allá de esto, las geometrías planas cuadradas suelen estar formadas por Ni 2 + (d 8), Ni 3 + (d 7) y Cu 2 + (d 9). Ejemplos de complejos planos cuadrados incluyen [Cu (acac) 2]; [PtCl 4] 2-; catalizador de Wilkinson, [rHCl (PPh 3) 3]; y complejo de Vaska, trans - [Ir (CO) Cl (PPh 3) 2].
Coordinación Número 5
Las dos geometrías de coordinación comunes para los complejos de cinco coordenadas son bipiramidal trigonal y piramidal cuadrado.
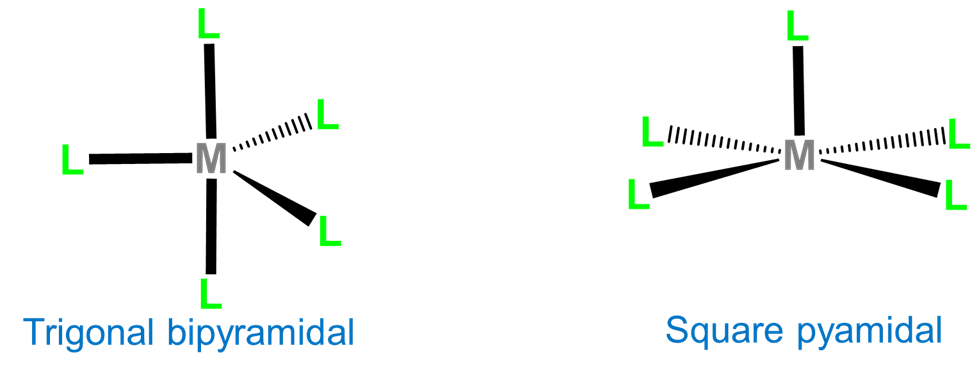
Homoléptico [Ni (CN) 5] 3- posee una estructura piramidal cuadrada, aunque la geometría es más común para complejos macrocíclicos como la protoporfirina de hierro de la desoximioglobina mostrada en la figura\(\sf{\PageIndex{4}}\) y para complejos que contienen ligandos oxo y nitrido, ejemplos de los cuales se muestran en Figura\(\sf{\PageIndex{12}}\).
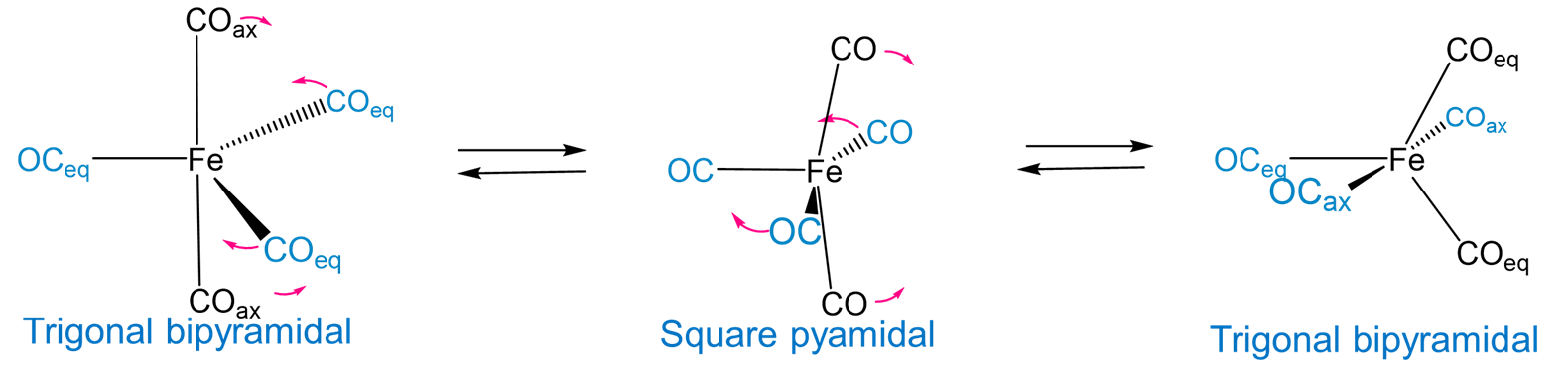
En ausencia de ligandos de restricción rígidos, la diferencia de energía relativamente baja entre las geometrías de coordinación bipiramidal trigonal y piramidal cuadrada proporciona un mecanismo para la interconversión de los ligandos axial y ecuatorial en un complejo plano trigonal. Por ejemplo, el pentacarboniliron (0) exhibe fluxionalidad involucrando un intermedio piramidal cuadrado a través de un mecanismo de pseudorrotación de Berry, como se muestra en la Figura\(\sf{\PageIndex{13}}\).
Coordinación Número 6
Las dos geometrías de coordinación comunes para la coordinación número 8 son octaédricas y trigonales prismáticas.
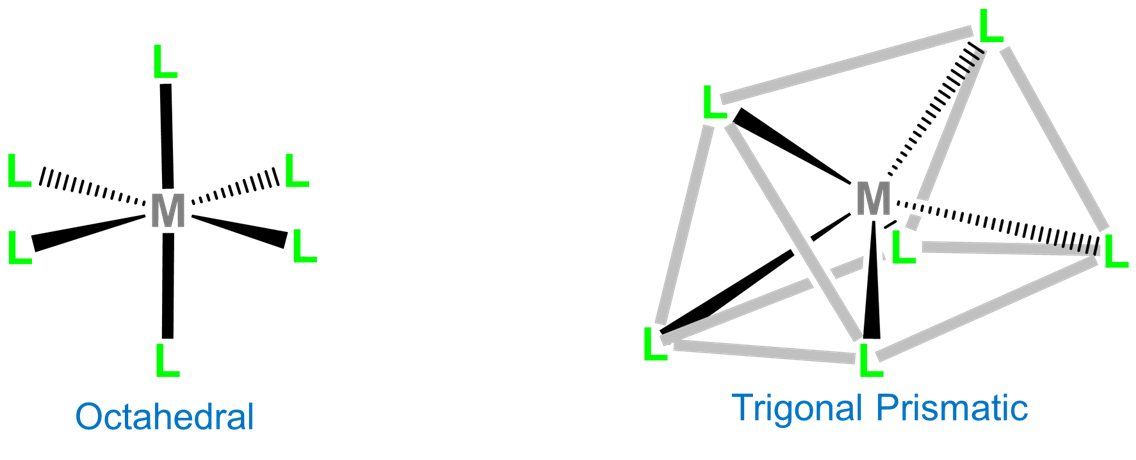
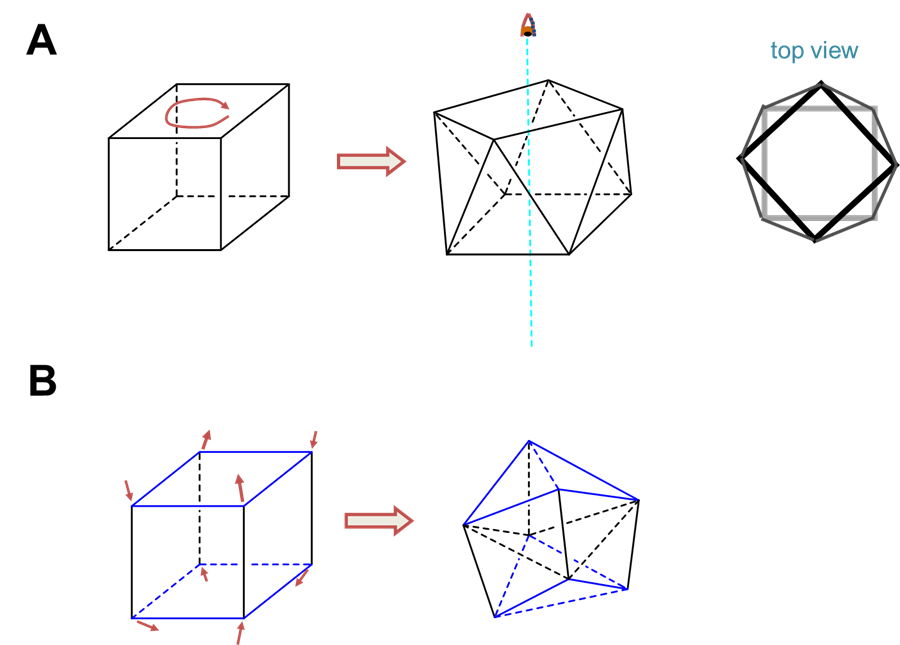
La coordinación prismática trigonal se relaciona con la coordinación octaédrica como se muestra en la Figura\(\sf{\PageIndex{15}}\). Como puede verse en la Figura\(\sf{\PageIndex{15}}\), una esfera de coordinación octaédrica es solo un antiprisma trigonal en el que todas las longitudes de borde son idénticas. La rotación de una cara triangular respecto a su opuesta hasta eclipsar las dos da una geometría prismática trigonal. De hecho, dado que la continuación de esta rotación da otro complejo octaédrico, la geometría prismática trigonal es un intermedio en las reacciones de isomerización que involucran complejos octaédricos.
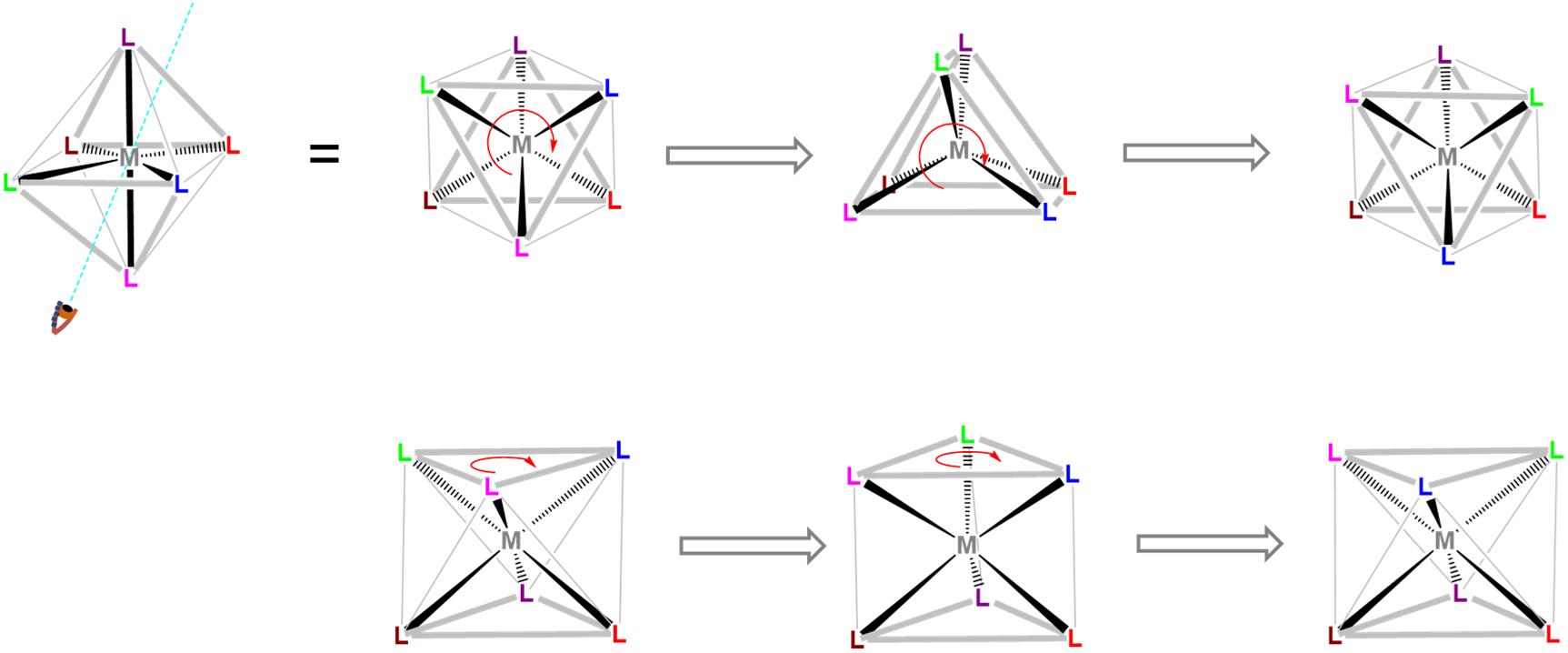
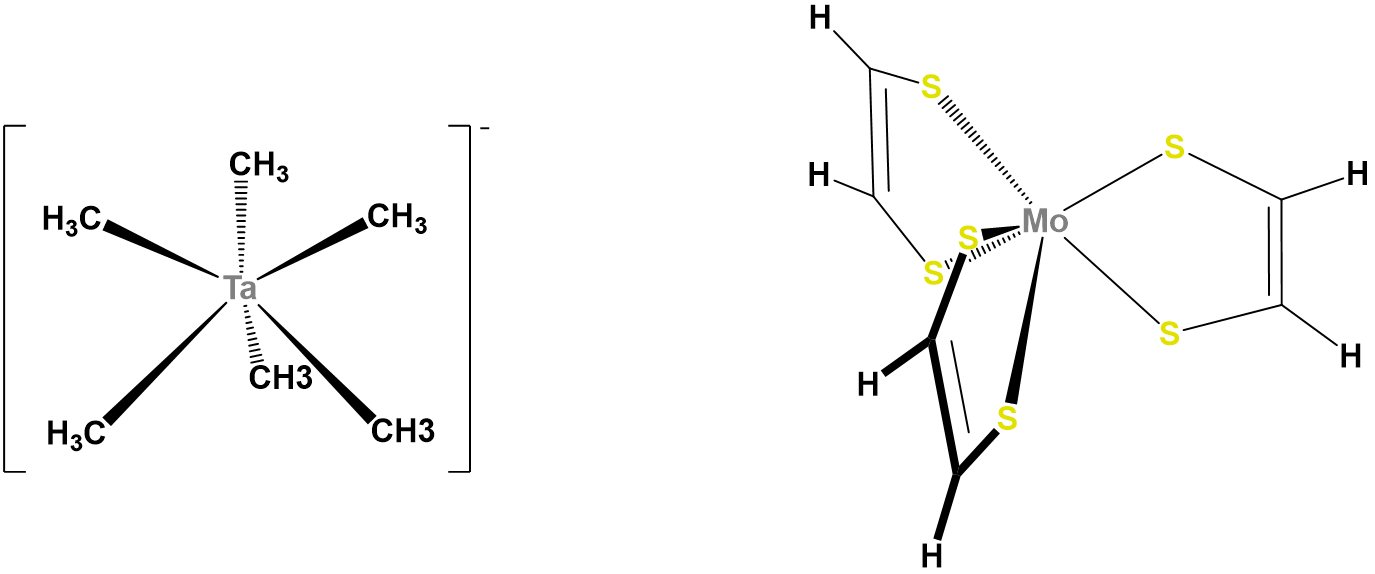
En contraste con las geometrías de coordinación octaédrica, la coordinación prismática trigonal (y sus versiones distorsionadas) son raras y ocurren principalmente para configuraciones d 0, d 1 y d 2. Ejemplos de centros metálicos prismáticos trigonales incluyen los centros d 2 Mo 4 + en MoS 2, d 1 [Re (S 2 C 2 Ph 2) 3] -, y d 0 [Ta (CH 3) 6] -, de los cuales las dos últimas estructuras se dan en la Figura\(\sf{\PageIndex{16}}\). Ligandos semirrígidos como el mostrado en la Figura\(\sf{\PageIndex{4C}}\) pueden ser utilizados para fomentar la adopción de una geometría prismática trigonal, aunque una vez que el número de electrones d presentes supera dos, la preferencia por la coordinación octaédrica es demasiado grande para que ocurra una geometría prismática trigonal.
Coordinación Número 7
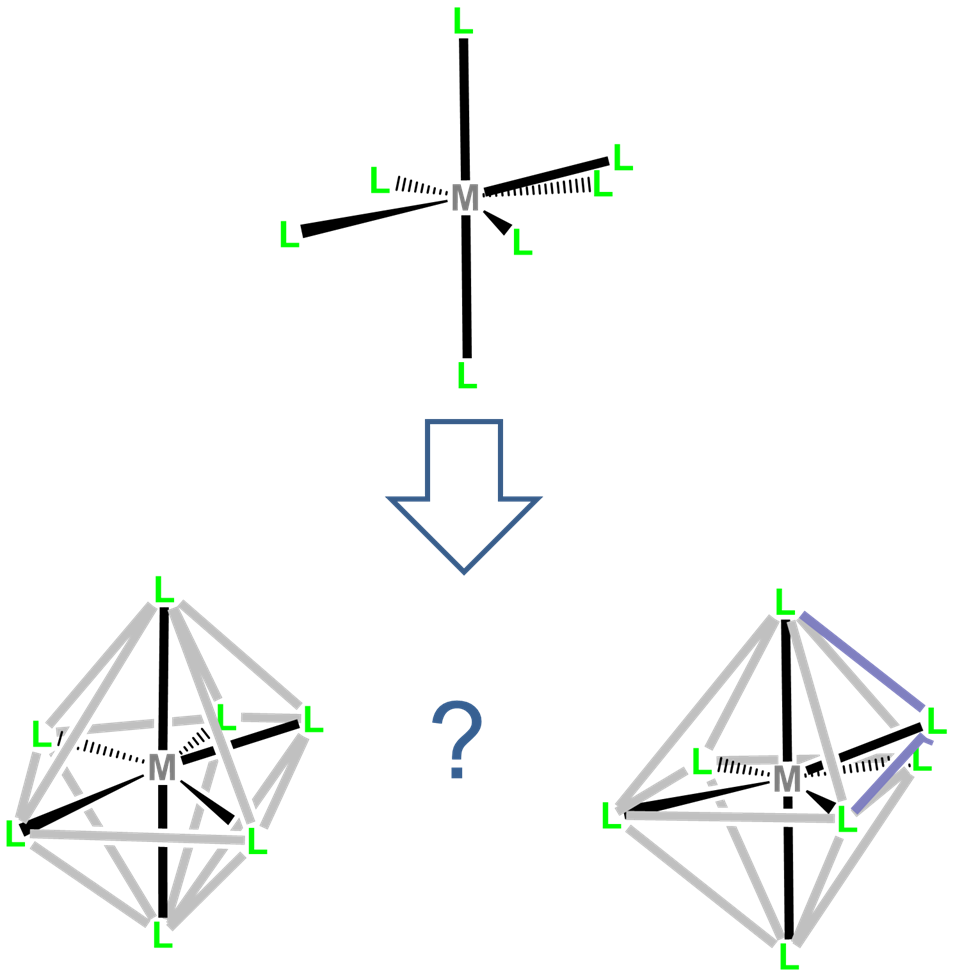
Los complejos de siete coordenadas son raros fuera de los relativamente grandes metales de transición temprana, lantánidos y actínidos. Las tres geometrías comunes de siete coordenadas son pentagonal bipiramidal, octaédrica monocapada y prismática trigonal monocapada. Estos dos últimos se denominan a menudo octaédricos tapados y prismáticos trigonales tapados, entendiéndose el mono- prefijo.
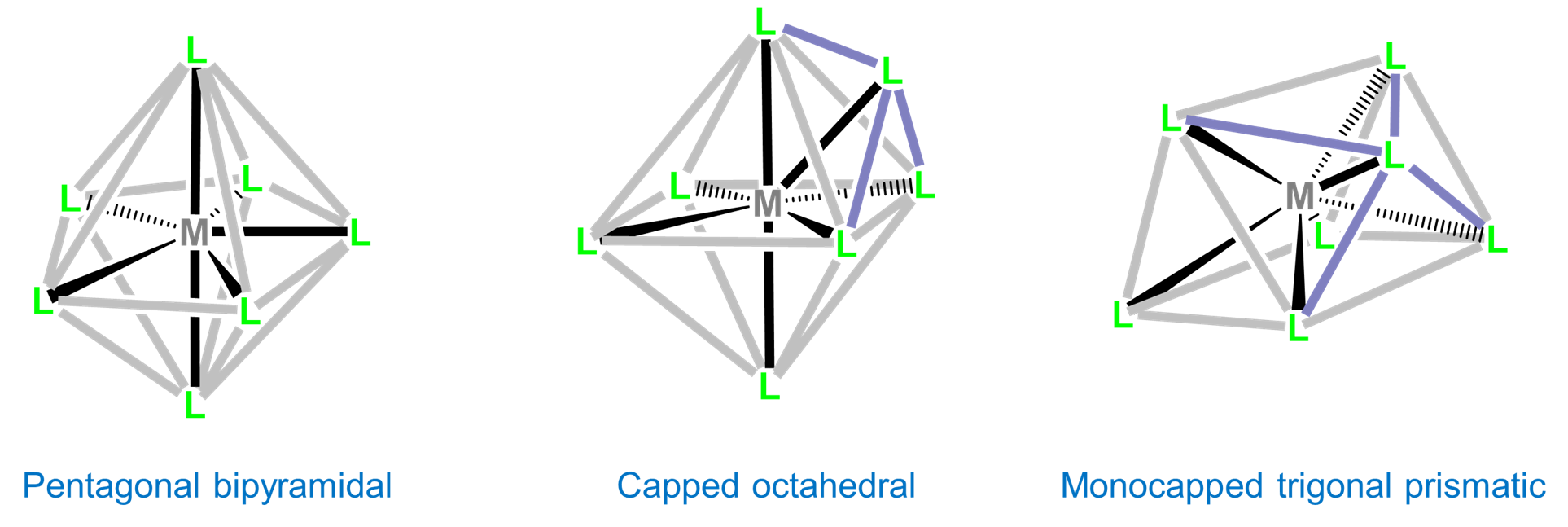
Aunque las repulsiones intraligand son más pequeñas en la geometría de coordinación bipiramidal pentagonal que las geometrías octaédricas tapadas y prismáticas trigonales tapadas, la diferencia es pequeña y las tres estructuras a menudo son cercanas en energía. Como resultado, la estructura observada a menudo depende de restricciones basadas en ligandos, empaquetamiento de cristales y efectos de solventes que prefieren una geometría sobre las otras.
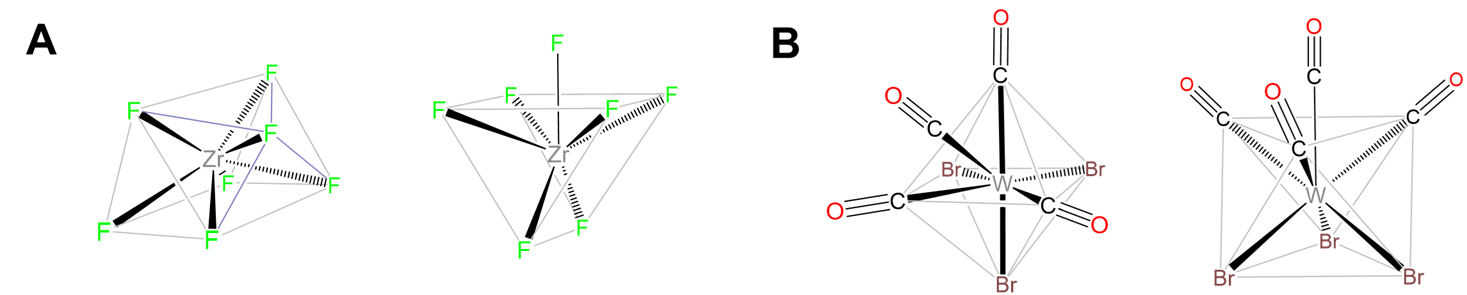
Los complejos heptacyano suelen ser pentagonales bipiramidales. Los ejemplos incluyen [Mo (CN) 7] 3-, [W (CN) 7] 3-, y [Os (CN) 7] 3-. Los complejos de siete coordenadas que contienen ligandos oxo comúnmente son pentagonales bipiramidales con el ligando oxo en la posición axial menos estéricamente impedida. Los ejemplos incluyen [NboF 6] 3- y, para los metales de transición internos, [UO 2 F 5] 3-. Los ligandos que se han utilizado para promover la formación de especies de siete coordenadas incluyen 15-corona-5 y 2,2':6',2":6",2"'-cuaterpiridina. Los complejos representativos se dan en la Figura\(\sf{\PageIndex{17}}\).
Las geometrías prismáticas trigonales coronadas son comunes para los complejos de los metales de transición temprana. Los ejemplos incluyen [nBF 7] 2-, [TaF 7] 2- y [ZrF 7] 3- en (NH 4) 3 [zrF 7].
Las geometrías octaédricas tapadas se encuentran en [MoMe 7] -, [WMe 7] - y [WBr 3 (CO) 4], que contiene tres pares de trans -Br y CO con el CO final tapando la cara del octaedro (CO) 3, como se muestra en la Figura \(\sf{\PageIndex{18}}\).
En los complejos de siete y mayores coordenadas, los efectos de empaquetamiento de ligandos y cristales frecuentemente dan geometrías de coordinación distorsionadas. Estas geometrías son intermedias entre dos o más de las siete geometrías de coordenadas idealizadas, dificultando decir exactamente de qué estructura son una distorsión (Figura\(\sf{\PageIndex{19}}\)).
Coordinación Número 8
Los complejos de ocho coordenadas son raros y ocurren en moléculas discretas e iones solo para los metales de transición temprana relativamente grandes, lantánidos y actínidos. Las tres geometrías comunes de ocho coordenadas son antiprismáticas cuadradas, dodecaédricas y prismáticas trigonales bicapadas. En contraste, la geometría de coordinación cúbica solo se encuentra en redes iónicas como la de CsCl y en complejos de los metales de transición internos como Na 3 [UF 8].
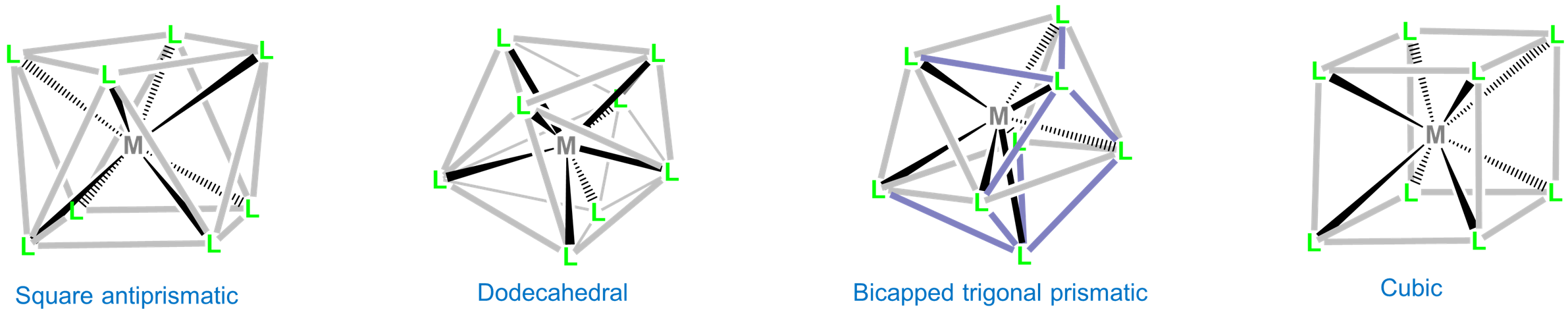
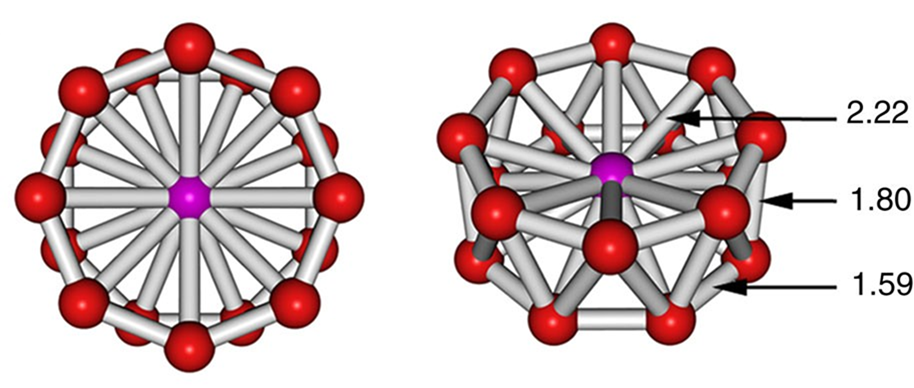
Al igual que con otras estructuras de coordenadas altas, la diferencia de energía entre estas geometrías de coordinación ocho veces es lo suficientemente pequeña como para que los efectos de empaquetamiento puedan influir significativamente en la estructura observada. Por ejemplo, los octacyanomolibdatos suelen adoptar una geometría de coordinación antiprismática cuadrada pero dependiendo de los contraiones presentes pueden dar complejos prismáticos trigonales dodecaédricos o bicapados. Se dan ejemplos en la Figura\(\sf{\PageIndex{21}}\).
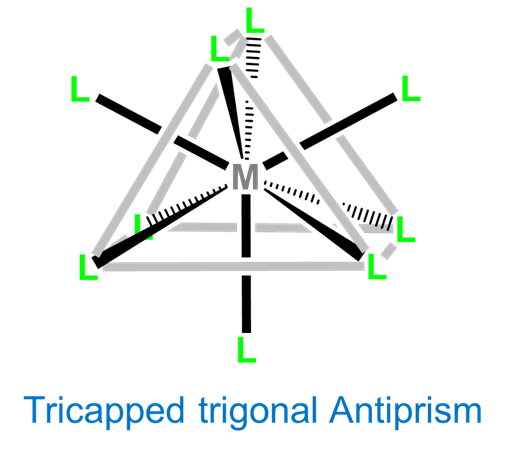
Coordinación Número 9
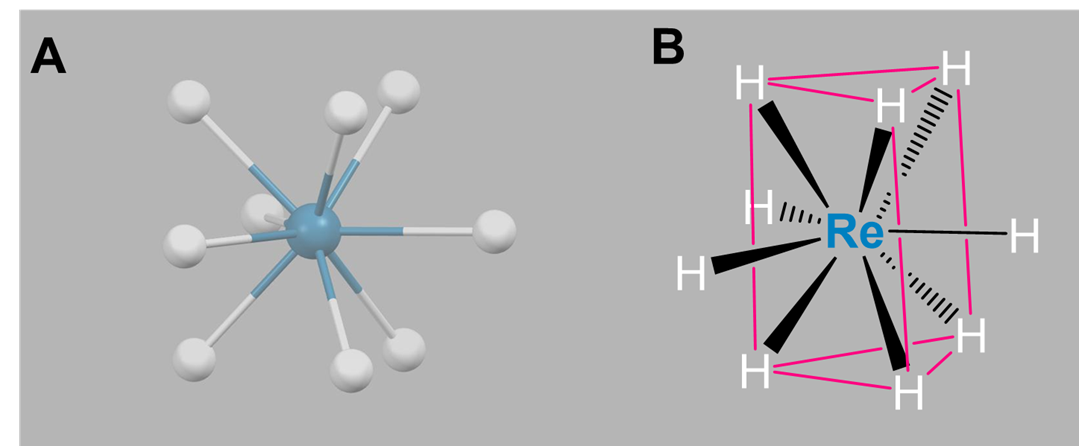
Nuevamente, los complejos de nueve coordenadas generalmente requieren metales de transición, lantánidos y actínidos más grandes. Las geometrías de coordinación son típicamente tricapadas trigoralmente prismáticas o idiosincráticamente determinadas por los ligandos. Ejemplos simples incluyen los complejos acuáticos [Sc (H 2 O) 9] 3+, [Y (H 2 O) 9] 3+, y [La (H 2 O) 9] 3+, así como [TCh 9] 2- y [ReH 9] 2-.
Números de Coordinación 10-16
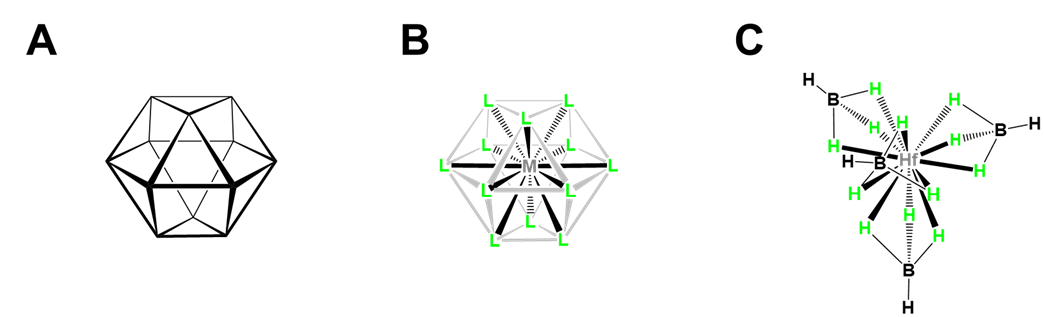
Los números de coordinación superiores a nueve son extremadamente raros para los compuestos que se unen de\(\kappa\) manera (forman enlaces metal-ligando convencionales) 14 y generalmente involucran alguna combinación de metales grandes, ligandos estéricamente poco exigentes y estructuras de ligandos especiales que promueven una mayor coordinación. Ejemplos notables incluyen
- Doce coordenadas [Hf (BH 4) 4], que ilustra cómo pequeños ligandos multidentados promueven mayores números de coordinación. Como se muestra en la Figura\(\sf{\PageIndex{23}}\), [Hf (BH 4) 4] tiene una estructura cubooctaédrica en la que BH 4 - actúa como ligando tridentado, ocupando unidades BH 3 caras triangulares del cubooctaedro para dar un tetraedro de BH 4 - ligandos alrededor de la Hf.
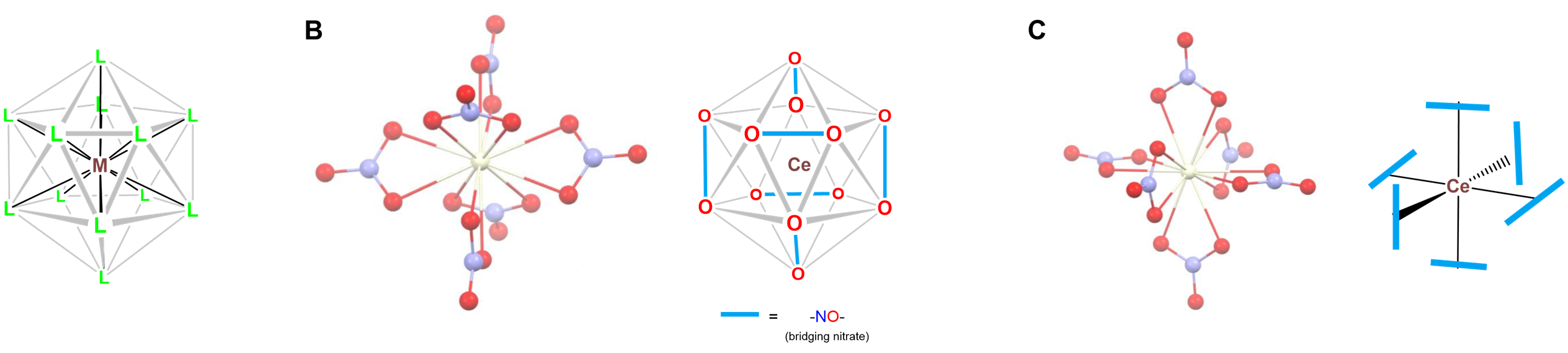
- Doce coordenada [Ce (NO 3) 6] 2-, en la que los oxígenos de nitrato definen una geometría de coordinación icosaédrica como se muestra en la Figura \(\sf{\PageIndex{24}}\). Los nitratos en la estructura unen el centro Ce de manera bidentada en una matriz octaédrica.
- Quince coordenadas [Th (H 3 BnMe 2 BH 3) 4], que también utiliza unidades puente H-B-H que ocupan poco de la esfera de coordinación. En [Th (H 3 BnMe 2 BH 3) 4], tres de los cuatro ligandos H 3 BnMe 2 BH 3 se unen de manera\(\kappa\) 4 y uno se une a\(\kappa\) 3, dando la coordinación de quince veces. 16
- Dieciséis coordenadas [CoB 16] −, que posee el mayor número de coordinación observado hasta ahora. Su estructura se da en la Figura\(\sf{\PageIndex{25}}\). La geometría de coordinación es un antiprisma octaédrico, y se debe considerar que el complejo involucra un centro Co en medio de un B 16 - “tambor molecular” mantenido unido por enlaces de racimo.
Referencias
- Dudev, M.; Wang, J.; Dudev, T.; Lim, C., Factores que rigen el número de coordinación de metales en complejos metálicos de Cambridge Structural Database Analyses. La Revista de Química Física B 2006, 110 (4), 1889-1895.
- Kuppuraj, G.; Dudev, M.; Lim, C., Factores que gobiernan las distancias Metal-Ligando y las Geometrías de Coordinación de Complejos Metálicos. La Revista de Química Física B 2009, 113 (9), 2952-2960.
- Cremades, E.; Echeverría, J.; Alvarez, S., El prisma Trigonal en Química de Coordinación. Química — Una revista europea 2010, 16 (34), 10380-10396.
- Xiong, X.-G.; Wang, Y.-L.; Xu, C.-Q.; Qiu, Y.-H.; Wang, L.-S.; Li, J., Sobre la covalencia oro-ligando en complejos lineales [AUx 2] −. Dalton Transacciones 2015, 44 (12), 5535-5546.
- Concepción Gimeno, M. La química del oro en Laguna, Antonio (ed.) Química Supramolecular Moderna del Oro: Interacciones y Aplicaciones Oro-Metal. Wiley, 2008.
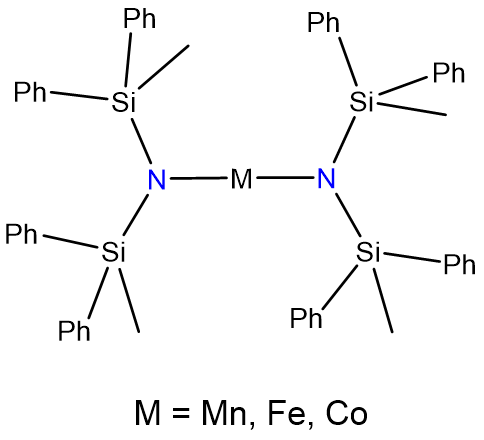
- Andersen, R. A.; Faegri, K.; Green, J. C.; Haaland, A.; Lappert, M. F.; Leung, W. P.; Rypdal, K., Síntesis de bis [bis (trimetilsilil) amido] hierro (II). Estructura y unión en M [N (SiMe3) 2] 2 (M = manganeso, hierro, cobalto): amidas bicoordinadas de metal de transición. Química Inorgánica 1988, 27 (10), 1782-1786.
- Persson, I., Iones metálicos hidratados en solución acuosa: ¿Qué tan regulares son sus estructuras? Química Pura y Aplicada 2010, 8 2 (10), 1901.
- Aramburu, J. A.; García-Fernández, P.; García-Lastra, J. M.; Moreno, M., Sistemas Jahn—Teller y No-Jahn—Teller que involucran CuF 6 4 — Unidades: Papel del Campo Eléctrico Interno en Ba2ZnF6:Cu2+ y Otros Sistemas Aislantes. La Revista de Química Física C 2017, 121 (9), 5215-5224.
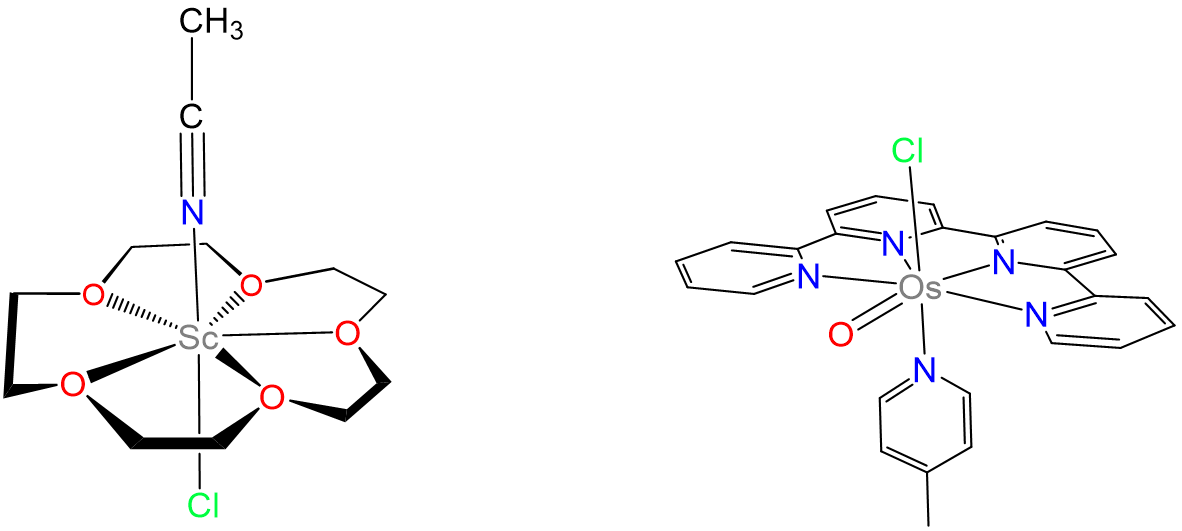
- Brown, M. D.; Levason, W.; Murray, D. C.; Popham, M. C.; Reid, G.; Webster, M., Coordinación primaria y secundaria de éteres de corona a escandio (iii). Síntesis, propiedades y estructuras de los productos de reacción de ScCl3 (tf) 3, ScCl3·6H2O y Sc (NO3) 3·5H2O con éteres corona. Dalton Transactions 2003, (5), 857-865.
- Liu, Y.; Ng, S.-M.; Lam, W. W. Y.; Yiu, S.-M.; Lau, T.-C., Un Complejo Oxo de Osmio de Siete Coordenadas Altamente Reactivo (V): [OsV (O) (qpy) (pic) Cl] 2+. Angewandte Chemie Edición Internacional 2016, 55 (1), 288-291.
- Popov, I., Jian, T., López, G. et al. Tambores moleculares de boro centrados en cobalto con el mayor número de coordinación en el cluster CoB 16 −. Nat Commun 6, 8654 (2015). https://doi.org/10.1038/ncomms9654
- Las estructuras se renderizan a partir de datos cif reportados en las siguientes publicaciones: (A) antiprismático cuadrado [Mo (CN) 8] 3-: Wen-Yan Liu, Hu Zhou, Ai-Hua Yuan, Acta Crystallographica Sección E: Structure Reports Online, 2008, 64, m1151, (B) dodecaédrico [Mo (CN) 8] 4-: B.J.Corden, J.A.Cunningham, R.Eisenberg, Química Inorgánica, 1970, 9, 356.
- La estructura de ReH 9 2 - se obtiene a partir de la estructura reportada en Abrahams, S.C.; Ginsberg, A.P.; Knox, K. Compuestos de transición metal-hidrógeno. II. El cristal y la estructura molecular del hidruro de potasio y renio, K 2 ReH 9 Inorganic Chemistry, 1964, 3, 558-567.
- Existen otros complejos en los que se puede decir que un metal interactúa con más de dieciséis “átomos de ligando”, pero estos no suelen considerarse que poseen un mayor número de coordinación. Por ejemplo, en algunos\(\pi\) complejos como\(\eta\) 5 -Cp 4 U, técnicamente hay 20 átomos de C sujetos a la U, pero estos complejos se consideran mejor como coordenadas 12 que veinte (ya que cada anillo de ciclopentadienilo es isolobal con un conjunto coordinado fac de 3 L ligandos), mientras que los centros metálicos en especies de fullereno endoédrico como La @C 60 no interactúan con los sesenta átomos de carbono a la vez, por lo que es mejor pensarse como un metal atrapado en una espaciosa jaula de sesenta carbonos.
- Zalkin, A.; Forrester, J.D.; Templeton, D.H. Estructura cristalina del hidrato de nitrato de magnesio de cerio Journal of Chemical Physics, 1963, 39, 2881-2891.
- Daly, S. R.; Piccoli, P. M. B.; Schultz, A. J.; Todorova, T. K.; Gagliardi, L.; Girolami, G. S., Síntesis y propiedades de un complejo de quince coordenadas: El aminodiboranato de torio [Th (H3BnMe2BH3) 4]. Angewandte Chemie Edición Internacional 2010, 49 (19), 3379-3381.
- Popov, I., Jian, T., López, G., Boldyrev, A. I.; Wang, L-S. Tambores moleculares de boro centrados en cobalto con el mayor número de coordinación en el cluster CoB 16 −. Nat Commun 6, 8654 (2015).

