10.1: Evidencia de Estructuras Electrónicas
- Page ID
- 81038
Esta sección describe los tipos de datos experimentales que nos dan pistas sobre la estructura electrónica de los complejos de coordinación (es decir, los orbitales moleculares, sus niveles de energía y configuraciones de electrones). Los tipos de observaciones experimentales aquí discutidos han sido utilizados para generar las teorías de vinculación que se describen más adelante en este capítulo.
Introducción
Los electrones y orbitales fronterizos (valencia) definen las propiedades químicas y físicas de cualquier compuesto. En los metales de transición y sus compuestos de coordinación, los\(d\) orbitales y\(d\) electrones son los de interés. Así, los\(d\) orbitales y los electrones serán el foco de este capítulo.
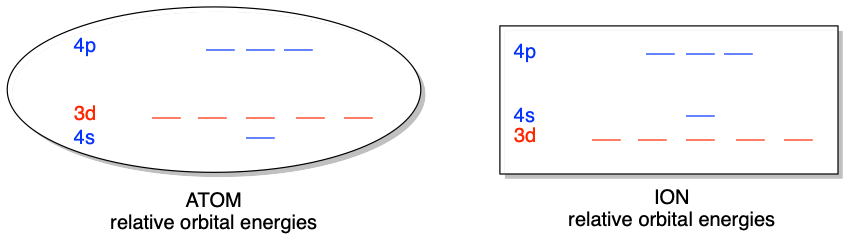
Una de las primeras cosas que podrías notar sobre\(d\) los orbitales de valencia es el orden de los niveles de energía orbitales de átomos e iones en los metales de transición. Por ejemplo, en la primera fila de metales de transición, el orbital 4s se llena antes que el\(3d\) en los átomos. Esto indica que\(4s\) es menor en energía que\(3d\) en estos átomos. Sin embargo, en los iones de los mismos elementos, el\(3d\) orbital está ocupado mientras que el\(4s\) orbital está vacío. Esto indica lo contrario, que el\(3d\) orbital es menor en energía que\(4s\) en estos iones. El cambio en los niveles de energía relativa de los\(3d\) y\(4s\) orbitales en los átomos en comparación con los iones es resultado de los efectos combinados de blindaje y penetración, como se discutió en un capítulo anterior. El resultado es que los niveles de energía orbitales 3d y 4s están lo suficientemente cerca en energía como para que los cambios sutiles en el entorno puedan revertir el orden.
Además, van a ver que una vez que el átomo está rodeado de ligandos, los cinco\(d\) orbitales ya no están degenerados. En un compuesto de coordinación, con ligandos unidos en una geometría específica, los\(d\) orbitales se dividen en niveles de energía ligeramente diferentes. El patrón de división depende de dónde se encuentren los ligandos en el espacio; en otras palabras, depende de la geometría de coordinación. Los patrones de división para geometrías tetraédricas y octaédricas se muestran a continuación. Observe que la división se invierte entre metales en un ambiente de coordinación tetraédrica en comparación con un ambiente octaédrico.
Cuando los orbitales de un compuesto de coordinación están llenos de electrones, la configuración electrónica depende de la diferencia de energía entre los niveles de energía más bajos y superiores. Por ejemplo, dados cinco\(d\) electrones en un ambiente octaédrico, existen dos posibles configuraciones de electrones. Los cinco electrones pueden ocupar el nivel inferior de\(d\) orbitales (Fig. \(\PageIndex{3}\), izquierda), de manera que algunos electrones están emparejados. Otra posibilidad es que todos los electrones quedarán desapareados si pueblan ambos niveles de los orbitales d (Fig. \(\PageIndex{3}\), derecha).
Una serie de factores determinan qué resultados de caso, incluyendo la identidad del ión metálico y la naturaleza de los ligandos involucrados. Estas diferentes órdenes de llenado también tienen consecuencias. Las propiedades magnéticas del complejo, su propensión a sufrir reacciones y sus propiedades ópticas dependen de la configuración de estos electrones fronterizos.
Este capítulo es una exploración de la naturaleza del enlace metal-ligando y cómo tanto la geometría como el modo de unión influyen en las propiedades de los complejos de coordinación.
- 10.1.2: Susceptibilidad Magnética
- La estructura electrónica de los complejos de coordinación puede conducir a varias propiedades diferentes que involucran diferentes respuestas a los campos magnéticos. Estas propiedades pueden variar entre compuestos relacionados debido a diferencias en los recuentos de electrones, geometría o fuerza del donante. Como resultado, la medición magnética de estos materiales se puede utilizar como una herramienta para proporcionar información sobre la estructura de un complejo de coordinación.

