10.1.2: Susceptibilidad Magnética
- Page ID
- 81048
Estructura Electrónica
La estructura electrónica de los complejos de coordinación puede conducir a varias propiedades diferentes que involucran diferentes respuestas a los campos magnéticos. Estas propiedades pueden variar entre compuestos relacionados debido a diferencias en los recuentos de electrones, geometría o fuerza del donante. Como resultado, la medición magnética de estos materiales se puede utilizar como una herramienta para proporcionar información sobre la estructura de un complejo de coordinación.
Los compuestos diamagnéticos y paramagnéticos son dos categorías comunes definidas por la interacción con un campo magnético. Los compuestos diamagnéticos muestran una repulsión muy leve de los campos magnéticos. La interacción es bastante sutil y requiere de la instrumentación adecuada para ser observada; no es algo que normalmente notarías agitando un imán frente a un vial de complejo de coordinación. En contraste, los compuestos paramagnéticos muestran una atracción muy leve hacia los campos magnéticos. En términos de estructura electrónica, los compuestos diamagnéticos tienen todos sus electrones en pares, mientras que los compuestos paramagnéticos tienen uno o más electrones desapareados. Estas definiciones no se limitan a los complejos de coordinación. El oxígeno atmosférico, O 2, es un ejemplo común de un compuesto paramagnético. El nitrógeno atmosférico, N 2, es un ejemplo común de un compuesto diamagnético.
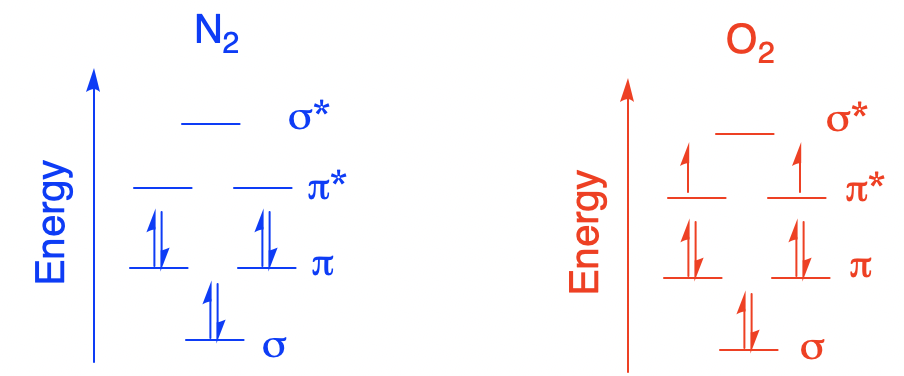
Estas diferencias surgen debido a una propiedad mecánica cuántica de los electrones y otras partículas subatómicas: el espín. El giro no tiene una analogía macroscópica directa; los químicos físicos a menudo instan a la precaución para equipararlo a un fenómeno en el nivel en el que observamos el universo. Sin embargo, sí sabemos que el giro está relacionado con fenómenos magnéticos. Podemos pensar en un electrón como tener un momento magnético. Hay dos valores permitidos de este momento magnético (\(+\frac{1}{2}\)y\(-\frac{1}{2}\)) que difieren en la orientación; el giro es una cantidad vectorial. Normalmente, no hay preferencia por una orientación sobre la otra. Si un complejo de coordinación tiene un electrón desapareado, y tenemos un millón de esos complejos de coordinación en una muestra muy diminuta, alrededor de 500,000 de los electrones desapareados tendrían spin =\(+\frac{1}{2}\) y alrededor de 500,000 de ellos tendrían spin =\(-\frac{1}{2}\). El espín de cada electrón está orientado aleatoriamente. Como resultado, el material no tendría momento magnético neto. En presencia de un campo magnético, sin embargo, hay una pequeña diferencia de energía entre esos dos estados de espín. Como resultado, la mayoría de los giros adoptan la orientación energéticamente más favorable. Aunque el material por sí mismo no tiene campo magnético neto, uno ha sido inducido temporalmente por la influencia de un campo magnético externo. Esto es lo que queremos decir con susceptibilidad magnética.
Medición de la susceptibilidad magnética
Todos los compuestos diamagnéticos tienen una respuesta más o menos similar a un campo magnético; o bien sus electrones están todos emparejados o no lo están. Los compuestos paramagnéticos, sin embargo, pueden responder de manera bastante diferente a un campo magnético, dependiendo del número de electrones desapareados. Cuantos más electrones desapareados haya, más fuerte será la susceptibilidad magnética, y así más fuerte será la atracción entre el compuesto y el campo magnético. Por esta razón, medir la fuerza de atracción de un compuesto para un campo magnético puede revelar el número de electrones desapareados en el compuesto. Esta relación es más sencilla para los complejos de metales de transición de primera fila (\(3d\)metales), volviéndose un poco más complicada para la\(5d\) serie\(4d\) y.
Un balance Guoy es probablemente el ejemplo más simple de un método para determinar la presencia de electrones desapareados en un complejo de coordinación. 1 Utiliza una balanza, un portamuestras y un imán. Esencialmente, el imán se pesa en presencia y ausencia de la muestra. La discrepancia entre las dos mediciones surge por la interacción de la muestra con el campo magnético. Cualquier muestra diamagnética provoca una ligera repulsión descendente, registrándose como un peso más pesado. Una muestra paramagnética suspendida entre los polos del imán provoca una ligera tracción hacia arriba del imán, que se registra como un peso más ligero. Cuantos más electrones desapareados haya, mayor será el momento magnético inducido, y así más ligero se vuelve el peso.
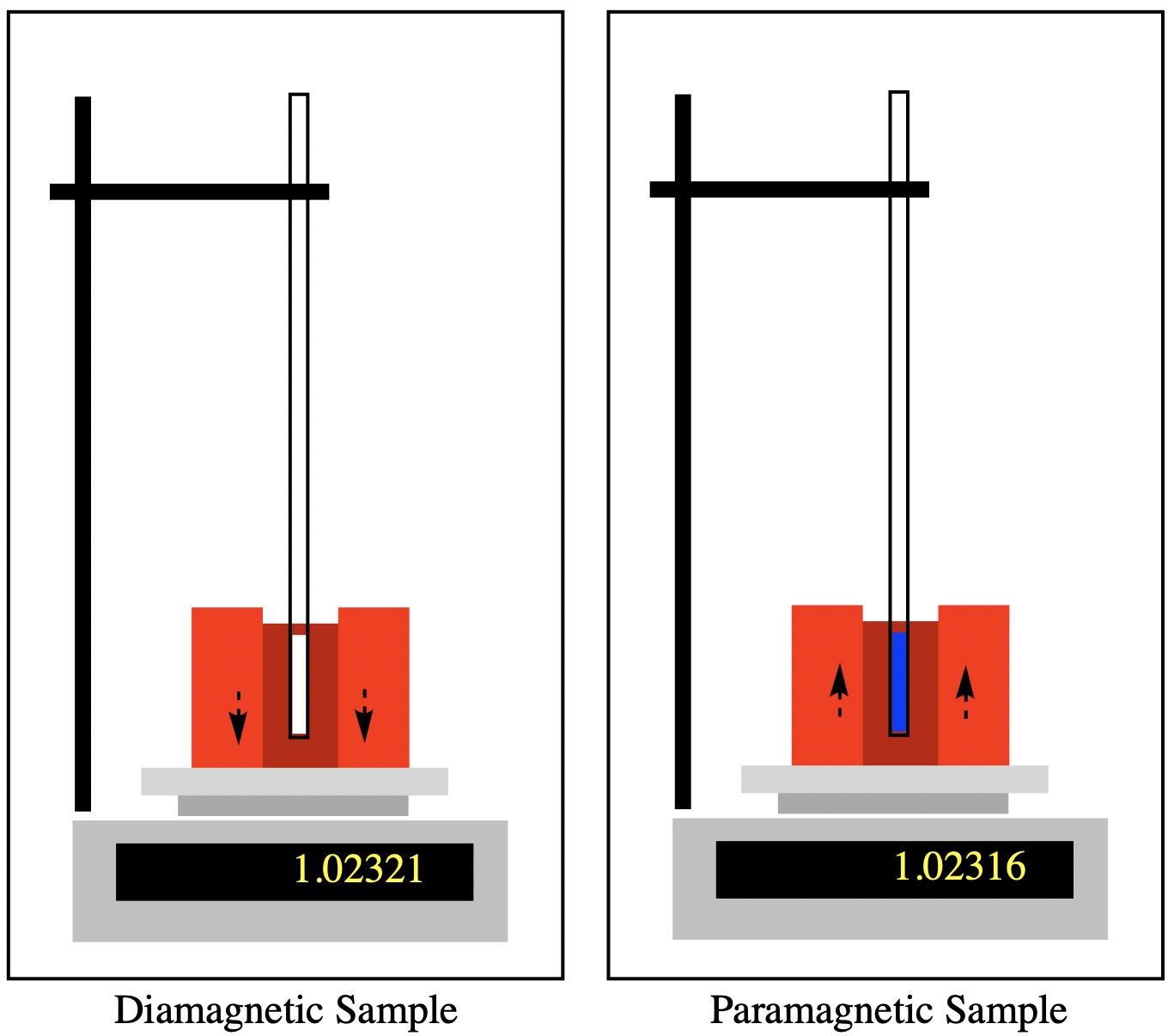
De esa medición, podemos extraer un parámetro al que normalmente nos referimos como el momento magnético efectivo del material,\(\mu_{eff}\). El momento magnético se expresa en unidades llamadas magnetones Bohr. Un magnetón Bohr (BM o\(\mu_{B}\)) se define como:
\[1 \text{BM} =\frac{e h}{4 \pi m c} \nonumber \]
en el que e es la carga sobre un electrón;\(h\) es la constante de Planck;\(m\) es la masa del electrón;\(c\) es la velocidad de la luz.
Esta cantidad experimental se ajusta a una relación simple que depende del número de electrones desapareados. Este modelo matemático da una predicción del momento magnético “spin-only”. Si el momento magnético surge puramente del número de electrones desapareados sin factores de complicación adicionales, el ajuste a los datos experimentales es bastante bueno.
\[\mu_{ eff } \approx \mu_{ so }=g \sqrt{S(S+1)} \nonumber \]
Aquí, g es la relación giromagnética, que es una constante de proporcionalidad entre el momento angular del electrón y el momento magnético. Tiene un valor de 2.00023, o aproximadamente 2.0. El término\(\sqrt{S(S+1)}\) es el valor del momento angular, que depende del número de electrones desapareados; S es el valor absoluto de la suma de los espines individuales de los electrones de valencia. Por supuesto, los giros se cancelarían en electrones que estaban emparejados, porque uno tendría\(m_s = \frac{1}{2}\) y el otro tendría\(m_s = -\frac{1}{2}\). Para los electrones desapareados, la regla de Hund establece que tendrían espines paralelos; por ejemplo, dos electrones desapareados dan\(S=1\).
\ [\ begin {array} {|c|c|c|}\ hline
\ text {Número de} &\ text {Total máximo} &\ text {momento magnético de solo giro,}\\
\ texto {electrones desapareados,} n &\ texto {giro, S} &\ mu_ {so} (BM)\\\ hline
1 &\ frac {1} {2} y 1.73\\
2 y 1 y 2. 83\\
3 &\ frac {3} {2} & 3.87\\
4 & 2 & 4.90\\
5 &\ frac {5} {2} & 5.92\\ hline
\ end {array}\ nonumber\]
La tabla anterior muestra cómo cambia el momento magnético con el número de electrones desapareados. El número máximo de electrones desapareados dado es de cinco, ya que para un metal de transición un sexto electrón tendría que emparejarse en un orbital previamente ocupado. En los elementos del bloque f, podría haber siete electrones desapareados antes de que ocurra el emparejamiento porque hay siete orbitales f en lugar de solo cinco orbitales d.
Tenga en cuenta que la expresión para momento magnético de solo giro a veces se escribe de una manera alternativa, basada directamente en el número de electrones desapareados,\(n\), en lugar de\(S\).
\[\mu_{ eff } \approx \mu_{ so }=\sqrt{n(n+2)} \nonumber \]
Hay una aproximación adicional en estos casos, basada en cómo los valores del momento magnético de solo giro se correlacionan con el número de electrones desapareados. Si siempre redondeamos el valor de\(\mu_{so}\), entonces es uno mayor que el número de electrones desapareados. Así,\(\mu_{so} \approx n + 1\), siempre y cuando por supuesto haya electrones desapareados en absoluto; la relación no se sostiene si n = 0 porque entonces\(\mu_{so}=0\), no 1.
En realidad, los momentos magnéticos observados son ligeramente diferentes a los momentos magnéticos de solo giro. En algunos casos, el momento magnético observado es menor de lo esperado, pero esos casos son más complicados y no los consideraremos aquí. Muy a menudo, los momentos magnéticos observados son mayores de lo previsto porque el momento angular orbital también juega un papel en la determinación de la magnitud del momento magnético general. Podemos usar una expresión modificada que tenga en cuenta esta parte.
\[\mu_{ eff } \approx \mu_{ s + L }=g \sqrt{S(S+1)+\frac{1}{4} L(L+1)} \nonumber \]
Así como S es el valor absoluto de la suma de los números cuánticos de espín en el ion,\(m_s\), L es el valor absoluto de la suma de los números cuánticos orbitales,\(m_l\). Hay cinco orbitales d, con\(m_l= 2, 1, 0, -1, -2\), y el valor de L tiene que maximizarse de acuerdo con la regla de Hund. Eso significa que el valor de L puede ser 3, 2 o 0.
Como ejemplo, supongamos que tenemos un\(\ce{Co^2+}\) ion. \(\ce{Co^2+}\)ion tiene una\(d^7\) configuración. Tiene cinco\(d\) orbitales, por lo que cuatro de estos electrones están emparejados, dejando sólo tres electrones desapareados con espines paralelos, entonces\(S = 3/2\). Para maximizar el número cuántico orbital,\(L\), dos electrones estarán en un orbital con\(m_l= 2\), dos electrones estarán en un orbital con\(m_l=1\), y un electrón estará en cada orbital con\(m_l\) = 0, -1, y -2. Cuando tomamos la suma, nos encontramos\( L = 2 + 2 + 1 + 1 + 0 -1 -2 = 3\). Eso nos da:
\[\mu_{ s + L }=g \sqrt{3 / 2(3 / 2+1)+\frac{1}{4} 3(3+1)}=5.20 \nonumber \]
En comparación,\(m_{so} = 3.87\) en este caso. Los valores observados\(\mu_{eff}\) varían entre diferentes complejos de Co 2 + pero generalmente están en el rango 4.1 — 5.2 BM. 2 La contribución orbital suele ser menor de lo esperado, por lo que las susceptibilidades magnéticas con frecuencia caen en algún lugar entre\(\mu_{so}\) y\(\mu_{S+L}\).
El uso de una balanza Guoy simple es un método históricamente importante para determinar la susceptibilidad magnética, y a veces se usa en experimentos de laboratorio de pregrado. Otros métodos se utilizan frecuentemente para medir la susceptibilidad magnética en el laboratorio de investigación. Un balance de susceptibilidad magnética opera sobre un principio similar al que está detrás del balance Guoy. Se coloca una muestra dentro de los polos de un electroimán, haciendo que el electroimán se mueva muy ligeramente. Se ajusta la corriente en el electroimán, cambiando su campo magnético, hasta que el imán vuelve a su posición inicial. La magnitud del ajuste de corriente es proporcional a la susceptibilidad magnética de la muestra.

Un dispositivo superconductor de interferencia cuántica (SQUID) utiliza un bucle superconductor en un campo magnético externo para medir la susceptibilidad magnética de una muestra. 3 La muestra se mueve mecánicamente a través del bucle superconductor, induciendo un cambio en la corriente y el campo magnético que son proporcionales a la susceptibilidad magnética de la muestra. Los magnetómetros SQUID producidos comercialmente a menudo tienen controles de temperatura variables, lo que permite medir la susceptibilidad magnética en un rango de temperaturas.
El método de RMN Evans es bastante común debido a la amplia disponibilidad de espectrómetros de RMN de alto campo en los laboratorios de investigación. Un capilar que contiene la muestra paramagnética y un analito de referencia se coloca en un tubo de RMN que contiene el mismo analito de referencia pero sin la muestra paramagnética. El analito en presencia del material paramagnético experimentará un campo magnético inducido local debido al efecto del imán superconductor del instrumento de RMN sobre la muestra paramagnética. Sus señales de RMN se desplazarán como resultado. La señal de RMN del analito fuera del capilar no sufrirá tal desplazamiento, y la diferencia en las dos señales es un indicador de la susceptibilidad magnética de la muestra.
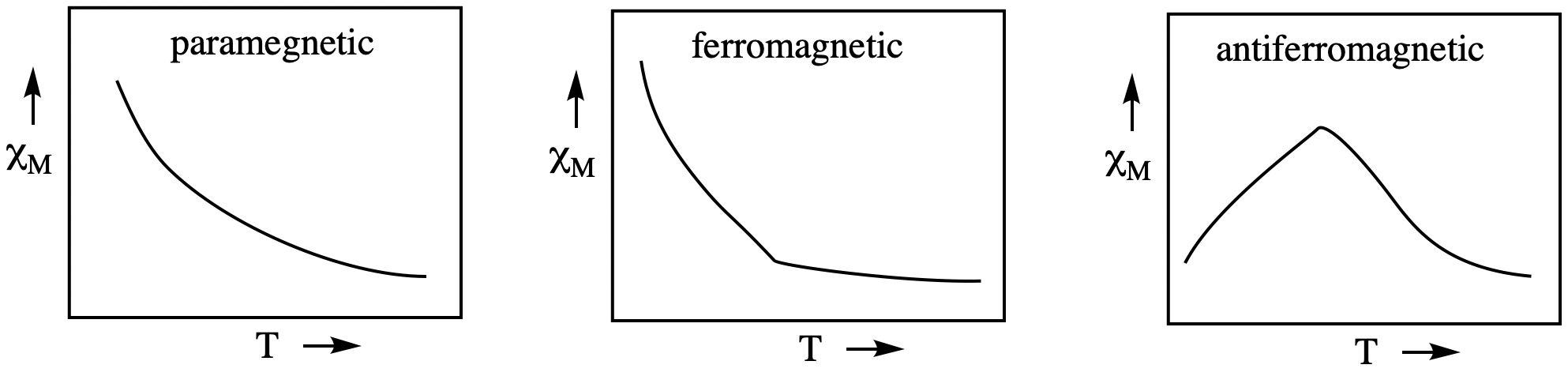
Existen otros tipos de comportamiento magnético además del diamagnetismo y paramagnetismo. Los materiales ferromagnéticos tienen un orden de largo alcance con espines orientados paralelos entre sí, incluso en ausencia de un campo magnético externo. Los imanes permanentes comunes están hechos de materiales ferromagnéticos. Los materiales antiferromagnéticos también tienen orden de largo alcance, pero los momentos magnéticos están dispuestos en pares opuestos. Estos tres comportamientos magnéticos diferentes son diagnosticados por la dependencia de la temperatura de la susceptibilidad magnética. Los materiales paramagnéticos muestran susceptibilidad magnética (\(\chi_M\), relacionada con\(\mu_{eff}\) _) que aumenta con la inversa de la temperatura. Los materiales ferromagnéticos tienen una temperatura crítica por debajo de la cual la susceptibilidad magnética aumenta rápidamente. Los materiales antiferromagnéticos tienen una temperatura crítica por debajo de la cual la susceptibilidad magnética cae rápidamente. Sin embargo, estos comportamientos están en gran parte fuera del alcance de la discusión actual.
Problemas
Demostrar eso, dado g = 2.0, entonces\(g \sqrt{S(S+1)}=\sqrt{n(n+2)}\).
- Contestar
-
\ [\ begin {alineado}
\ mu_ {so} &=g\ sqrt {S (S+1)}\\
&=2\ sqrt {S (S+1)}\\
&=\ sqrt {4 S (S+1)}\\
&=\ sqrt {2 S (2 S+2)}\ end {alineado}\ nonumber\]pero\(S=n(1 / 2)\) o\(n=2 S\) entonces
\[\mu_{ so }=\sqrt{n(n+2)} \nonumber \]
Calcular el valor de\(\mu_{so}\) en los siguientes casos:
a) V 4+ b) Cr 2 + c) Ni 2 + d) Co 3 + e) Mn 2 + f) Fe 2 +
- Contestar
-
a)\(V ^{4+} \text{ is } d ^{1} ; n=1 ; \sqrt{n(n+2)}=1.73\)
b)\(Cr ^{2+} \text{ is } d ^{4} ; n=4 ; \sqrt{n(n+2)}=4.90\)
c)\(Ni ^{2+} \text{ is } d ^{8} ; n=2 ; \sqrt{n(n+2)}=2.83\)
d)\(Co ^{3+} \text{ is } d ^{6} ; n=0 ; \sqrt{n(n+2)}=0\)
e)\(Mn ^{2+} \text{ is } d ^{5} ; n=5 ; \sqrt{n(n+2)}=5.92\)
f)\(Fe ^{2+} \text{ is } d ^{6} ; n=4 ; \sqrt{n(n+2)}=4.90\)
g)\(Cr ^{3+} \text{ is } d ^{3} ; n=3 ; \sqrt{n(n+2)}=3.87\)
h)\(V ^{3+} \text{ is } d ^{2} ; n=2 ; \sqrt{n(n+2)}=2.83\)
Calcular el valor de\(\mu_{eff}\) en los siguientes casos:
a) V 4+ b) Cr 2 + c) Ni 2 + d) Co 3 + e) Mn 2 + f) Fe 2 +
g) Cr 3 + h) V 3+
- Contestar
-
a)\(V ^{4+}\text{ is } d ^{1} ; S=1 / 2 ; L=2 ; \mu_{ s + L }=g \sqrt{1 / 2(1 / 2+1)+\frac{1}{4} 2(2+1)}=3.00\)
b)\(Cr ^{2+}\text{ is } d ^{4} ; S=2 ; L=2+1+0-1=2 ; \mu_{ s + L }=g \sqrt{2(2+1)+\frac{1}{4} 2(2+1)}=5.48\)
c)\(Ni ^{2+}\text{ is } d ^{8} ; S=1 ; L=2+2+1+1+0+0-1-2=3 ; \mu_{ s + L }=g \sqrt{1(1+1)+\frac{1}{4} 3(3+1)}=2.24\)
d)\(Co ^{3+}\text{ is } d ^{6} ; S=2 ; L=2+2+1+0-1-2=2 ; \mu_{ s + L }=g \sqrt{(2+1)+\frac{1}{4} 2(2+1)}=5.48\)
e)\(Mn ^{2+}\text{ is } d ^{5} ; S=5 / 2 ; L=2+1+0-1-2=0 ; \mu_{ s + L }=g \sqrt{5 / 2(5 / 2+1)+\frac{1}{4} 0(0+1)}=5.92\)
f)\(Fe ^{2+}\text{ is } d ^{6} ; S=2 ; L=2+2+1+0-1-2=2 ; \mu_{ s + L }=g \sqrt{2(2+1)+\frac{1}{4} 2(2+1)}=5.48\)
g)\(Cr ^{3+}\text{ is } d ^{3} ; S=3 / 2 ; L=2+1+0=3 ; \mu_{ s + L }=g \sqrt{3 / 2(3 / 2+1)+\frac{1}{4} 3(3+1)}=5.20\)
h)\(V ^{3+}\text{ is } d ^{2} ; S=1 ; L=2+1=3 ; \mu_{ s + L }=g \sqrt{1(1+1)+\frac{1}{4} 3(3+1)}=2.24\)
Referencias
- Lancashire, R. J. Susceptibilidad magnética https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Map%3A_Inorganic_Chemistry_(Housecroft)/04%3A_Experimental_techniques/4.14%3A_Magnetism/Magnetic_Susceptibility_Measurements (consultado Jun 27, 2021).
- Cotton, F.A.; Wilkinson, G. Química Inorgánica Avanzada, 4ª Ed. John Wiley & Sons: Nueva York, 1980, p. 628.
- Raja, P. M. V.; Barron, A. R. Magnetismo https://chem.libretexts.org/@go/page/55872 (consultado el 27 jun. 2021).

