12.3.3: Ley de Tasas para Mecanismos Asociativos
- Page ID
- 81495
Los mecanismos asociativos (A) implican un primer paso donde el ligando entrante se une al ion metálico, creando un intermedio\(\color{red}{\ce{ML_{n}XY}}\),, con un número de coordinación mayor que el del reactivo,\(\ce{ML_{n}X}\).
\ [\ begin {array} {rc}
\ text {Paso 1 (Asociación):} &\ ce {ML_ {n} X + Y <=> [k_1] [k_ {-1}]}\ color {rojo} {\ ce {ML_ {n} XY}}\
\ texto {Paso 2 (Disociación):} &\ textcolor {rojo} {\ ce {ML_ {n}}}\ ce {<=> [k_2] [k_ {-2}] ML_ {n} Y + X}\\
\ hline\ text {Reacción general:} &\ ce {ML_ {n} X + Y <=> ML_ {n} Y + X}
\ final {matriz}\ nonumber\]
Para determinar la ley de tarifas, podemos usar un proceso similar al que seguimos para los mecanismos D, que también son dos pasos. Suponiendo que\(k_2 >> k_{-2}\), la tasa de formación del producto a partir del segundo paso es:\[\frac{d\ce{[ML_{n}Y]}}{dt} = k_2 \textcolor{red}{\ce{[ML_{n}XY]}} \nonumber \]
La aproximación de estado estacionario permite suponer que el intermedio está en baja concentración (demasiado baja para ser medido de manera confiable) y que es inmutable. Podemos usar la ley de tarifas para el primer paso para encontrar\(\color{red}{\ce{[ML_{n}XY]}}\) en términos de especies que puedan medirse de manera confiable.
\[\frac{d\textcolor{red}{\ce{[ML_{n}XY]}}}{dt} = k_1 \ce{[ML_{n}X][Y]}-k_{-1}\textcolor{red}{\ce{[ML_{n}XY]}} - k_2\textcolor{red}{\ce{[ML_{n}XY]}}=0 \nonumber \]
... resolviendo esta ley de primer paso para\(\textcolor{red}{\ce{[ML_{n}XY]}}\) dar\(\textcolor{red}{\ce{[ML_{n}XY]}} = \dfrac{k_1\ce{[ML_{n}X][Y]}}{k_{-1}+k_2}\)
Y luego sustitución\(\textcolor{red}{\ce{[ML_{n}XY]}}\) en la ley de tarifas para el segundo paso, y let\(k=\frac{k_1 k_2}{k_{-1}+k_2}\) to da la ley general de tarifas a continuación.
\[\frac{d\ce{[ML_{n}Y]}}{dt} = \frac{k_1 k_2 \ce{[ML_{n}X][Y]}}{k_{-1}+k_2} = k \ce{[ML_{n}X][Y]} \nonumber \]
Esta ley general de tasa es de segundo orden, y de primer orden con respecto a cada uno de los reactivos. Esto significa que existe una relación directa (lineal) entre la concentración de cualquiera de los reactivos y la velocidad de reacción.
¿Por qué el mecanismo asociativo depende de las concentraciones de esta manera específica?
Este es un caso de dos moléculas que se unen. Si ambos compuestos se disuelven en solución, deben “nadar” o viajar a través de la solución hasta que choquen entre sí y reaccionen. Cuanto más concentrada esté la solución, o cuanto más llena esté de moléculas, más probabilidades hay de que los reactivos choquen entre sí. Si duplicamos la cantidad de nuevo ligando en solución, un encuentro entre ligando y complejo se vuelve el doble de probable. Si duplicamos la cantidad de complejo metálico en solución, un encuentro también se vuelve el doble de probabilidades.

Figura\(\PageIndex{1}\): Efecto de la concentración sobre la probabilidad de colisión. En el primer vaso de precipitados, existe la posibilidad de que una molécula negra y una molécula blanca se encuentren y reaccionen juntas. La posibilidad de un encuentro es mucho mayor tanto en el segundo vaso de precipitados, donde hay muchas más moléculas negras, como en el tercer vaso de precipitados, donde hay muchas más moléculas blancas.
Dada la ley de tasa asociativa anterior, ¿qué pasaría con la velocidad de reacción para una sustitución asociativa en los siguientes casos?
- la concentración de ligando se duplica y la concentración de complejo metálico se duplica
- la concentración de ligando se triplica y la concentración de complejo metálico se duplica
- la concentración de ligando se triplicó, y la concentración de complejo metálico se triplicó
- la concentración de ligando se reduce a la mitad, y la concentración de complejo metálico se duplica
- Contestar a
-
Ley de Tasa Asociativa:\(Rate = [ML_{n}][X]\), if MLn is the complex and X is the new ligand.
Tarifa cuadruplicará:\(Rate = (2 \times [ML_{n}]_{0}) \times (2 \times [X]_{0})= 4 \times [ML_{n}]_{0}[X]_{0}\), if [X]0 and [MLn]0 are the original concentrations.
- Respuesta b
-
La tarifa se sextuplicará:\(Rate = (3 \times [ML_{n}]_{0}) \times (2 \times [X]_{0}) = 6 \times [ML_{n}]_{0}[X]_{0}\) .
- Respuesta c
-
La tarifa no será uple:\(Rate = (3 \times [ML_{n}]_{0}) \times (3 \times [X]_{0}) = 9 \times [ML_{n}]_{0}[X]_{0}\).
- Respuesta d
-
La tarifa se mantendrá igual:\(Rate = (0.5 \times [ML_{n}]_{0}) \times (2 \times [X]_{0}) = 1 \times [ML_{n}]_{0}[X]_{0}\).
Grafica gráficas de tasa inicial vs. concentración para mostrar lo que verías en la sustitución asociativa.
a) La concentración de nuevo ligando, [X], se mantiene constante en 0.1 mol/L y la concentración de complejo metálico se cambia de 0.5 mol/L a 1 mol/L y luego a 1.5 mol/L.
b) La concentración de complejo metálico, [ML n], se mantiene constante a 0.1 mol/L y la concentración de ligando se cambia de 0.5 mol/L a 1 mol/L y luego a 1.5 mol/L.
- Contestar
-
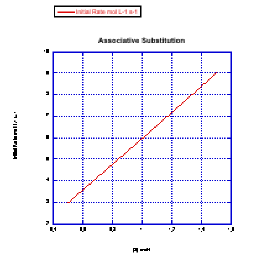
In the previous problem, the experiment was run in a particular way for particular reasons.
a) Why was one concentration held constant while the other one was changed? Why not change both?
b) Why does the graph report "initial rate" -- just the rate at the very beginning of the reaction?
- Answer a
-
Changing both concentrations at once would leave some doubt about whether one concentration had affected the rate, or the other concentration, or both. In practice, one concentration is usually held constant while the other is kept in excess and varied.
- Answer b
-
Rate changes over time because the concentrations of reactants change as they are consumed. By reporting only the initial rate (usually meaning less than 5% or 10% complete, but possibly even less than that if a lot of data can be gathered very quickly), the concentrations are still about what you started with. That means you can report a rate that corresponds to a given concentration with confidence.
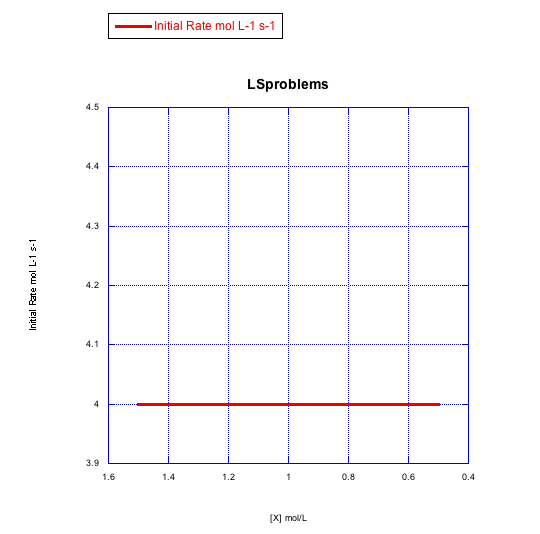
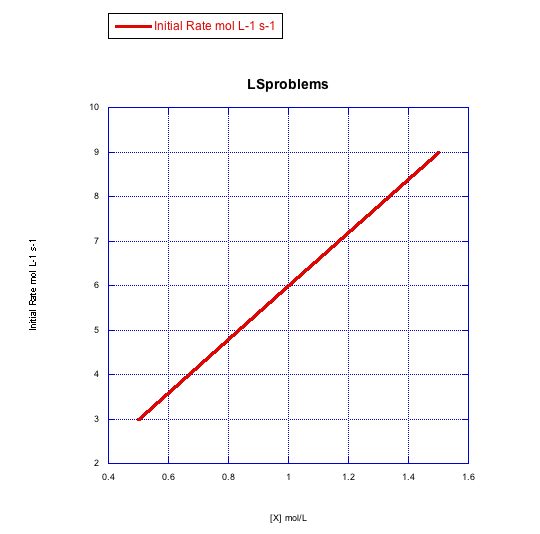
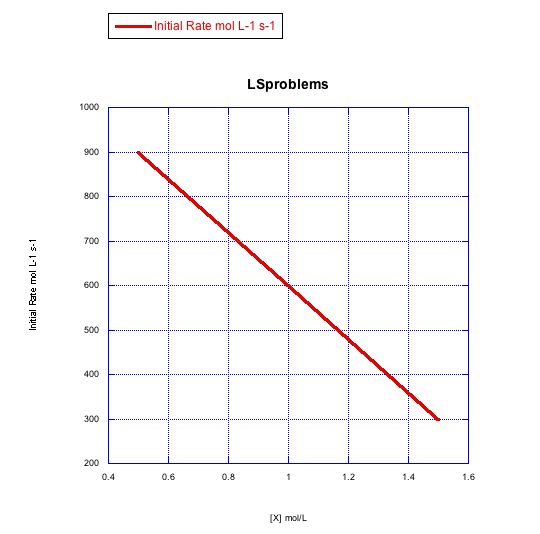
Given the following sets of initial rate data (rates measured at the beginning of a reaction), determine whether each case represents an associative substitution.
a)
b)
c)
d)
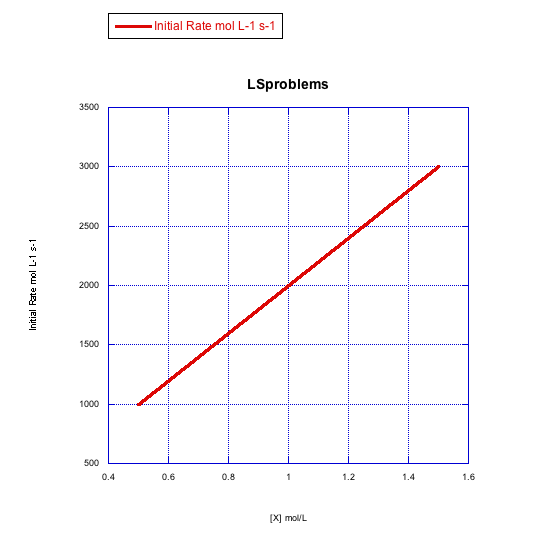
Contestar a-
La tasa cambiaría con la concentración de ligando si es asociativa. Esta velocidad es constante en un rango de concentraciones de ligando, por lo que la reacción no es asociativa.
- Respuesta b
-
La tasa aumenta linealmente con la concentración de ligando. Esta reacción procede a través de un mecanismo asociativo.
- Respuesta c
-
La tasa cambia a lo largo del rango de concentración, pero disminuye. Esto es lo contrario de lo que debería suceder. Esta reacción no sigue un simple camino asociativo.
- Respuesta d
-
La tasa aumenta linealmente con la concentración de ligando. Esta reacción procede a través de un mecanismo asociativo.
Qué información se puede obtener de las pendientes de líneas en Ejercicio\(\PageIndex{4}\) ?
- Contestar
-
Porque\(Rate = k[ML_{n}][L]\) is held constant while [L] is varied, then the slope of the line is k [MLn]. Since you would know the value of [MLn], you could obtain the rate constant from the quantity (slope/ [MLn]).
Tenga en cuenta que la ley de velocidad para un mecanismo A, y un mecanismo I reversible son de la misma forma: cada uno es de primer orden con respecto a cada reactivo. Por lo tanto, una determinación inequívoca entre los dos es difícil porque requeriría la detección del intermedio, que existe sólo a una concentración muy baja.


