13.5.2: Sistemas π cíclicos
- Page ID
- 81082
Los ligandos arenos o aromáticos son el tema de este post, el segundo de nuestra serie sobre ligandos del sistema π. Los arenos son ligandos dativos tipo L que pueden servir como actores o espectadores. Los arenos comúnmente se unen a los metales a través de más de dos átomos, aunque se conocen ligandos η2-areno. Estructuralmente, la mayoría de los η6-arenos tienden a permanecer planos después de unirse a los metales. Tanto el enlace “normal” como el backbonding son posibles para los ligandos de areno; sin embargo, los arenos son donantes de electrones más fuertes que el CO y el backbonding es menos importante para estos ligandos. La reactividad de los arenos cambia drásticamente al unirse al metal, siguiendo las líneas que esperaríamos para ligandos fuertemente donadores de electrones. Después de coordinarse a un metal de transición, el areno generalmente se convierte en un mejor electrófilo (particularmente cuando el metal es pobre en electrones). Por lo tanto, la coordinación metálica puede permitir reacciones de sustitución aromática nucleofílica de otro modo difíciles.
Propiedades Generales
La coordinación de un compuesto aromático a un centro metálico a través de su π MOS aromático elimina la densidad de electrones del anillo. Voy a renunciar a un análisis orbital en profundidad en este post, porque honestamente no es muy útil (y demasiado complejo) para los ligandos arenos. π → dσ (enlace normal) y dπ → π* (backbonding) las interacciones orbitales son posibles para los ligandos de areno, siendo el primero mucho más importante, típicamente. Para simplificar los dibujos, a menudo ve a los químicos dibujar arenos de “inodoro” que involucran un círculo y una sola línea central para representar la interacción orbital π → dσ. A pesar de la línea única, a menudo es útil pensar en los arenos como ligandos de tipo L3. Por ejemplo, pensamos en η6-arenos como donantes de seis electrones.
Múltiples modos de coordinación son posibles para los ligandos de areno. Cuando los seis átomos de un anillo de benceno están unidos al metal (modo η6), el anillo es plano y las longitudes de los enlaces C—C son ligeramente más largas que las del areno libre. El anillo es doblado y no aromático en modo η4, de manera que los cuatro átomos unidos al metal son coplanarios mientras que el otro enlace π está fuera del plano. Los ligandos η4-areno aparecen tanto en complejos estables (ver la figura a continuación) como en intermedios reactivos que poseen un sitio de coordinación abierto. Para generar este último, el ligando η6-areno correspondiente sufre deslizamiento del anillo, uno de los enlaces π “se desliza” del metal para crear un sitio de coordinación abierto. Veremos nuevamente el deslizamiento del anillo en las discusiones sobre los ligandos aromáticos de ciclopentadienilo e indenilo.
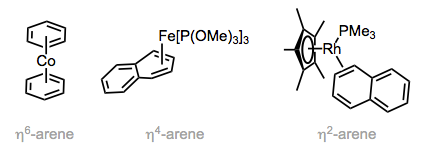
Los ligandos de areno presentan múltiples modos de coordinación.
Incluso los ligandos η2-areno unidos a través de un doble enlace son conocidos. La coordinación de un enlace π da como resultado la desaromatización y hace que el η2-benceno se comporte más como butadieno, y el furano actúe más como un éter vinílico. Con el naftaleno como ligando, existen múltiples isómeros η2 que podrían formarse; el isómero observado es el que retiene la aromaticidad en la porción libre del ligando. De hecho, este resultado es general para los hidrocarburos aromáticos policíclicos: la unión maximiza la aromaticidad en la porción libre del ligando. En la referencia ligada, los autores incluso observaron la coordinación de dos centros de rodio diferentes con la naftaleno, ¡un ligando de areno puente! Otros modos de puente incluyen la unión σ, π (el areno es un ligando de tipo LX, y un enlace C-M es covalente, no dativo) y el puente de tipo L2 a través de dos sistemas π distintos (como en bifenilo).
Los ligandos de areno suelen ser hidrocarburos, no heterociclos. ¿Por qué? Los heterociclos aromáticos, como la piridina, se unen más comúnmente usando sus pares solitarios básicos. Dicho esto, algunos heterociclos forman complejos π importantes. El tiofeno es quizás el más estudiado, ya que la desulfuración del tiofeno a partir de combustibles fósiles es un proceso industrialmente útil.
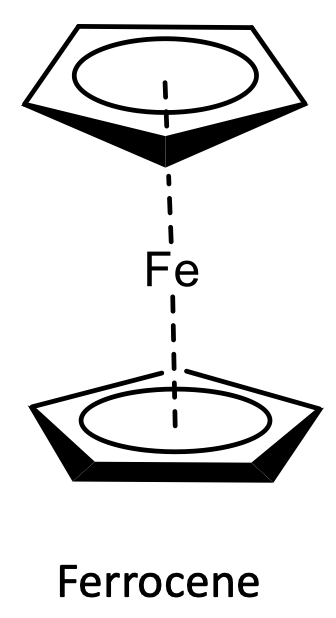
Adhesión en Ferroceno
El ferroceno fue el primer metaloceno en ser descubierto y caracterizado. A continuación se muestra la estructura del ferroceno.
¿La estabilidad de la estructura del ferroceno también puede ser explicada por la teoría orbital molecular? ¡Vamos a comprobarlo! Primero, tenemos que decidir sobre el grupo de puntos. Haremos la simplificación de que los dos anillos de ciclopentadienilo C p están en formación eclipsada, y luego el grupo puntual es D 5h. En realidad, los anillos están en confirmación escalonada y el grupo de puntos es D 5d, pero la diferencia de energía es mínima, y hay una barrera de activación muy pequeña entre los dos confórmeros.
\ begin {array} {|c|rrrrrrrrr|cc|}
\ hline\ bf {D_ {5h}} & E & 2C_5 & 2C_5 & 2C_5^2 & 5C_2 &\ sigma _h & 2S_5 & 2S_5^2 & 5\ sigma_h & h=20 &
\\ hline A_ {1} 'y 1 & 1 & 1 & 1 & 1 & 1 & 1 & 1 & & & x^2+y^2,\; z^2\\ A_ {2} '& 1 & 1 & 1 & -1 & 1 & 1 & 1 & -1 & r_z &\\
E_ {1}' & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & (x,\; y) &\\
E_ {2} 'y 2 & 2cos (144 ^ { \ circ}) & 2cos (72 ^ {\ circ}) & 0 & 2 & 2cos (144 ^ {\ circ}) & 2cos (72 ^ {\ circ}) & 0 & & (x^2-y^2,\; xy)\\
A_ {1}” & 1 & 1 & 1 & -1 & -1 & -1 & & -1 & &\\
A_ {2}” & 1 & 1 & 1 & -1 & -1 & -1 & -1 & 1 & z &\\
E_ {1}” & 2 & 2cos (72 ^ {\ circ}) & 2cos (144 ^ {\ circ}) & 0 & -2 & -2cos (72 ^ {\ circ}) & -2cos (144 ^ {\ circ}) & 0 & (R_x,\; R_y) & (xz,\; yz)\\
E_ {2}” & 2 & 2cos (144 ^ {\ circ}) & 2cos (72 ^ {\ circ}) & amp; 0 & -2 & -2cos (144 ^ {\ circ}) & -2cos (72 ^ {\ circ}) & 0 & &\\
\ hline\ end {array}
Podemos definir el eje z de pie perpendicular a los anillos Cp, y el plano xy para ser coplanario con los anillos Cp.
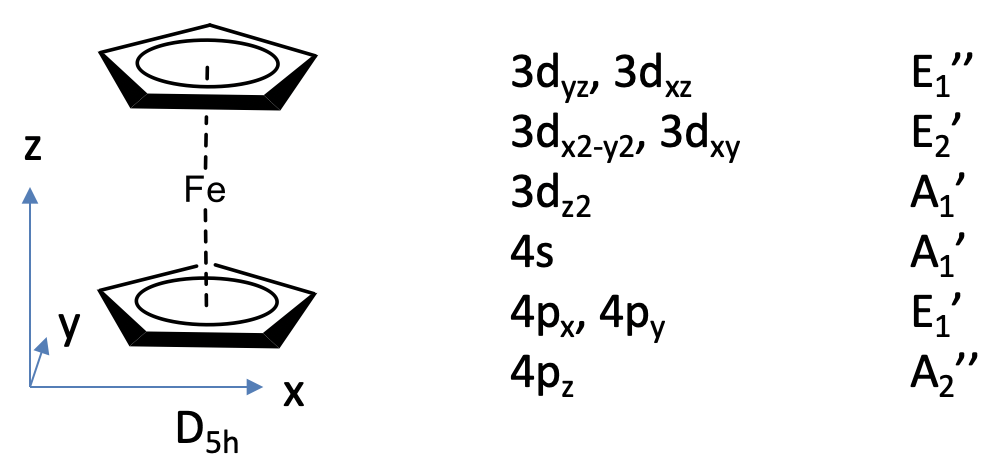
Los orbitales Fe 3d, 4s y 4p serán nuestros orbitales fronterizos y podremos leer sus tipos de simetría en la tabla de caracteres de D 5h. El 3d xz y 3d yz tienen E 1” simetría, el 3d x 2 -y 2 y el 3d xy tienen E 2 'simetría, el 3d z 2 tiene A 1' simetría, el 4s tiene simetría A 1 ', y los orbitales 4p x y 4p y tienen simetría E 1', y el 4p z tiene simetría A 2”.
A continuación, necesitamos determinar los orbitales del grupo de ligandos. Sabemos que los orbitales moleculares del ligando π son los que donan los electrones a los orbitales metálicos, por lo que tenemos que tener una mirada más cercana a estos orbitales. Los π-MOS del ligando están hechos de los cinco orbitales 2p z de los átomos de carbono que se encuentran perpendiculares al anillo. Esto significa que hay 5 MO a considerar.
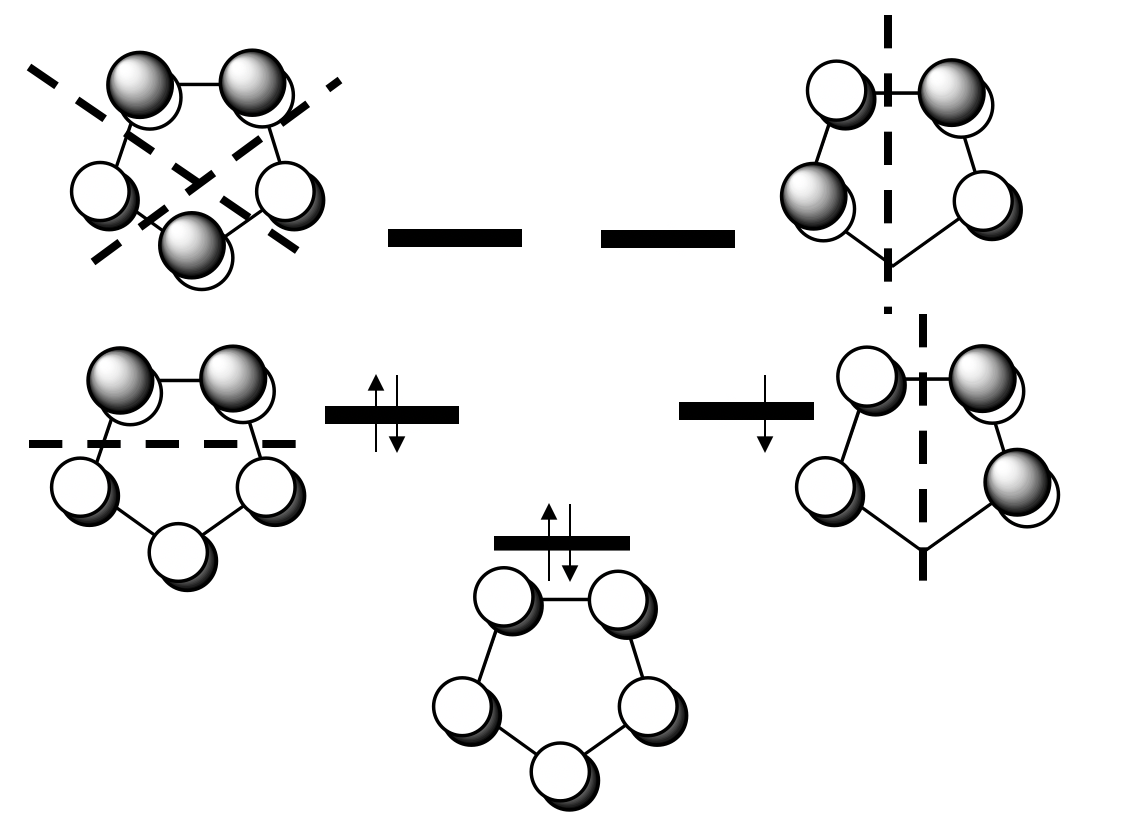
Se pueden ver los cinco MOs y su energía relativa arriba. Uno está fuertemente unido y no tiene nodo. Entonces, hay dos de doble generación débilmente enlazados que tienen un nodo, y finalmente hay dos anti-bonding que tienen dos nodos. Debido a que el anión ciclopentadienilo tiene seis electrones π, el MO de enlace y los dos MO de enlace débil están llenos, los MO antiunión están vacíos.
Debido a que tenemos dos aniones Cp - a considerar tenemos en general 10 MO para combinar. Por lo tanto, esperaríamos diez orbitales de grupos de ligandos (LGO). Podemos determinar su tipo de simetría determinando las representaciones reducibles e irreducibles. A continuación se muestran los resultados.
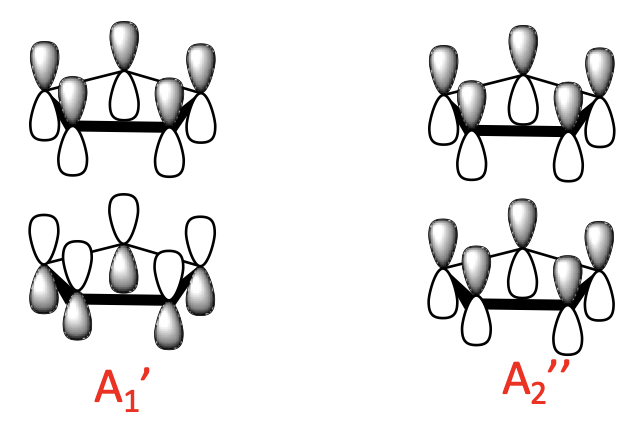
Generalmente podemos dividir las LGO en tres grupos con un número diferente de nodos. Hay dos LGO de 0 nodos con simetría A 1 'y A 2”. Se elaboran a partir de los MO de 0 nodos del ligando. Hay una unión y una combinación anti-adhesión posible. En la combinación de unión, los MOs del ligando de 0 nodos tienen los lóbulos con el mismo signo algebraico apuntando uno hacia el otro. La combinación anti-unión tiene los lóbulos con signo algebraico opuesto apuntando uno hacia el otro.
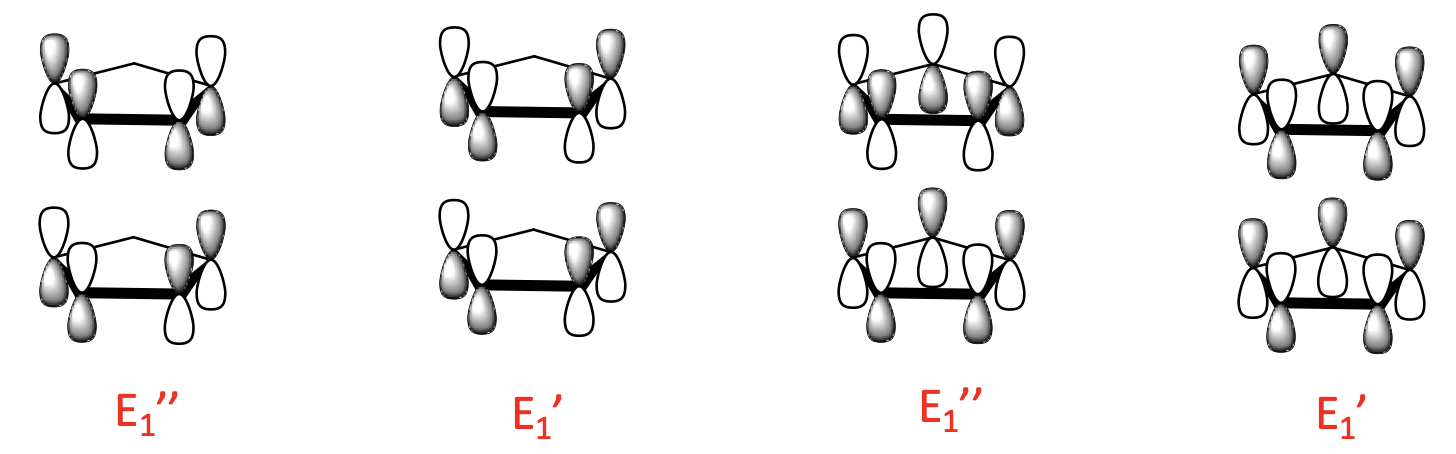
Hay cuatro LGO de 1 nodo con simetría E 1 'y E 1”. Se construyen a partir de los dos MO de ligando de 1 nodo. Al igual que para los orbitales de 0 nodos, existe una combinación de unión y anti-unión posible.
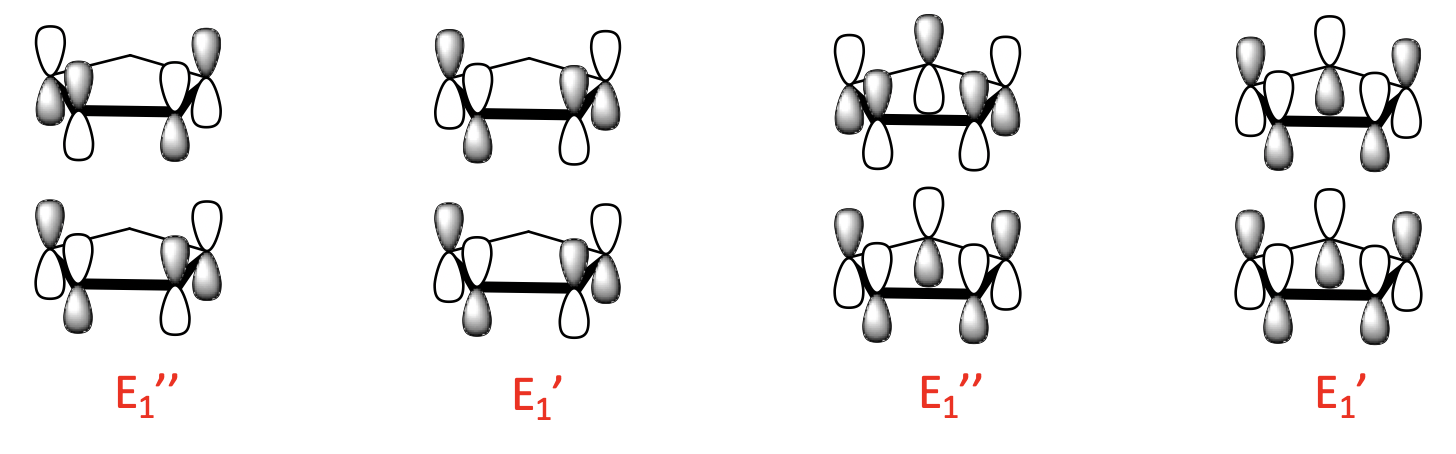
Finalmente, hay cuatro LGO de 2 nodos con simetría E 2 'y E 2”. Están hechos del ligando de 2 nodos MoS y también hay una unión y una combinación anti-unión posible.
El diagrama orbital molecular del ferroceno
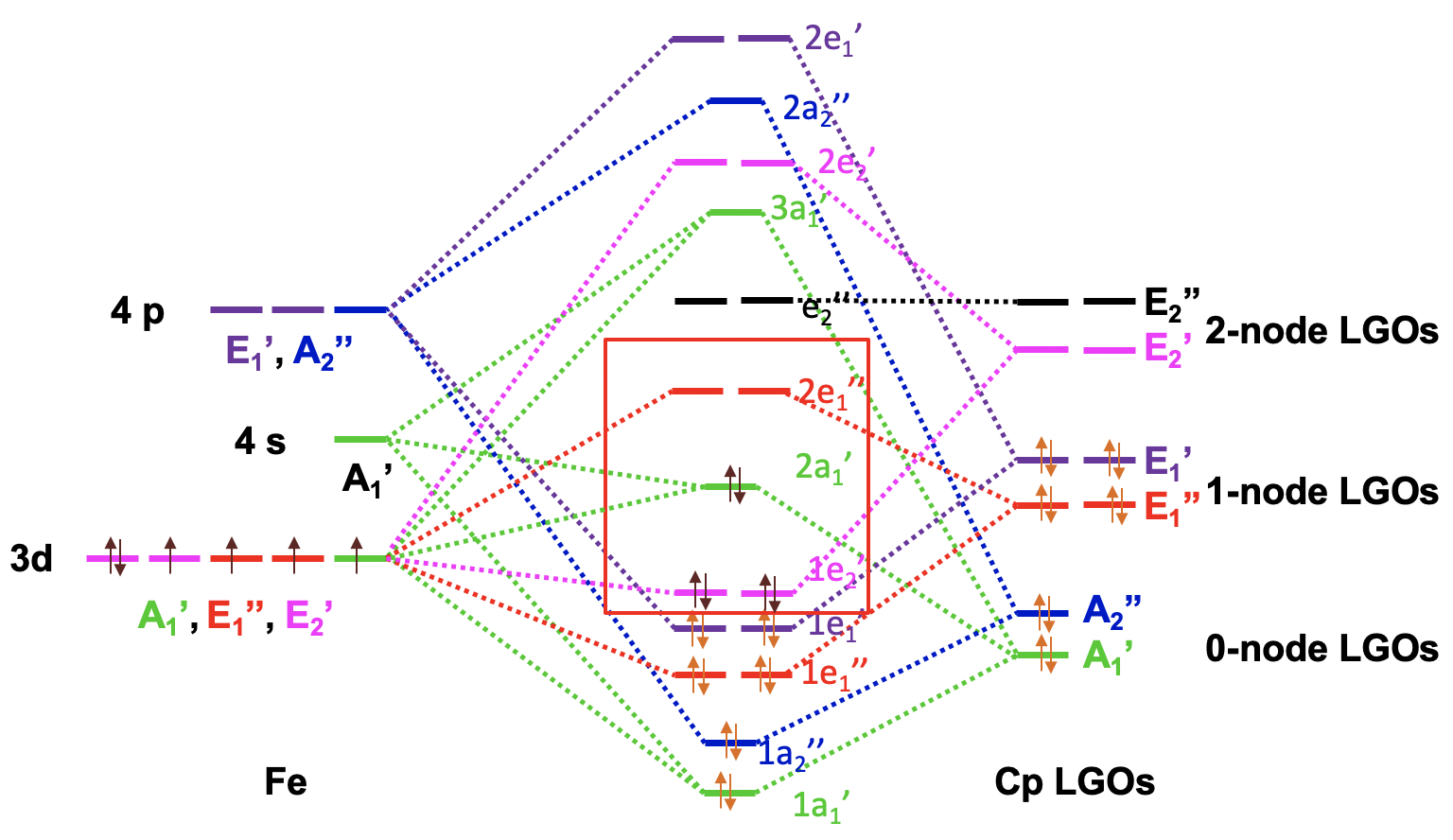
Ahora tenemos toda la información para dibujar el diagrama orbital molecular del ferroceno. Como de costumbre trazamos los orbitales de frontera metálica a la izquierda y etiquetamos su simetría. Trazamos los Cp LGO a la derecha y también etiquetamos la simetría. Podemos ordenar los LGO de acuerdo con la energía con los LGO de 0 nodos que tienen la energía más baja y los LGO de 2 nodos que tienen la mayor energía. Entonces, podemos comenzar a combinar orbitales del mismo tipo de simetría para formar MO. Hay dos AOs metálicos del tipo A 1 'y un LGO A 1' que dan tres MO de este tipo de simetría, uno de unión, uno aproximadamente sin unión y tercero un antiadherencia. Podemos conectar AO, LGO y MO con líneas punteadas. A continuación, podemos combinar el A 2” AO y el A 2” LGO para formar una unión y una MO antiadhesión. Nuevamente conectamos los AO, las OGs y los MO con líneas punteadas. Entonces, podemos producir dos MoS de unión e 1” y dos anti-unión e 1” MO a partir de los AE metálicos E 1” y los IgO E 1” y conectar los orbitales con líneas punteadas. Hay dos E 1 'LGO y dos E 1' AOs que se pueden combinar en dos 1e 1 'de unión y dos 2e 1' MO antiadhesión y nuevamente conectamos los orbitales con líneas punteadas. Los dos E 2 'LGO se pueden combinar con los dos orbitales E 2' d para formar un par de orbitales moleculares de enlace 1e 2 'y anti-unión 2e 2'. Por último, notamos que los LGO E 2” no encuentran pareja, y tenemos que escribirlos como no vinculantes con la misma energía en el diagrama MO.
Ahora necesitamos llenar los electrones en los orbitales. Los ligandos tienen doce electrones en total. Se pueden llenar en los seis orbitales de la energía más baja. Esto llena los orbitales 1a 1 ', 1a 2”, 1e 1”, y 1e 1'. Observamos que todos los MO están enlazando lo que apoya la estabilidad de la molécula. Aún tenemos que considerar los orbitales d metálicos. Tenemos un ion Fe 2 + y así seis electrones d metálicos. Entrarían en el orbital 1e 2 'que está uniendo y el orbital 2a 1' que se une débilmente. El 2a 1 es el HOMO, y el siguiente superior 2e 1” es el LUMO. Podemos ver que podemos llenar todos los electrones metálicos en MO de unión. El LUMO es un orbital antiunión y, por lo tanto, en general, todos los MO de unión están llenos, y no es necesario llenar orbitales sin unión y antiunión. Esta es la situación ideal para una molécula estable. También podemos ver que el diagrama MO explica la regla de 18 electrones. Todos los 18 electrones están en MO de unión.
Podemos considerar los d-orbitales 1e 2 ', 2a 1' y 2e 1” metálicos en el campo ligando producido por los ligandos CP ya que estos 5 orbitales pueden contener el número máximo posible de 10 electrones d, tener energía similar a la de los orbitales d, y tener contribuciones de ellos.
Metalocenos con otros ligandos p cíclicos
¿Es posible hacer metalocenos con otros anillos conjugados con π pero el anión cilopentadienilo?
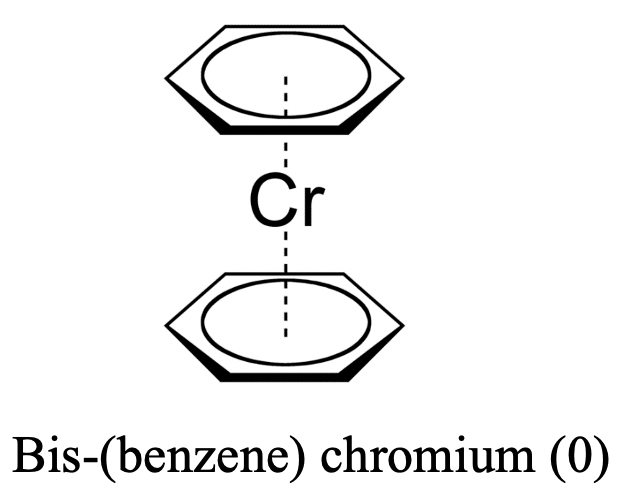
La respuesta es sí, por ejemplo se sabe que el benceno actúa como ligando bis- (benceno) cromo (0). En este caso el ligando actúa como un ligando 6 porque los seis átomos de carbono están involucrados en el enlace. ¿Por qué el cromo da un complejo estable de metaloceno con benceno? Esto lo podemos explicar de nuevo con la regla de los 18 electrones. En el bis- (benceno) cromo (0), el cromo se encuentra en el estado de oxidación 0 debido a que el ligando de benceno no tiene carga. Así, el cromo aporta seis electrones. Al sumar los 12 electrones π de los dos ligandos de benceno se obtienen 18 electrones.
Otros ligandos p cíclicos
También el ciclobutadieno puede actuar como un ligando p cíclico en complejos. El ciclobutadieno es diferente del anión ciclopentadienilo y el ligando de benceno de dos maneras. En primer lugar, tiene mucha más cepa de anillo que las dos anteriores, y en segundo lugar no es un ligando aromático, sino un ligando antiaromático. Recuerde, tenemos un anillo aromático cuando hay 4n+2 π-electrones, donde n es un número inter. Esto significa que los anillos con dos (n=0), seis (n=1) y diez (n=2) π-electrones son aromáticos. Los anillos antiaromáticos son aquellos que tienen 4n electrones, como cuatro (n=1), ocho (n=2) y así sucesivamente. El ciclobutadieno tiene cuatro electrones, y por lo tanto es antiaromático. Los anillos antiaromáticos son menos estables que los aromáticos porque no todos los electrones π están en orbitales moleculares enlazados. Ilustremos esto construyendo el diagrama MO para el sistema π de la molécula de ciclobutadieno (Figura\(\PageIndex{25}\))
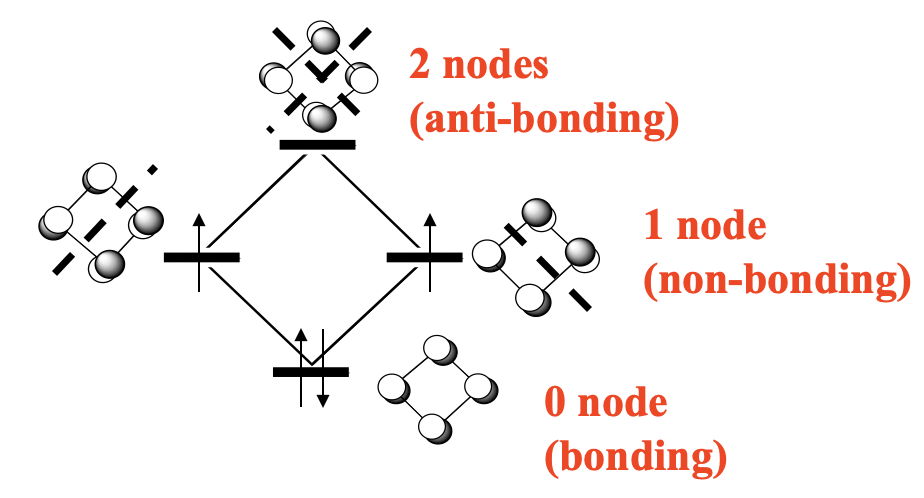
El sistema π está compuesto por cuatro átomos de carbono que aportan un orbital 2p z medio lleno cada uno (si definimos el plano de la molécula como el plano xy). Eso hace cuatro orbitales p con cuatro electrones que dan cuatro orbitales moleculares. Hay un MO de unión sin nodo, dos dos no vinculantes doblemente degenerados con un nodo y uno anti-vinculación con dos nodos (Figura\(\PageIndex{25}\)). Hay cuatro electrones. Podemos llenar dos electrones en el MO de unión, pero los otros dos deben entrar en los dos no enlazantes bajo obediencia al gobierno de Hund.
Distorsión Jahn-Teller en ciclobutadieno
Uno puede pensar que el ciclobutadieno es una molécula plana cuadrada debido a la deslocalización completa de los electrones π, pero en realidad ese no es el caso. Hay dos dobles enlaces más cortos y dos enlaces simples más largos, y la forma de las moléculas es un rectángulo. Esto significa que los dos dobles enlaces están localizados. Podemos ver este efecto como una distorsión de Jahn-Teller.
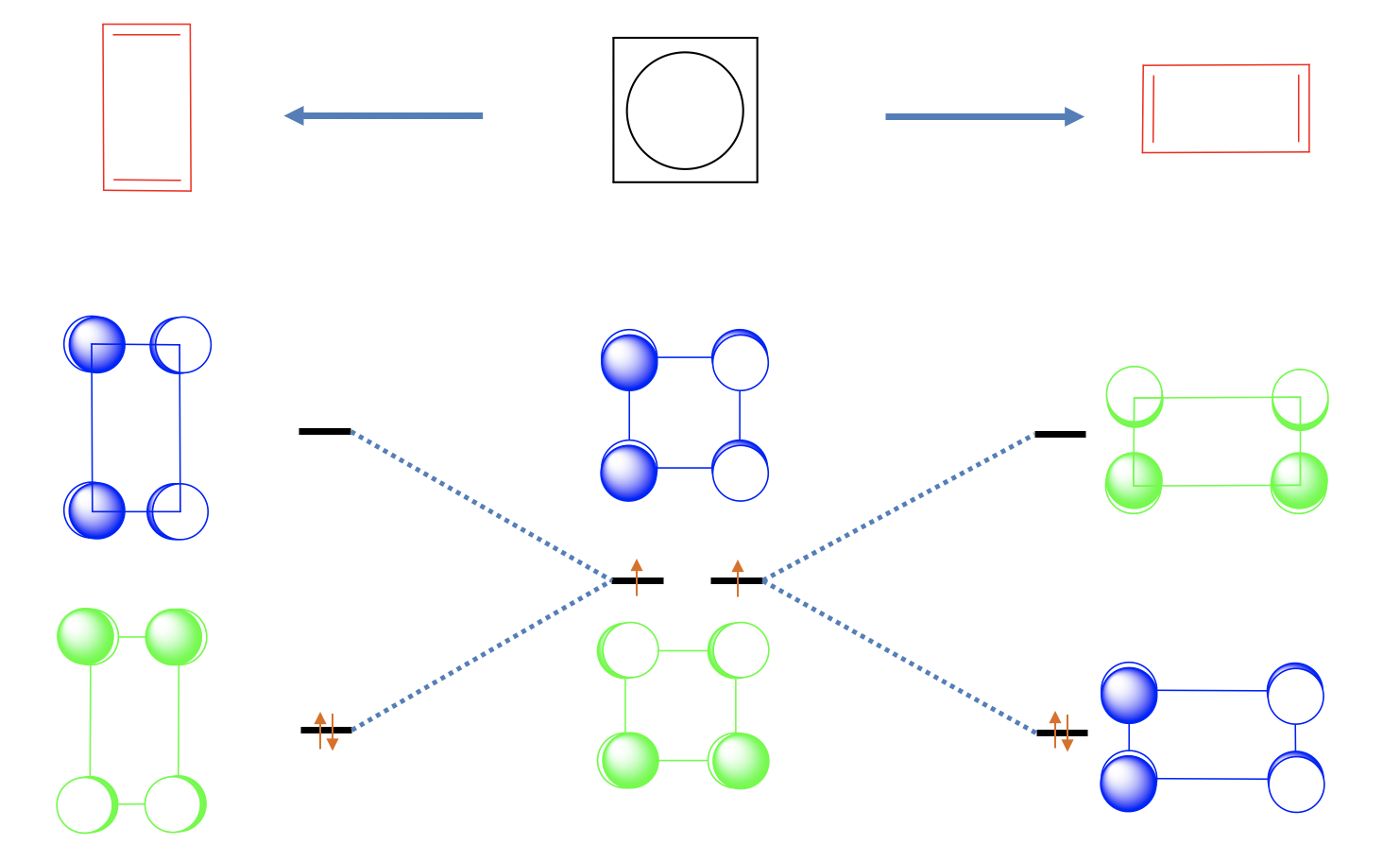
La distorsión del cuadrado para formar un rectángulo es energéticamente favorable porque disminuye la energía de los dos electrones no enlazantes. ¿Por qué? Veamos primero el orbital sin unión 1 y alarguemos en la dirección x, y apretemos en dirección y (Figura\(\PageIndex{26}\)). Podemos ver que separamos más los orbitales p con interacciones de unión, y acercamos a aquellos con interacciones antienlace. Esto significa que la energía de este orbital sube y el orbital se vuelve antienlace. Hagamos lo mismo con orbitales no adherentes 2. Vemos que sucede lo contrario. Las interacciones de unión se mejoran y las interacciones anti-unión se debilitan. Por lo tanto, este orbital se convierte en unión y la energía baja. Ahora podemos llenar los dos electrones en el MO de unión. Vemos que hemos bajado la energía de los electrones a través de la distorsión.
También podríamos haber exprimido en dirección x y alargado en dirección y. En este caso orbital 1 se habría convertido en unión y orbital 2 antiadhesión. Sin embargo, esta distorsión es simetría-equivalente a la anterior, y no produce una nueva molécula. Ambas moléculas pueden superponerse mediante una simple rotación de 90°.
Ciclobutadieno como ligando 4
El ciclobutadieno (Cb) en su forma libre no es estable debido a la alta cepa del anillo y la antiaromaticidad, pero los complejos con ciclobutadieno como ligando son estables. Se esperaría que 18 complejos de electrones sean los más estables.
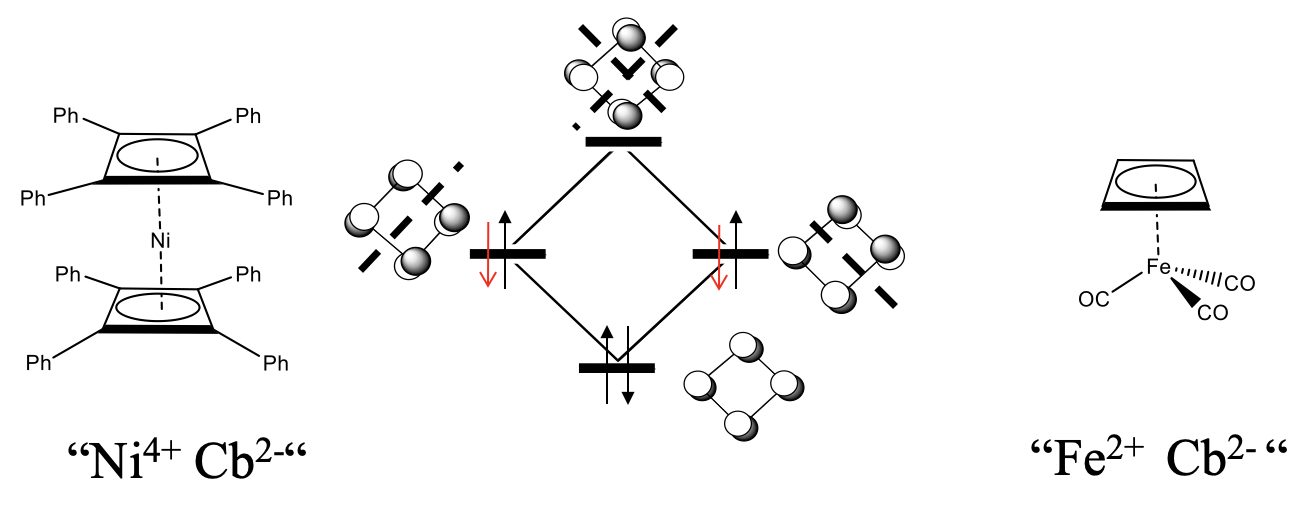
¿Qué sería un complejo sándwich de 18 electrones con dos ligandos de ciclobutadieno? Debido a que cada ciclobutadieno aporta cuatro electrones, diez electrones necesitarían provenir del metal, y esperaríamos un complejo de ciclobutadienilo de níquel Ni (Cb) 2. Este complejo no se conoce, pero los derivados sí. Por ejemplo, se conoce un complejo de Ni con dos ligandos de tetrafenil-butadieno (Figura\(\PageIndex{27}\)). Otro ejemplo es el complejo butadieniltricarbonil hierro (0). Curiosamente, cuando el ciclobutadieno actúa como un ligando 4, entonces no se distorsiona, sino plano cuadrado. Una explicación es que podemos tratar formalmente el ligando de ciclobutadieno como un ligando Cb 2 que se une a un catión metálico. Por ejemplo en FeCB (CO) 3 el Fe sería un Fe 2 +, en el complejo de níquel, el níquel sería un Ni 4 +. El anión Cb 2 - sería formalmente aromático porque tiene 4n+2=6 electrones. Los dos electrones adicionales estarían en los orbitales no enlazantes. Debido a que los dos orbitales no vinculantes están completamente llenos ahora, ya no habría una fuerza impulsora para la distorsión. Tenga en cuenta que es sólo una visión formal, y hay argumentos que hablan en contra de este punto de vista. Una es que la adición de los dos electrones al ligando debería desestabilizar aún más el anillo porque los electrones añadidos no se unen. La aromaticidad se lograría más bien eliminando dos electrones para formar un catión Cb 2 + que tendría solo dos electrones en el orbital de unión.
Ciclooctetraeno (cot) como ligando
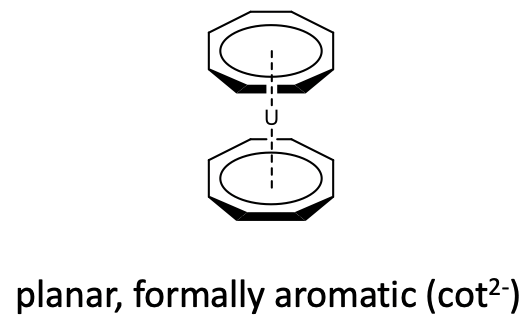
También se conocen metalocenos con ciclooctatetraeno (cot) actuando como 8-ligando. Sin embargo, debido al gran tamaño del anillo solo los metales con radios atómicos grandes, pueden hacer metalocenos con este ligando. Por ejemplo, el uranio produce un uranocenos con dos ligandos de ciclooctatetraeno (Figura\(\PageIndex{28}\)).
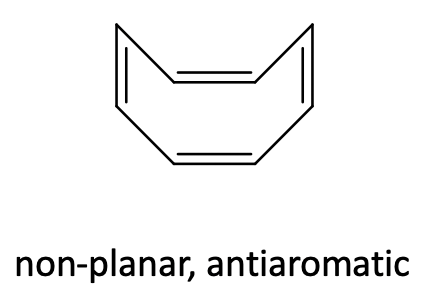
Al igual que el ciclobutadieno, el ciclooctatetraeno es un ligando antiaromático con 4n=8 electrones π-( n=2). En el ciclooctatetraeno libre la molécula no es plana y los electrones p están localizados (Figura\(\PageIndex{29}\)).
Sin embargo, en los metalocenos, el anillo se vuelve plano (Figura\(\PageIndex{28}\)). De nuevo se puede explicar formalmente que al asumir una cuna aromática 2 -ligando que se une a un catión metálico 2+, sin embargo se debe tener en cuenta nuevamente que esta es una visión formal y no necesariamente refleja la situación de unión en el compuesto.
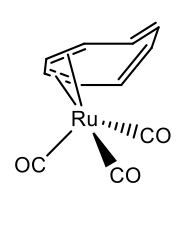
Los metales que tienen un radio atómico más pequeño pueden unirse a la cuna en 2, 4, y menos comúnmente en el modo 6. La regla de 18 electrones se mantiene en la mayoría de los casos. Por ejemplo, cot puede hacer un complejo 4 en tricarbonil ciclooctatetraeno rutenio (0) (Figura\(\PageIndex{30}\)).
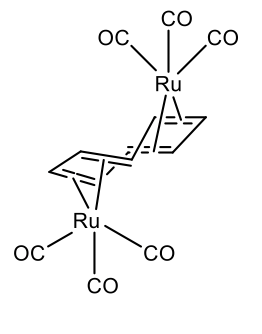
También dos metales pueden unirse a un solo ligando de cuna. Esto se realiza por ejemplo en μ-ciclooctetraeno bis (tricarbonil rutenio (0) (Figura\(\PageIndex{31}\)).