1.8: Ácidos, Bases y Solventes - Elección de un Solvente
- Page ID
- 69545
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La elección del disolvente es un parámetro importante para cualquier reacción química. A continuación se proporciona una guía sobre algunas de las consideraciones que se deben hacer al elegir un disolvente para asegurar que se produzca la reacción deseada.
Solvación
La solvatación puede definirse como la interacción entre el disolvente y el soluto, sin embargo, dos clases generales de solvatación tienen diferentes consecuencias para la estabilidad de reactivos o productos en una reacción química, y por lo tanto, el potencial de que ocurra una reacción
- La solvatación específica es donde el disolvente interactúa con uno de los iones (o moléculas) en solución a través de una interacción covalente. Además, habrá un número específico de moléculas de disolvente unidas a cada ion (o molécula), por ejemplo, [Cu (NH 3) 4] 2+ y [Mg (H 2 O) 6] 2+ (Figura\(\PageIndex{1}\) .60a).
- La solvatación no específica es el resultado de fuerzas de van der Waals o dipolo-dipolo entre el disolvente y un ion (o molécula). No habrá un número definido de interacciones y el disolvente... la interacción iónica será altamente fluxional, e.g., mientras que el agua solvata el ion cloruro (Figura\(\PageIndex{1}\) .60b) el número de moléculas de agua alrededor de cada anión no es fijo
En el cuadro\(\PageIndex{1}\) .10 se muestra la capacidad de tres disolventes para actuar con solvatación específica e inespecífica. La capacidad de solvatación relativa de cada disolvente da como resultado tres productos diferentes a partir de la disolución del cloruro de hierro (III) (FeCl 3).
| Solvación | DMSO (Me 2 SO) | Piridina (C 5 H 5 N) | Acetonitrilo (MECN) |
|---|---|---|---|
| Específico | Bueno | Muy bueno | Pobre |
| Inespecífico | Bueno | Pobre | Moderadamente bueno |
La disolución de FeCl 3 en DMSO da como resultado la disociación de un ligando cloruro, (1.8.1), debido tanto a la solvatación específica del catión FeCl 2+ como a la solvatación inespecífica del anión Cl-. De hecho, las buenas propiedades de solvatación del DMSO significan que dependiendo de la concentración (y temperatura) puede ocurrir una serie de disociaciones, (1.8.2).
\[ FeCl_3 \overset{DMSO}{\rightleftharpoons} [FeCl_2(DMSO)_4]^+ Cl^-_{(solv)} \]
\[[FeCl_2(DMSO)_4]^+ \xleftrightarrow[-Cl^-_{(solv)}]{+DMSO}[FeCl(DMSO)_5]^{2+} \xleftrightarrow[-Cl^-_{(solv)}]{+ DMSO} [Fe(DMSO)_6]^{3+}\]
Por el contrario, si el FeCl 3 se disuelve en piridina (py) se forma el complejo ácido-base de Lewis neutro, (1.8.3), porque mientras que la piridina es muy buena en la solvatación específica (Cuadro\(\PageIndex{1}\) .10), es pobre en la solvatación del anión cloruro.
\[FeCl_3 + py \rightarrow FeCl_3(py)\]
De manera similar, el FeCl 3 (MeCN) 3 se formará por la disolución en acetonitrilo, ya que aunque no es bueno en la solvatación específica, no es suficientemente bueno en la solvatación no específica para estabilizar el anión cloruro. Sin embargo, dado que el anión FeCl 4 - tiene una densidad de carga menor que Cl-, puede ser soportado por la solvatación no específica de acetonitrilo y así se produce una reacción de desproporción, (1.8.4).
\[ 2 FeCl_3(MeCN)_3 \rightleftharpoons [FeCl_2(MeCN)_4]^+ + FeCl_4^-\]
Interferencia por el solvente
En lugar de solvatar una molécula o ion, el disolvente puede tomar un papel activo y perjudicial en la síntesis de un compuesto deseado.
Solvolisis
La reacción de solvolisis arquetípica es la reacción con agua, es decir, hidrólisis, (\ ref {1.8.5}). Sin embargo, la solvolisis es una reacción general, que implica la ruptura del enlace por el disolvente. Así, la reacción con amoníaco es amonólisis, (\ ref {1.8.6}), la reacción con ácido acético es acetólisis, (\ ref {1.8.7}), y la reacción con un alcohol es alcoholisis, (\ ref {1.8.8}) donde Et =\(\ce{C2H5}\). En cada caso tiene lugar la misma reacción general produciendo el catión asociado con el disolvente.
\[\ce{SO_2Cl_2 + 4 H_2O \rightarrow SO_2(OH)_2 + 2 H_3O^+ + 2 Cl^-} \label{1.8.5}\]
\[\ce{SO_2Cl_2 + 4 NH_3 \rightarrow SO_2(NH_2)_2 + 2 NH_4^+ + 2 Cl^-} \label{1.8.6}\]
\[\ce{ SO_2Cl_2 + 4 MeCO_2H \rightarrow SO_2(O_2CMe)_2 + 2 MeCO_2H_2^+ + 2 Cl^-} \label{1.8.7}\]
\[\ce{SO_2Cl_2 + 4 EtOH \rightarrow SO_2(OEt)_2 + 2 EtOH_2^+ + 2 Cl^-} \label{1.8.8}\]
Reacciones de competencia
Donde podría ocurrir más de una reacción, la reacción que involucra al disolvente a menudo puede competir con la reacción deseada.
Si se desea sintetizar el complejo ácido-base de Lewis entre dietiléter (Et 2 O) y trifluoruro de boro (BF 3) es importante elegir un disolvente que no compita con la formación del complejo. Por ejemplo, la piridina es una mala elección porque el donante de nitrógeno es una base Lewis más fuerte que el éter dietilico, (1.8.9), y por lo tanto no se produciría ninguna reacción entre el dietiléter y el trifluoruro de boro. En contraste, dado que el acetonitrilo (MetN) es una base de Lewis pobre, entonces se producirá la reacción.
\[BF_3(Et_2O) + py \rightarrow BF_3(py) + Et_2O\]
Si la síntesis de GeCl 6 2- a partir de tetracloruro de germanio (GeCl 4) y una fuente de anión cloruro, entonces el agua sería una mala elección de disolvente ya que resultaría la hidrólisis de GECl 4. El cloruro de hidrógeno líquido sería igualmente pobre disolvente ya que el fuerte enlace de hidrógeno Cl-... H-Cl estabilizaría el anión cloruro e imposibilitaría la reacción. En contraste, el nitrometano (CH 3 NO 2) sería un disolvente suficientemente polar para solvatar el GECl 4, pero será desplazado por el anión cloruro, que solo estaría débilmente solvatado.
Formación de sal
La formación de una sal a través de una reacción de doble desplazamiento, (1.8.10), puede ser promovida por la elección del disolvente desplazando el equilibrio mediante la estabilización de uno o más reactivos/producto.
\[MX + M'X' \rightleftharpoons MX' + M'X \]
Estabilización de sal a través de acidez relativa
El intento de formación de perclorato de nitrón a partir de ácido nítrico y ácido perclórico, (1.8.11), en agua dará como resultado la descomposición del catión NO 2 +, (1.24). Sin embargo, si la reacción se lleva a cabo en un ácido más fuerte, es decir, ácido sulfúrico, el catión NO 2 + es estable, y la sal resultante puede ser reciclada, (1.8.12).
\[HNO_3 + HClO_4 \rightarrow NO_2^+ + ClO_4^- + H_2O \]
\[NO_2^+ + 2 H_2O \rightarrow HNO_3 + H_3O^+ \]
De manera similar, el carácter básico débil del agua significa que la reacción de equilibrio, (1.25), tiene una constante de equilibrio muy pequeña, K. Sin embargo, si la reacción se lleva a cabo en un disolvente fuertemente básico como el amoníaco el anión uride se estabiliza, (1.26), y puede precipitarse por intercambio catiónico.
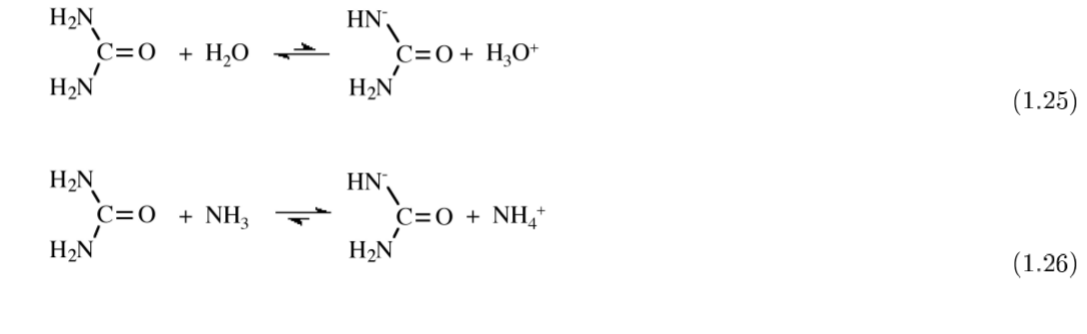
Estabilización salina mediante solvatación
Las siguientes observaciones pueden explicarse por una consideración de la capacidad de solvatación del disolvente.
- La reacción del nitrato de plata con cloruro de bario en agua produce cloruro de plata y nitrato de bario, (1.8.13).
- La reacción del nitrato de bario con cloruro de plata en amoníaco produce cloruro de bario y nitrato de plata, (1.8.14).
\[ 2 AgNO_3 + BaCl_2 \xrightarrow{H_2O} 2 AgCl\downarrow + Ba^{2+} + 2 NO_3^-\]
\[ 2 AgCl + Ba(NO_3)_2 \xrightarrow{NH_2} BaCl_2\downarrow + 2 Ag^+ + 2 NO_3^-\]
Dado que el nitrato de plata y el nitrato de bario son solubles en ambos disolventes, las diferencias deben deberse a diferencias en la solubilidad de los cloruros en cada disolvente. Una consideración de la estabilidad relativa del cloruro de plata sólido frente a las especies solvatadas (Figura\(\PageIndex{1}\) .61) muestra que la entalpía de solvatación en agua es menor que la energía reticular. Así, si el cloruro de plata estuviera presente como Ag+ y Cl- en el agua precipitaría espontáneamente. Por el contrario, la entalpía de la solvatación en amoníaco es mayor que la energía de la red, por lo que el AgCl sólido se disolverá fácilmente en amoníaco líquido. El motivo de la estabilización extra a partir de la solvatación específica del catión plata por el amoníaco, es decir, la formación del complejo covalente [Ag (NH 3) 2] +.
Como puede verse en la Figura\(\PageIndex{1}\) .62, el efecto contrario ocurre para el cloruro de bario. Aquí la entalpía de solvatación en amoníaco es menor que la energía reticular. Así, si el cloruro de bario estuviera presente como Ba 2 + y Cl - en amoníaco precipitaría espontáneamente. Por el contrario, la entalpía de la solvatación en agua es mayor que la energía de la red, por lo que el BaCl 2 sólido se disolverá fácilmente en agua. La estabilización de Ba 2 + (aq) ocurre porque el agua tendrá una mayor esfera de solvatación no específica como consecuencia de tener dos pares solitarios, permitiendo la interacción con el Ba 2+ así como con otras moléculas de agua (Figura\(\PageIndex{1}\) .63).
Reacción de transferencia de electrones
Una consideración de las reacciones de oxidación, (1.8.15), y reducción, (1.8.16), que ocurren para el agua pura a pH neutro (donde [H +] = 10 -7) sugeriría que el agua no tolerará oxidantes cuyo E0 sea mayor de 0.82 V ni tolerará reductores cuyo E0 sea menor que -0.41 V.
\[2 H^+ + \dfrac{1}{2} O_2 + 2 e^- \rightarrow H_2O \space\space\space\space\space\space E_0=+0.82V\]
\[H^+ + e^- \rightarrow \dfrac{1}{2} H_2 \space\space\space\space\space\space E_0 = -0.41V\]
Así, mientras que el agua tiene un rango justo para soportar reacciones redox, no es muy buena en los extremos con agentes reductores fuertes o agentes oxidantes fuertes. El amoníaco líquido es un excelente solvente para agentes reductores muy fuertes debido a la estabilización de electrones solvatados, es decir, [e - (NH 3) 6]. Por el contrario, el ácido clorhídrico es un buen disolvente para reacciones que involucran agentes oxidantes muy fuertes.


