6.12: Arsenuro de galio de grado electrónico
- Page ID
- 69440
Introducción
La síntesis y purificación de material semiconductor policristalino a granel representa el primer paso hacia la fabricación comercial de un dispositivo electrónico. Este material policristalino se utiliza entonces como materia prima para la formación de material monocristalino que se procesa en obleas semiconductoras.
En contraste con el silicio de grado electrónico (EGS), cuyo uso es una fracción menor de la producción global de silicio elemental, el arseniuro de galio (GaAs) se produce exclusivamente para su uso en la industria de semiconductores. Sin embargo, el arsénico y sus compuestos tienen importantes aplicaciones comerciales. El uso principal del arsénico elemental es en aleaciones de Pb, y en menor medida Cu, mientras que los compuestos de arsénico son ampliamente utilizados en pesticidas y conservantes de madera y en la producción de vidrio de botella. Así, la industria electrónica representa un menor usuario de arsénico. En contraste, aunque el galio tiene usos menores como sello líquido de alta temperatura, fluidos manométricos y medios de transferencia de calor, y para soldaduras a baja temperatura, su uso principal es en la tecnología de semiconductores.
Aislamiento y purificación de galio metálico
A 19 ppm, el galio (L. Gallia, Francia) es aproximadamente tan abundante como el nitrógeno, el litio y el plomo; es dos veces más abundante que el boro (9 ppm), pero es más difícil de extraer debido a la falta de cualquier mineral importante que contenga galio. El galio siempre ocurre en asociación ya sea con zinc o germanio, sus vecinos en la tabla periódica, o con aluminio en el mismo grupo. Así, las concentraciones más altas (0.1-1%) se encuentran en el mineral raro germanita (un sulfuro complejo de Zn, Cu, Ge y As), mientras que las concentraciones en esfalerita (ZnS), diáspora [AlO (OH)], bauxita o carbón, son cien veces menos. Industrialmente, el galio se recuperó originalmente del polvo de combustión emitido durante el tostado de sulfuro o la quema de carbón (hasta 1.5% de Ga), sin embargo, ahora se obtiene como producto secundario de la vasta industria del aluminio y en particular del proceso Bayer para obtener alúmina a partir de bauxita.
El proceso de Bayer implica la disolución de bauxita, AlO x OH 3-2x, en NaOH acuoso, separación de impurezas insolubles, precipitación parcial del trihidrato, Al (OH) 3 y calcinación a 1,200 °C, durante el procesamiento la solución alcalina se enriquece gradualmente en galio de una relación en peso inicial Ga/Al de aproximadamente 1/5000 a aproximadamente 1/300. La electrólisis de estos extractos con un cátodo de Hg da como resultado una mayor concentración, y la solución de galato de sodio así formada se electroliza con un cátodo de acero inoxidable para dar metal Ga. Dado que la bauxita contiene 0.003-0.01% de galio, la recuperación completa produciría unas 500-1000 toneladas anuales, sin embargo el consumo presente es solo 0.1% de esto alrededor de 10 toneladas anuales.
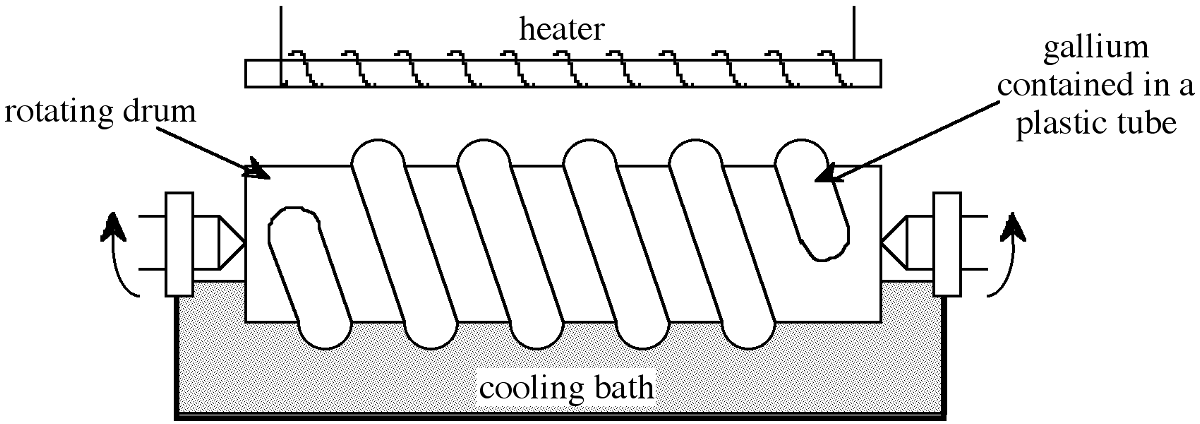
Un análisis típico del galio puro 98-99% obtenido como producto secundario del proceso Bayer se muestra en la Tabla\(\PageIndex{1}\). Este material se purifica adicionalmente al 99.99% mediante tratamiento químico con ácidos y O 2 a altas temperaturas seguido de cristalización. Este proceso químico da como resultado la reducción de la mayoría de las impurezas metálicas a nivel de ppm, ver Tabla\(\PageIndex{1}\). La purificación a siete nueves 99.9999% es posible a través del refinamiento de zona, sin embargo, dado que el coeficiente de distribución de equilibrio de las impurezas residuales k 0 ≈ 1, se requieren múltiples pasadas, típicamente > 500. El bajo punto de fusión del galio asegura que la contaminación de la pared del recipiente (que es significativa en el refinamiento de la zona de silicio) se minimiza. Con el fin de facilitar el refinamiento de zonas múltiples en un tiempo adecuado, se emplea una simple modificación de refinación de zona que se muestra en la Figura\(\PageIndex{1}\). El galio está contenido en un tubo de plástico envuelto alrededor de un cilindro giratorio que está medio sumergido en un baño de enfriamiento. Un calentador se coloca encima de la bobina de plástico de galio. De esta manera, se establece una serie de zonas fundidas que pasan al girar el tambor por un segmento helicoidal por revolución. De esta manera, se pueden realizar 500 pasadas en periodos de tiempo relativamente cortos. Los niveles típicos de impurezas de la zona de galio refinada de esta manera se dan en la Tabla\(\PageIndex{1}\).
| Element | Proceso Bayer (ppm) | Después de la lixiviación ácido/base (ppm) | 500 pases de zona (ppm) |
|---|---|---|---|
| aluminio | 100-1,000 | 7 | < 1 |
| calcio | 10-100 | no detectado | no detectado |
| cobre | 100-1,000 | 2 | < 1 |
| hierro | 100-1,000 | 7 | < 1 |
| plomo | < 2000 | 30 | no detectado |
| magnesio | 10-100 | 1 | no detectado |
| mercurio | 10-100 | no detectado | no detectado |
| níquel | 10-100 | no detectado | no detectado |
| silicio | 10-100 | ≈ 1 | no detectado |
| hojalata | 10-100 | ≈ 1 | no detectado |
| titanio | 10-100 | 1 | < 1 |
| zinc | 30,000 | ≈ 1 | no detectado |
Aislamiento y purificación de arsénico elemental
El arsénico elemental (L. arsenicum, orpimento amarillo) existe en dos formas: amarilla (cúbica, As 4) y gris o metálica (romboédrica). A una abundancia natural de 1.8 ppm el arsénico es relativamente raro, sin embargo, esto se ve compensado por su presencia en varios minerales comunes y la relativa facilidad de aislamiento. Los minerales que contienen arsénico se agrupan en tres clases principales: los sulfuros realgar (As 4 S 4) y orpimento (As 2 S 3), el óxido arsenolita (As 2 O 3) y los arsenidos y sulfaresenuros del hierro, cobalto y níquel. Los minerales de esta última clase incluyen: loelinginita (FEA 2), safforlita (CoAs), niccolita (NIAs), rammelsbergita (NiAs 2), ansenopirita o mispiquel (FeAsS), cobaltita (CoAsS), enargita (Cu 3 AsS 4), gerdsorfita (NiAsS) y el sulfuro quarturnario glaucodot [(Co, Fe) ASs]. El cuadro\(\PageIndex{2}\) muestra las impurezas típicas en la arsenopirita.
| Element | Concentración (ppm) | Element | Concentración (ppm) |
|---|---|---|---|
| plata | 90 | níquel | < 3,000 |
| oro | 8 | plomo | 50 |
| cobalto | 30,000 | platino | 0.4 |
| cobre | 200 | renio | 50 |
| germanio | 30 | selenio | 50 |
| manganeso | 3,000 | vanadio | 300 |
| molibdeno | 60 | zinc | 400 |
El arsénico se obtiene comercialmente fundiendo FeAs 2 o FeAs a 650-700 °C en ausencia de aire y condensando el elemento sublimado (T sub = 613 °C), (6.12.1).
\[ \text{FeAsS} \xrightarrow{\text{650-700 °C}} \text{FeS + As(vapor)} \xrightarrow{\text{<613 °C}} \text{As(solid)}\]
El arsénico así obtenido se combina con plomo y luego se sublima (T sub = 614 °C) el cual une cualquier impureza de azufre con mayor fuerza que el arsénico. Cualquier arsénico residual que quede atrapado en el sulfuro de hierro se separa formando el óxido (As 2 O 3) tostando el sulfuro en aire. El óxido se sublima en el sistema de humos durante el tostado de donde se recolecta y se reduce con carbón a 700-800 °C para dar arsénico elemental. El arsénico de grado semiconductor (> 99.9999%) se forma por refinación de zona.
Síntesis y purificación de arseniuro de galio.
El arseniuro de galio se puede preparar mediante la reacción directa de los elementos, (6.12.2). Sin embargo, aunque conceptualmente simple la síntesis de GaAs se complica por las diferentes presiones de vapor de los reactivos y la naturaleza altamente exotérmica de la reacción. Además, dado que la síntesis de GaAs a presión atmosférica va acompañada de sus descomposiciones simultáneas debido a la pérdida por sublimación, de arsénico, la síntesis debe realizarse bajo una sobrepresión de arsénico para mantener una composición estequiométrica de los GaAs sintetizados.
\[ \text{Ga(liquid) + As(vapor)} \xrightarrow{ \text{>1240 °C}} \text{GaAs(solid)}\]
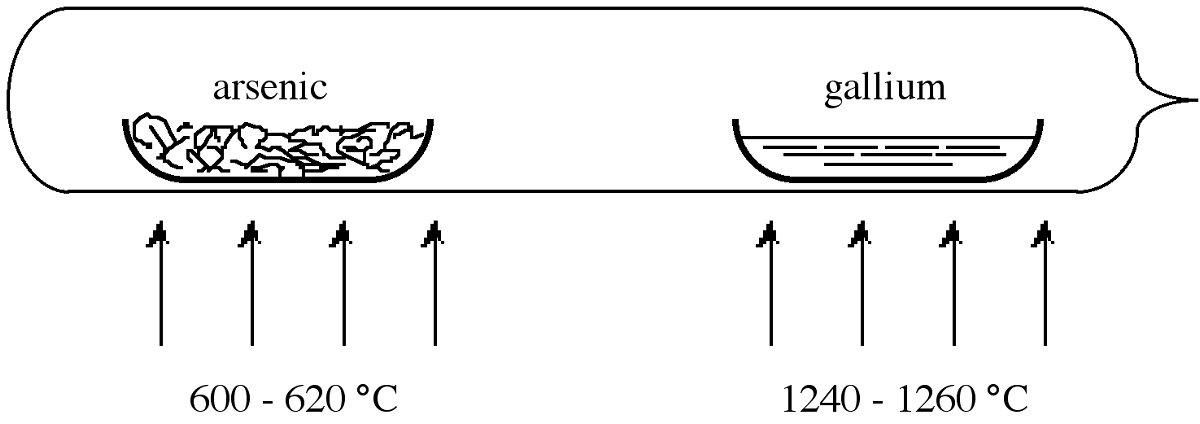
Para superar los problemas asociados con la pérdida de arsénico, la reacción generalmente se lleva a cabo en un tubo de reacción sellado. Sin embargo, si se usa una cantidad estequiométrica de arsénico en la reacción, se debe emplear una temperatura constante de 1238 °C para mantener la sobrepresión deseada de arsénico de 1 atm. Prácticamente, es más fácil usar un gran exceso de arsénico calentado a una temperatura más baja. En esta situación la presión en el tubo es aproximadamente igual a la presión de vapor de equilibrio del componente volátil (arsénico) a la temperatura más baja. Por lo tanto, se puede mantener una sobrepresión de 1 atm de arsénico si dentro de un tubo sellado el arsénico elemental se calienta a 600-620 °C mientras que los GaAs se mantienen a 1240-1250 °C.
La figura\(\PageIndex{2}\) muestra la configuración de tubo sellado que se usa típicamente para la síntesis de GaAs. El tubo se calienta dentro de un horno de dos zonas. Los barcos que contienen los reactivos suelen estar hechos de cuarzo, sin embargo, también se usa grafito ya que este último tiene una coincidencia de expansión térmica más cercana al producto GaAs. Si se requiere mayor pureza entonces se utiliza nitruro de boro pirolítico (PBN). Uno de los barcos está cargado de galio puro y el otro con arsénico. Se puede colocar un tapón de lana de cuarzo entre las embarcaciones para que actúe como difusor. Luego se evacua el tubo y se sella. Una vez llevados a las temperaturas de reacción correctas (Figura\(\PageIndex{2}\)), el vapor de arsénico se transporta al galio, y reaccionan para formar GaAs de manera controlada. La tabla\(\PageIndex{3}\) da las concentraciones típicas de impurezas encontradas en GaAs policristalinos.
| Element | Concentración (ppm) | Element | Concentración (ppm) |
|---|---|---|---|
| boro | 0.1 | silicio | 0.02 |
| carbono | 0.7 | fósforo | 0.1 |
| nitrógeno | 0.1 | azufre | 0.01 |
| oxígeno | 0.5 | cloro | 0.08 |
| flúor | 0.2 | níquel | 0.04 |
| magnesio | 0.02 | cobre | 0.01 |
| aluminio | 0.02 | zinc | 0.05 |
GaAs policristalino, formado a partir de la reacción directa de los elementos a menudo se usa como material de partida para el crecimiento monocristalino a través del crecimiento de cristales Bridgeman o Czochralski. También es posible preparar cristales individuales de GaAs directamente a partir de los elementos usando compuestos in situ o directos dentro de una técnica de Czochralski encapsulado en líquido de alta presión (HPLEC).
Crecimiento de cristales de arseniuro de galio
Al considerar la síntesis de compuestos del Grupo 13-15 para aplicaciones electrónicas, la naturaleza misma del comportamiento de los semiconductores exige el uso de materiales monocristalinos de alta pureza. Los materiales policristalinos sintetizados anteriormente son, por lo tanto, de poco uso para 13-15 semiconductores pero pueden, sin embargo, servir como material de partida para cristales individuales cultivados en estado fundido. Para GaAs, sin duda el semiconductor 13-15 (III - V) más importante, los monocristales cultivados en fusión se logran mediante una de dos técnicas: la técnica Bridgman, y la técnica Czochralski.
Crecimiento de Bridgman
La técnica Bridgman requiere un horno de dos zonas, del tipo mostrado en la Figura\(\PageIndex{3}\). La zona izquierda se mantiene a una temperatura de ca. 610 °C, permitiendo una sobrepresión suficiente de arsénico dentro del sistema sellado para evitar la pérdida de arsénico del arseniuro de galio. El lado derecho del horno contiene la materia prima policristalina GaAs mantenida a una temperatura justo por encima de su punto de fusión (ca. 1240 °C). A medida que el horno se mueve de izquierda a derecha, la masa fundida se enfría y solidifica.
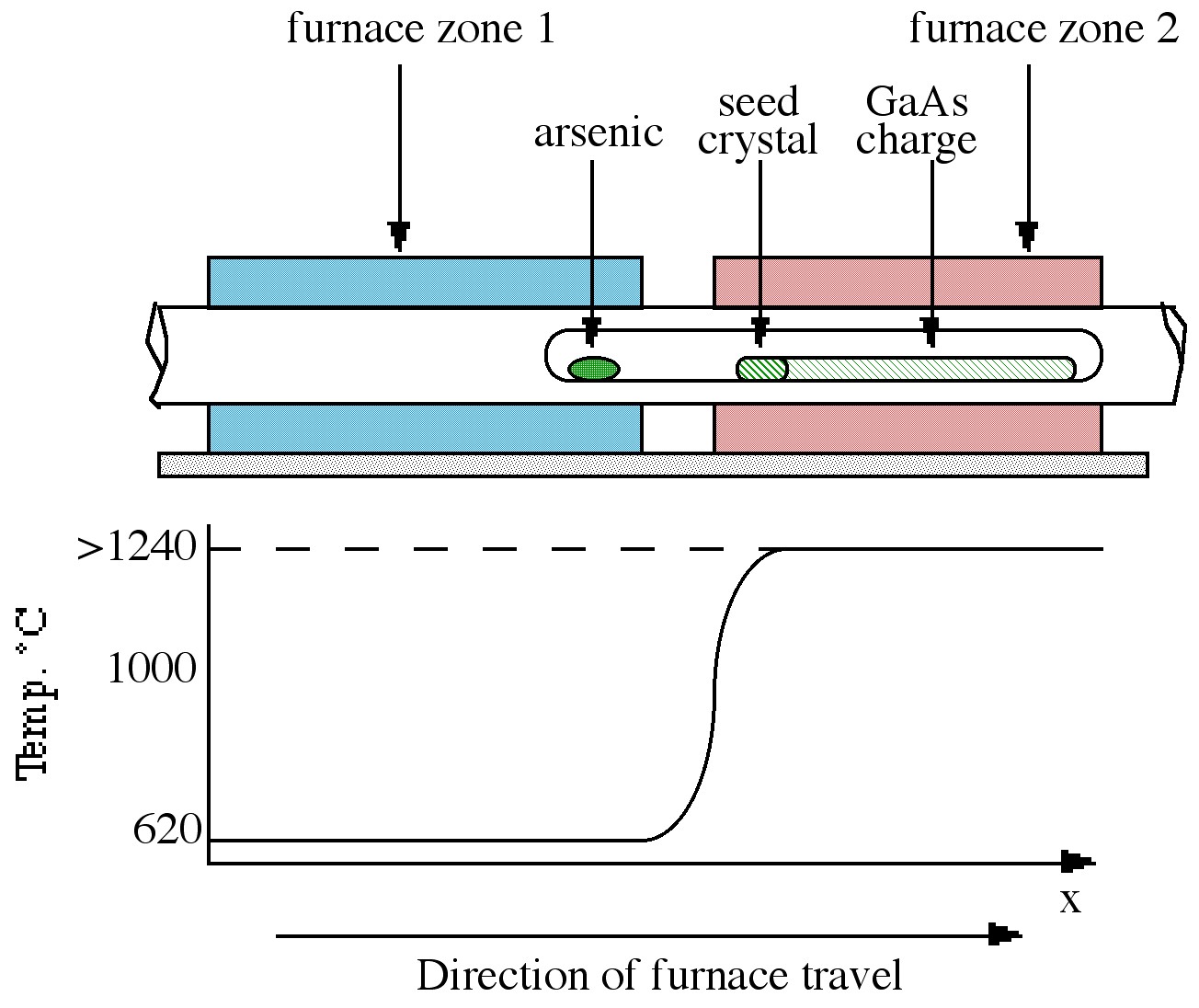
Si se coloca un cristal semilla en el lado izquierdo de la masa fundida (en un punto donde el gradiente de temperatura es tal que solo el extremo se funde), una orientación específica del cristal único puede propagarse en la interfaz líquido-sólido eventualmente para producir un solo cristal.
Crecimiento de Czochralski
La técnica de Czochralski, que es la técnica más utilizada en la industria, se muestra en la Figura\(\PageIndex{4}\). El proceso se basa en la retirada controlada de un cristal semilla de una masa fundida líquida. A medida que la semilla se baja en la masa fundida, se produce una fusión parcial de la punta creando la interfaz líquido-sólido requerida para el crecimiento del cristal. A medida que se retira la semilla, se produce la solidificación y la orientación de la semilla se propaga en el material cultivado. Los parámetros variables de velocidad de extracción y velocidad de rotación pueden controlar el diámetro y la pureza del cristal. Como se muestra en\(\PageIndex{4}\) la Figura, la masa fundida de GaAs está tapada por trióxido de boro (B 2 O 3). La capa de recubrimiento, que es inerte a GaAs, evita la pérdida de arsénico cuando la presión en la superficie está por encima de la presión atmosférica. El crecimiento de GaAs por esta técnica se denomina así crecimiento de Czochralski encapsulado líquido (LEC).
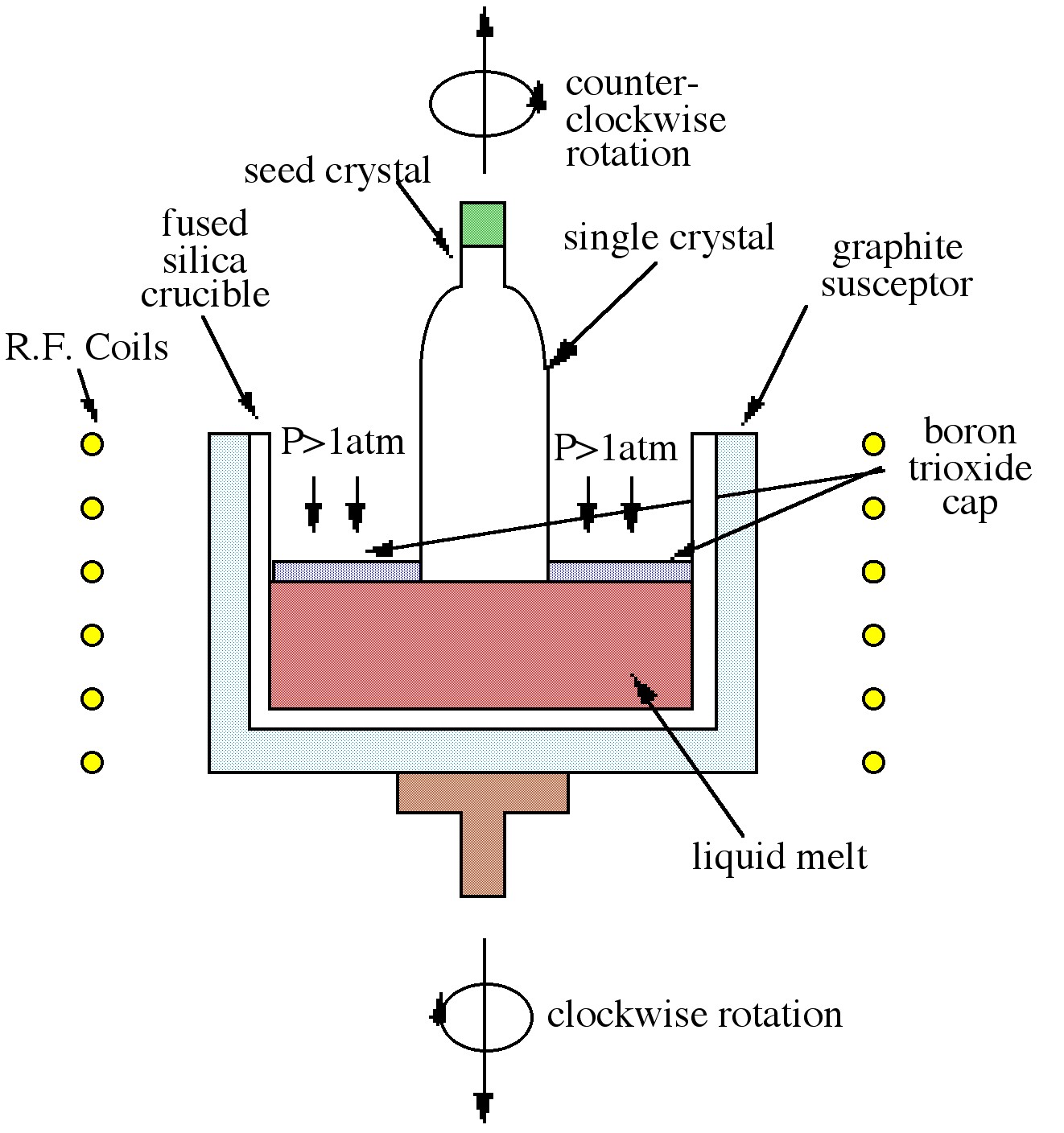
Si bien la técnica de Bridgman se ve favorecida en gran medida para el crecimiento de GaAs, se pueden obtener obleas de mayor diámetro mediante el método Czochralski. Ambas técnicas de fusión producen materiales muy contaminados por el crisol, haciéndolos adecuados casi exclusivamente como material de sustrato. Otra desventaja de estas técnicas es la producción de defectos en el material causados por el proceso de fusión.
Bibliografía
- S. K. Ghandhi, VLSI Principios de Fabricación: Silicio y Arseniuro de Galio. Wiley-Interscience, Nueva York, (1994).
- J. Krauskopf, J. D. Meyer, B. Wiedemann, M. Waldschmidt, K. Bethge, G. Wolf, y W. Schültze, 5ta Conferencia sobre Materiales Semiaislantes III-V, Malmo, Suecia, 1988, Eds. G. Grossman y L. Ledebo, Adam-Hilger, Nueva York (1988).
- W. G. Pfann, Zone Melting, John Wiley & Sons, Nueva York (1966).
- R. E. Williams, Técnicas de Procesamiento de Arseniuro de Galio. Casa Artech (1984).
- Propiedades del Arsenuro de Galio. Ed. M. R. Brozel y G. E. Stillman. 3ª Ed. Institución de Ingenieros Eléctricos, Londres (1996).

