6.13: Calcogenidos de Aluminio, Galio e Indio
- Page ID
- 69452
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los únicos calcogenidos estables de aluminio son Al 2 S 3 (blanco), Al 2 Se 3 (gris) y Al 2 Te 3 (gris oscuro). Cada uno se prepara mediante la reacción directa de los elementos (100 °C) y se hidrolizan rápidamente en solución acuosa, (6.13.1). Todos los calcogenidos tienen una estructura hexagonal de ZnS en la que están ocupados 2/3 de los sitios metálicos.
\[ \text{Al}_3\text{E}_3 \text{ + 6 H}_2\text{O} \rightarrow \text{2 Al(OH)}_3 \text{ + 3 H}_2\text{E}\]
Los calcogenidos de galio e indio son más numerosos que los del aluminio, y se enumeran en Tabla\(\PageIndex{1}\) y Tabla\(\PageIndex{2}\) junto con propiedades físicas seleccionadas.
| Compuesto | Tipo estructural | Sistema cristalográfico | Parámetros de celda (Å,°) | Banda Gap (eV) a |
| Gas | Hexagonal | a = 3.587, c = 15.492 | 3.05 (dir.), 2.593 (ind.) | |
| Gas | ZnS o NaCl | Cúbico | a = 5.5 | 4.0 (opt.) |
| β-Gasa | Gas | Hexagonal | a = 3.742, c = 15.919 | 2.103 (dir.), 2.127 (ind.) |
| γ-Gasa | Gas | Romboédrico | a = 3.755, c = 23.92 | |
| Δ-Gasa | Gas | Hexagonal | a = 3.755, c = 31.99 | |
| Puerta β | Gas | Hexagonal | a = 4.06, c = 16.96 | |
| GATE | Gas | Monocínicos | a = 17.44, b = 4.077, c = 10.456, β = 104.4 | 1.799 (dir.) |
| α-GA 2 S 3 | Wurtzita | Cúbico | a = 5.181 | |
| α-GA 2 S 3 | Wurtzita | Monocínicos | a = 12.637, b = 6.41, c = 7.03, β = 131.08 | 3.438 (opt.) |
| β-GA 2 S 3 | Wurtzita Defecto | Hexagonal | a = 3.685, c = 6.028 | 2.5 - 2.7 (opc.) |
| α-GA 2 Se 3 | Esfalerita | Cúbico | a = 5.429 | 2.1 (dir.), 2.04 (ind.) |
| α-GA 2 Te 3 | Esfalerita | Cúbico | a = 5.886 | 1.22 (opt.) |
| Compuesto | Tipo estructural | Sistema cristalográfico | Parámetros de celda (Å,°) | Separación de banda (eV) a |
| β-ins | Gas | Ortorrómbico | a = 3.944, b = 4.447, c = 10.648 | 2.58 (dir.), 2.067 (ind.) |
| INs b | Hg 2 Cl 2 | Tetragonal | ||
| InSe | Gas | Romboédrico | a = 4.00, c = 25.32 | 1.3525 (dir.), 1.32 (ind.) |
| β-INSE | Gas | Hexagonal | a = 4.05, c = 16.93 | |
| InTe | TLSE | Tetragonal | a = 8.437, c = 7.139 | Metálico |
| InTe b | NaCl | Cúbico | a = 6.18 | |
| α-en 2 S 3 | γ-Al 2 O 3 | Cúbico | a = 5.36 | |
| β-en 2 S 3 | Espinela | Tetragonal | a = 7.618, c = 32.33 | 2.03 (dir.), 1.1 (ind.) |
| α-In 2 Se 3 | Wurtzita Defecto | Hexagonal | a = 16.00, c = 19.24 | |
| β-en 2 Se 3 | Wurtzita Defecto | Romboédrico | a = 4.025, c = 19.222 | 1.2 - 1.5 (ind.) |
| α-en 2 Te 3 | Esfalerita | Cúbico | a = 6.158 | 0.92 - 1.15 (opt.) |
| En 6 S 7 | Monocínicos | a = 9.090, b = 3.887, c = 17.705, β = 108.20 | 0.89 (dir.), 0.7 (ind.) | |
| En 6 Se 7 | En 6 S 7 | Monocínicos | a = 9.430, b = 4.063, c = 18.378, β = 109.34 | 0.86 (dir.), 0.34 (ind.) |
| En 4 Se 3 | Ortorrómbico | a = 15.297, b = 12.308, c = 4.081 | 0.64 (dir.) | |
| En 4 Te 3 | En 4 Se 3 | Ortorrómbico | a = 15.630, b = 12.756, c = 4.441 | 0.48 (dir.) |
La forma hexagonal β de Ga 2 S 3 es isoestructural con el análogo de aluminio; sin embargo, mientras que la fase α se propuso ser hexagonal, posteriormente se demostró que era monoclínica. Se ha reportado una fase α cúbica. Se encuentran estructuras de esfalerita cúbica para Ga 2 Se 3, Ga 2 Te 3 y In 2 Te 3, en las que la estructura se basa en un empaquetamiento cerrado cúbico de los calcogenidos y los átomos metálicos que ocupan 1/3 del tetraédrico sitios. Todas estas estructuras se forman con cristalización rápida; la cristalización lenta y/o el recocido térmico conducen al ordenamiento y la formación de estructuras más complejas. Los sulfuros de indio y los derivados de selenidos son espinela (γ-Al 2 O 3), y defecto Würtzita, respectivamente.
A diferencia de los calcogenidos del aluminio, los del galio y el indio también forman compuestos subvalentes, es decir, aquellos en los que el metal se encuentra formalmente en un estado de oxidación menor a +3. De estos calcogenidos subvalentes los materiales (formalmente) divalentes son de mayor interés. La fase termodinámicamente estable de GAs tiene una estructura de capa hexagonal (Figura\(\PageIndex{1}\)) con enlaces Ga-Ga (2.48 Å). El compuesto puede, por lo tanto, considerarse como un ejemplo de Ga (II). Cada Ga está coordinado por tres átomos de azufre y un galio, y la secuencia de capas a lo largo del eje z es... S-Ga-Ga-S... S-Ga-Ga-S... .

Las estructuras de β-Gasa y β-INSE son similares a las GAS hexagonales. La estructura en capas de GATE es similar en que consiste en... TEGAGATE... capas, pero es monoclínica, mientras que los INs se encuentran tanto en una fase tetragonal (alta presión) (Figura\(\PageIndex{2}\) a) como en una fase ortorrómbica (Figura\(\PageIndex{2}\) b). En contraste con estos compuestos estratificados unidos M-M InTe (Figura\(\PageIndex{3}\)) tiene una estructura formalizada como In (I) [In (III) Te 2]; cada In (III) está coordinado tetraédricamente a cuatro Te y estos tetraedros están unidos a través de bordes compartidos; los centros In (I) se encuentran entre estas cadenas.


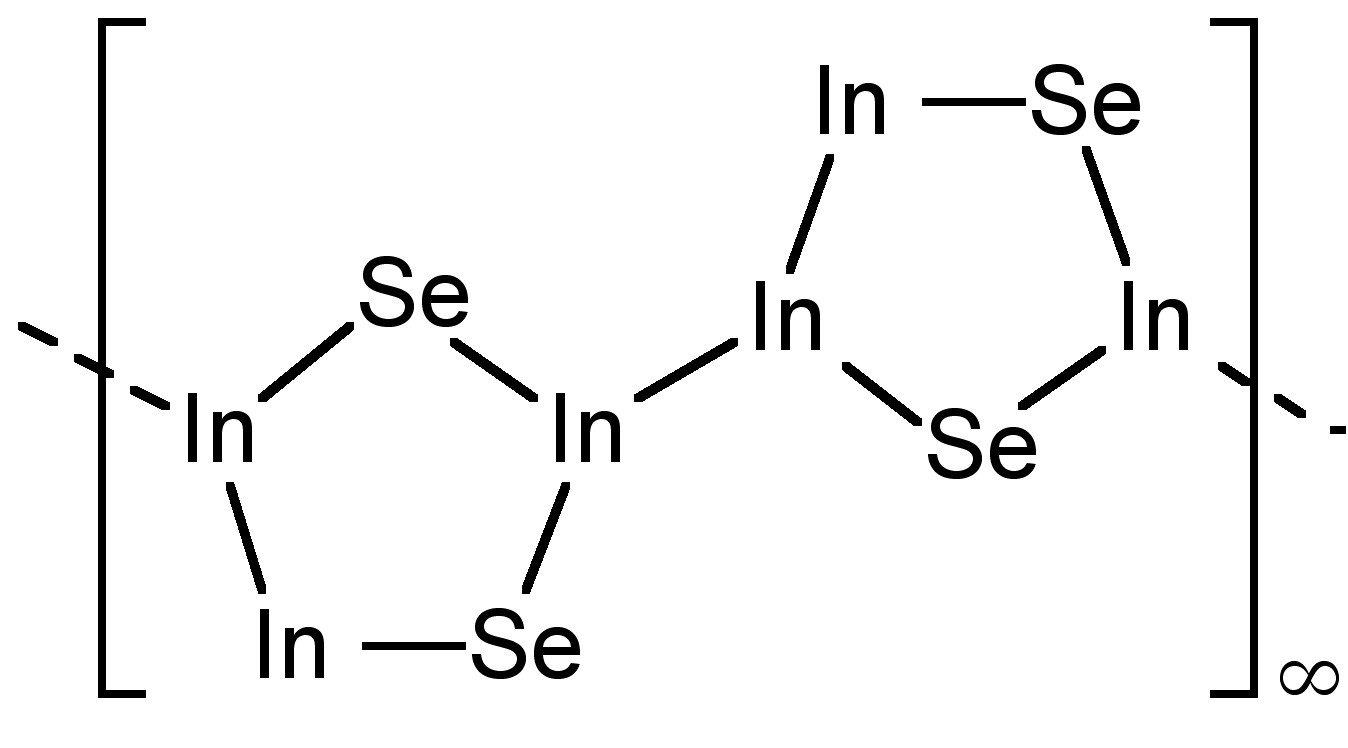
Se conocen otros subcalcogenidos para el indio, por ejemplo; En 4 Se 3, que contiene [In (III) 3 Se 2] 5+ grupos (Figura\(\PageIndex{4}\)). Si bien la molécula formalmente In (I) In 2 S ha sido detectada en fase gaseosa, en realidad es una mezcla de In e INs en estado sólido.
Bibliografía
- W. J. Duffin y J. H. C. Hogg, Acta Crystallogr., 1966, 20, 566.
- J. Goodyear y G. Steigman, Acta Crystallogr. 1963, 16, 946.
- H. Hahn y G. Frank, Z. Anorg. Allgem. Chem., 1955, 278, 340.
- S. Kabalkina, V. G. Losev, y N. M. Gasanly, Commun de Estado Sólido, 1982, 44, 1383.
- A. Keys, S. G. Bott, y A. R. Barron, Chem. Mater. , 1999, 11, 3578.
- A. N. MacInnes, M. B. Power, y A. R. Barron, Chem. Mater. , 1992, 4, 11.
- A. N. MacInnes, W. M. Cleaver, A. R. Barron, M. B. Power, y A. F. Hepp, Adv. Mater. Óptica. Electrón. , 1992, 1, 229.
- K. Schubert, E. Dörre, y E. Günzel, Naturwissenschaften, 1954, 41, 488.

