7.4: Compuestos de Nitrógeno de Carbono
- Page ID
- 69525
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hay una gran cantidad de compuestos orgánicos que contienen enlaces carbono-nitrógeno, incluyendo: aminas, iminas y nitrilos. Sin embargo, aquí nos preocupan los compuestos carbono-nitrógeno más simples.
Cianógeno
El cianógeno, (CN) 2, puede considerarse el fragmento molecular más pequeño que contiene carbono y nitrógeno (Figura\(\PageIndex{1}\) a). La química de reacción del cianógeno está relacionada con la de los halógenos, es decir, F 2, Cl 2, etc. En consecuencia, el cianógeno se denomina pseudo halógeno.

Como se muestra en\(\PageIndex{1}\) la Tabla, el enlace en cianógeno es consistente con la localización del enlace π entre carbono y nitrógeno dada la similitud de la distancia de enlace C-N en cianógenos y acetonitrilo. Sin embargo, existe claramente alguna deslocalización π asociada con la distancia C-C dada su acortamiento en comparación con el etano.
| Compuesto | Fórmula | Distancia de enlace C-C (Å) | Distancia de enlace C-N (Å) |
| Cianógeno | (CN) 2 | 1.393 | 1.163 |
| Cianuro de hidrógeno | HCN | - | 1.154 |
| acetonitrilo | CH 3 CN | 1.46 | 1.16 |
| Etano | C 2 H 6 | 1.535 | - |
| Etileno | C 2 H 4 | 1.339 | - |
El cianógeno se produce por la reacción de una mezcla del cianuro y cloruro de mercurio, (7.4.1).
\[ \text{Hg(CN)}_2 \text{ + HgCl}_2 \rightarrow \text{(CN)}_2 \text{ + 2 Hg + Cl}_2\]
Alternativamente, la descomposición del cianuro inestable de cobre (II), formado a partir de sales de cobre (II) con un cianuro del Grupo 1, (7.4.2), produce cianógenos, (7.4.3).
\[ \text{CuSO}_4\text{ + 2 KCN} \rightarrow \text{Cu(CN)}_2\text{ + K}_2\text{SO}_4\]
\[\text{2 Cu(CN)}_2 \rightarrow \text{(CN)}_2 \text{ + 2 CuCN}\]
El cianógeno es un gas inflamable (Mp = -28 °C y Bp = -21 °C) que produce la segunda llama natural más caliente (después del subnitruro de carbono, C 4 N 2) con una temperatura superior a 4525 °C cuando se quema en oxígeno. El calentamiento de cianógeno en ausencia de oxígeno da como resultado autopolimeriza.

La hidrólisis del cianógeno resulta además a través de los enlaces triples carbono-nitrógeno y la formación de oxamida. La escisión del enlace C-C ocurre en presencia de base (por ejemplo, KOH), con la formación de sales de cianuro (CN -) y cianato (CNO -), (7.4.4).

\[ \text{(CN)}_2\text{ + 2 OH}^- \rightarrow \text{CN}^-\text{ + CNO}^- \text{ + H}_2\text{O}\]
Dicyanoacetileno
El dicianoacetileno (también conocido como subnitruro de carbono o por su nombre IUPAC but-2-inedinitrilo) tiene la estructura que se muestra en la Figura\(\PageIndex{1}\) b, y puede considerarse como un acetileno sustituido con dicianaide.
A temperatura ambiente, el dicianoacetileno es un líquido transparente, sin embargo, se ha detectado dicianoacetileno sólido en la atmósfera de Titán (la luna más grande del planeta Saturno) por espectroscopia infrarroja. El dicianoacetileno es un explosivo entrópico que proporciona polvo de carbono y gas nitrógeno. En presencia de oxgyen se quema con una llama azul-blanca brillante a una temperatura de 4990 °C.
Cianuro de hidrógeno
El cianuro de hidrógeno (HCN) es un gas incoloro, altamente venenoso (Mp = -13.5 °C y Bp = 25.6 °C). Debido a su aislamiento original del azul prusiano (ferrocianuro férrico hidratado), el cianuro de hidrógeno también se conoce con el nombre de ácido prúsico.
La síntesis de cianuro de hidrógeno se realiza comercialmente mediante la oxidación parcial de metano en presencia de amoníaco, (7.4.5), utilizando un catalizador de platino. El calor para activar la reacción se deriva de la combustión parcial del metano y amoníaco. La solución acuosa resultante se seca por destilación a partir de pentóxido de fósforo (P 2 O 5) para producir cianuro de hidrógeno anhidro.
\[ \text{2 CH}_4 \text{ + 3 O}_2\text{ + 2 NH}_3 \rightarrow \text{ 2 HCN + 6 H}_2\text{O}\]
También se puede formar cianuro de hidrógeno en ausencia de oxígeno, (7.4.6); sin embargo, en este caso la reacción debe calentarse externamente.
\[ \text{CH}_4 \text{ + NH}_3 \rightarrow \text{ HCN + 3 H}_2 \]
Se pueden preparar pequeñas cantidades de cianuro de hidrógeno para uso en laboratorio mediante la reacción de un ácido con una sal de cianuro (ya sea de potasio o sodio), (7.4.7).
\[\text{KCN + H}^+ \rightarrow \text{HCN + K}^+\]
La estructura del cianuro de hidrógeno se muestra en la Figura\(\PageIndex{2}\) junto con su forma isomérica, cianuro de hidrógeno (HNC). Si bien el cianuro de hidrógeno está presente en los huesos de muchos frutos, y es generado por polillas de burnet y algunos milpiés, el cianuro de hidrógeno solo se encuentra en el espacio interestelar. Se postula, sin embargo, que junto con el HCN, el HNC es un bloque de construcción importante para los aminoácidos y, por lo tanto, la vida.

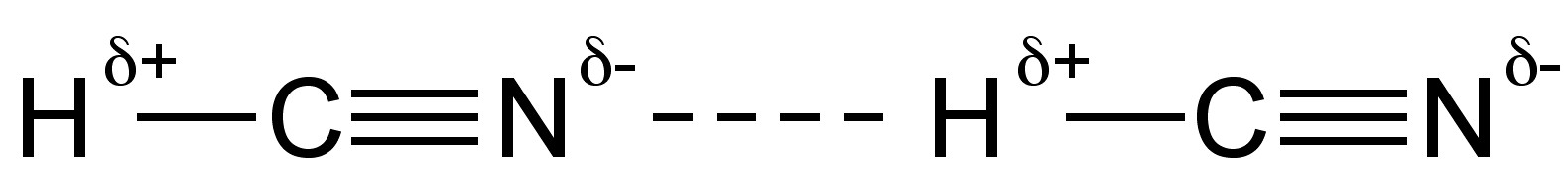
En estado líquido, el cianuro de hidrógeno forma fuertes enlaces de hidrógeno (Figura\(\PageIndex{3}\)). El cianuro de hidrógeno es un buen solvente para compuestos polares debido a su alta permitividad (∈ r) y alto momento dipolar (2.98 D).
En solución acuosa el cianuro de hidrógeno es un ácido débil, (7.4.7), y se conocen varias sales. Sin embargo, el HCN también reacciona con el agua para dar formiato amónico vía formamida, (7.4.8).
\[ \text{HCN + H}_2\text{O} \rightleftharpoons \text{H}_3\text{O}^+ \text{ + CN}^- \]
\[ \text{HCN + H}_2\text{O} \rightarrow \text{HC(O)NH}_2 \xrightarrow{\text{H}_2\text{O}} \text{HCO}_2^- \text{ + NH}_4^+\]
De manera similar a la relación del cianógeno con los halógenos, el anión cianuro (CN -) se considera un pseudo haluro (es decir, F -, Cl -, etc.), y como tal forma muchos compuestos de coordinación, por ejemplo, [Fe (CN) 6] 3- y [Ag (CN) 2 ] -.
Asesinato, ejecución y Holocausto
El cianuro de hidrógeno es fatal para los humanos debido a su inhibición de la enzima citocromo c oxidasa por el ion cianuro (CN -), lo que resulta en la detención de la respiración celular. Una concentración de 300 mg/m 3 matará en 10 minutos, mientras que 3200 mg/m 3 (ca. 3500 ppm) serán fatales en aproximadamente 1 minuto.
Los síntomas de intoxicación por cianuro parecen similares a un ataque al corazón y esto ha llevado a que sea el veneno de elección tanto para los escritores de misterio de asesinato ficticio como para el ex KGB (Konitet gosudarstvennoy bezopasnosti o Comité de Seguridad del Estado) y su predecesor SMERSH ( desde la contracción smert shpionam que significa muerte hasta espías) en la vida real. Posiblemente el uso más famoso del cianuro de hidrógeno para el asesinato fue el uso de una pistola de niebla atomizadora por parte del agente de la KGB Bohdan Stashynsky por el asesinato del escritor político ucraniano y anticomunista Lev Rebet en 1957, y posteriormente en 1959 el del compañero ucraniano, Stepan Bandera. En ambos casos la intención era inducir un paro cardíaco y hacer que pareciera que la víctima había muerto de un infarto.
Sin duda el uso más notorio del cianuro de hidrógeno es en la forma del producto Zyklon B, el cual fue desarrollado originalmente como insecticida. El Dr. Walter Heerdt encontró que el cianuro de hidrógeno podría ser absorbido sobre sustratos como pellets absorbentes (por ejemplo, sílice), fibras o tierra de diatomeas (Figura\(\PageIndex{4}\)). Si bien es estable en un recipiente hermético, una vez abierto se libera el cianuro de hidrógeno. La “B” en el nombre comercial proviene del nombre alemán para ácido prúsico (el nombre común para cianuro de hidrógeno), es decir, Blausäure que significa ácido azul.

El primer uso al por mayor de Zyklon B fue en realidad en Estados Unidos donde se utilizó ya en 1929 para desinfectar los trenes de carga y telas de los inmigrantes mexicanos que ingresaban a Estados Unidos. El primer uso de Zyklon B en los campos de concentración durante la Segunda Guerra Mundial fue para un propósito similar (en particular para el deshuesado para controlar el tifus); sin embargo, para su uso como insecticida, Zyklon B contenía un odorante de advertencia. La fabricación deliberada de Zyklon B sin el odorante resultó en el material que se utilizó en un grupo de 250 niños gitanos en el campo de concentración de Buchenwald a principios de 1940. Posteriormente, en septiembre de 1940, un número similar de prisioneros de guerra polacos enfermos y 600 prisioneros de guerra soviéticos fueron asesinados en Auschwitz (Figura\(\PageIndex{5}\)). Una vez realizadas estas horribles pruebas, se logró el asesinato sistemático de millones de personas, entre ellos judíos, gitanos y homosexuales, utilizando Zyklon B en Auschwitz, Majdanek, Sachsenhausen y uno de los campamentos de la Operación Reinhard. Es apropiado que muchos de los propios arquitectos del Holocausto murieran de cianuro, entre ellos: Adolf Hitler (además de una bala), Joseph Goebbles, Hermann Göring y Heinrich Himmler.

A pesar del horror asociado con el uso del cianuro de hidrógeno para el Holocausto, fue utilizado por 11 estados estadounidenses para la pena de muerte (Figura\(\PageIndex{6}\)). Arizona, Maryland y Missouri retienen la cámara de gas como método secundario de ejecución aunque tienen inyección letal como método principal. Los pellets de cianuro de potasio (KCN) se colocan en un compartimento directamente debajo de la silla en la cámara de gas. El condenado es entonces atado a la silla, y se sella la cámara hermética. Luego se vierte ácido sulfúrico concentrado (H 2 SO 4) por un tubo sobre los pellets de cianuro para generar cianuro de hidrógeno, (7.4.7). La ejecución por cámara de gas resulta especialmente desagradable para los testigos de la ejecución debido a las respuestas físicas exhibidas durante el proceso de muerte, entre ellas: convulsiones y babeo excesivo.

Bibliografía
- J. Wu y N. J. Evans, Astrophys. J., 2003, 592, L79.


